名校
解题方法
1 . A、B、C、D、E为原子序数依次增大的前四周期元素。A是半径最小的元素,B的价电子层中有3个未成对电子;C与D同主族;E的最外层只有1个电子,但次外层有18个电子。五种元素形成的离子化合物可表示为 。下列说法错误的是
。下列说法错误的是
 。下列说法错误的是
。下列说法错误的是A. 中含有 中含有 键数目为26 键数目为26 |
B.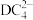 呈正四面体形 呈正四面体形 |
C.该化合物受热分解时首先失去的是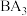 |
| D.A与B、C均可形成含有非极性共价键的化合物 |
您最近一年使用:0次
名校
解题方法
2 . 物质的结构决定其性质。下列实例与解释正确且相符的是
A.摩尔质量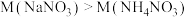 ,因此 ,因此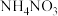 的熔点低于 的熔点低于 |
B.根据基团种类不同,推断酸性: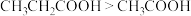 |
C. 分子间氢键数目多于HF,因此水的沸点高于氟化氢 分子间氢键数目多于HF,因此水的沸点高于氟化氢 |
| D.碘的非金属性较弱,因此碘的熔沸点较低 |
您最近一年使用:0次
名校
解题方法
3 . 下列说法中正确的是
| A.碳化硅的熔点低于金刚石 | B. 是非极性分子 是非极性分子 |
C. 的空间构型为平面三角形 的空间构型为平面三角形 | D.ⅥA族元素氢化物的沸点从上到下依次升高 |
您最近一年使用:0次
4 . 亚硝酸钠( )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。
(1)滴入浓硝酸前先通入一段时间的 ,目的是
,目的是___________ 。
(2)B中发生反应的化学方程式为___________ 、___________ 。
(3)C中试剂是___________ (填名称)。
(4)装置E的作用是___________ 。
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:___________ 。
(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ. 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ. 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: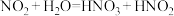 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。
ⅲ. 离子颜色为绿色。
离子颜色为绿色。
猜想1: 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色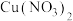 溶液混合而呈现绿色。
溶液混合而呈现绿色。
猜想2: 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。
①向浓硝酸中通入 ,溶液呈黄色,加入
,溶液呈黄色,加入___________ (填化学式)后呈绿色,证实猜想1合理。
②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。 的证据是
的证据是___________ 。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:___________ 。
 )常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。
)常用作食品防腐剂,实验室常用NO和过氧化钠反应制得。 是白色粉末,易溶于水。
是白色粉末,易溶于水。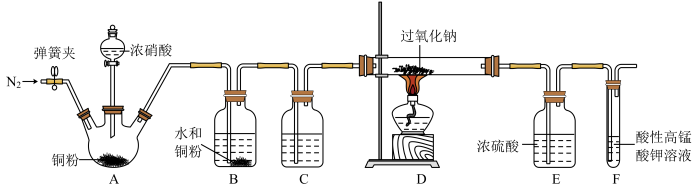
(1)滴入浓硝酸前先通入一段时间的
 ,目的是
,目的是(2)B中发生反应的化学方程式为
(3)C中试剂是
(4)装置E的作用是
(5)观察到F中溶液由紫红色变为无色,经检验氧化产物是
 ,还原产物是
,还原产物是 。写出F中发生反应的离子方程式:
。写出F中发生反应的离子方程式:(6)实验结束后小组同学发现装置A中浓硝酸有剩余,溶液呈绿色,针对这一现象提出猜想。
查阅资料:
ⅰ.
 溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;ⅱ.
 与水反应时会有部分发生反应:
与水反应时会有部分发生反应: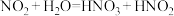 ,
, 是弱酸,无色,不稳定。
是弱酸,无色,不稳定。ⅲ.
 离子颜色为绿色。
离子颜色为绿色。猜想1:
 溶于浓硝酸,与蓝色
溶于浓硝酸,与蓝色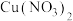 溶液混合而呈现绿色。
溶液混合而呈现绿色。猜想2:
 电离出的
电离出的 与
与 结合为
结合为 (绿色)。
(绿色)。①向浓硝酸中通入
 ,溶液呈黄色,加入
,溶液呈黄色,加入②研究猜想2是否为所得溶液呈绿色的主要原因,实验如下。
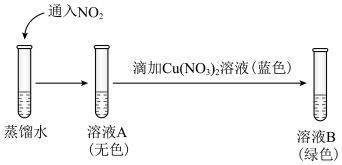
 的证据是
的证据是b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验Ⅰ所得溶液呈绿色的主要原因,说明理由:
您最近一年使用:0次
名校
解题方法
5 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)金属氢化物是一类常用的储氢剂。氢化钠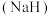 的晶体类型为
的晶体类型为___________ , 与
与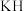 相比,熔点更高的是
相比,熔点更高的是___________ 。
(2)钛系贮氢合金中的钛锰合金,吸氢量更大,室温下易活化,基态锰原子的价层电子排布式为___________ 。与锰同周期且价层电子数相同的元素基态原子的价电子排布图为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度
(氨硼烷)具有很高的储氢容量及相对低的放氢温度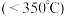 而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。
①与 同周期元素中,第一电离能大于
同周期元素中,第一电离能大于 的元素有
的元素有___________ 种(填数字)。
②氨硼烷中的共价键可以分为两种,这两种共价键的数量比为___________ 。
③氨硼烷中的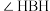
___________ (填“ ”、“
”、“ ”或“
”或“ ”)
”) 中的
中的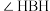 ,理由是
,理由是___________ 。
(4)咔唑(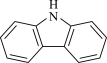 )是一种新型有机液体储氢材料,
)是一种新型有机液体储氢材料, 咔唑中含有的
咔唑中含有的 键的数目为
键的数目为___________ (设阿伏加德罗常数的值为 )。已知咔唑分子中
)。已知咔唑分子中 原子连接的
原子连接的 与两个苯环共平面,则分子中
与两个苯环共平面,则分子中 原子的杂化类型是
原子的杂化类型是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示,该晶体储氢时, 分子在晶胞的体心和棱心位置。
分子在晶胞的体心和棱心位置。 原子最近的
原子最近的 分子个数是
分子个数是___________ 。
②该晶体未储氢时的密度为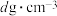 ,则铁原子的半径为
,则铁原子的半径为___________  。
。
(用含 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 ,假设晶胞中邻近的铁原子相切)
,假设晶胞中邻近的铁原子相切)
(1)金属氢化物是一类常用的储氢剂。氢化钠
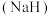 的晶体类型为
的晶体类型为 与
与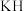 相比,熔点更高的是
相比,熔点更高的是(2)钛系贮氢合金中的钛锰合金,吸氢量更大,室温下易活化,基态锰原子的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度
(氨硼烷)具有很高的储氢容量及相对低的放氢温度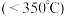 而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成。
进行合成。①与
 同周期元素中,第一电离能大于
同周期元素中,第一电离能大于 的元素有
的元素有②氨硼烷中的共价键可以分为两种,这两种共价键的数量比为
③氨硼烷中的
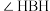
 ”、“
”、“ ”或“
”或“ ”)
”) 中的
中的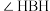 ,理由是
,理由是(4)咔唑(
 )是一种新型有机液体储氢材料,
)是一种新型有机液体储氢材料, 咔唑中含有的
咔唑中含有的 键的数目为
键的数目为 )。已知咔唑分子中
)。已知咔唑分子中 原子连接的
原子连接的 与两个苯环共平面,则分子中
与两个苯环共平面,则分子中 原子的杂化类型是
原子的杂化类型是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示,该晶体储氢时,
 分子在晶胞的体心和棱心位置。
分子在晶胞的体心和棱心位置。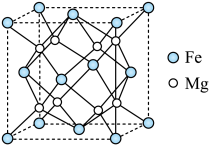
 原子最近的
原子最近的 分子个数是
分子个数是②该晶体未储氢时的密度为
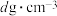 ,则铁原子的半径为
,则铁原子的半径为 。
。(用含
 的代数式表示,阿伏加德罗常数的值为
的代数式表示,阿伏加德罗常数的值为 ,假设晶胞中邻近的铁原子相切)
,假设晶胞中邻近的铁原子相切)
您最近一年使用:0次
解题方法
6 . 已知某物质X能发生如下转化:

| A.若X为NH3,则A为硝酸 |
| B.若X为H2S,则A为亚硫酸或者硫酸 |
| C.若X为非金属单质或非金属氢化物,则A一定能与金属铜反应生成Y |
| D.反应①和②一定为氧化还原反应,反应③有可能为非氧化还原反应 |
您最近一年使用:0次
名校
解题方法
7 . 某学生对 与漂粉精的反应进行实验探究,观察到如下实验现象,下列说法中不正确的是
与漂粉精的反应进行实验探究,观察到如下实验现象,下列说法中不正确的是
 与漂粉精的反应进行实验探究,观察到如下实验现象,下列说法中不正确的是
与漂粉精的反应进行实验探究,观察到如下实验现象,下列说法中不正确的是
| ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
| A.用pH试纸测漂粉精溶液的pH,试纸先变蓝后褪色,说明溶液具有碱性、漂白性 |
B.溶液变为黄绿色的原因可能是: |
C.用酸化的 溶液检验白雾,产生白色沉淀,说明白雾中含有 溶液检验白雾,产生白色沉淀,说明白雾中含有 |
D.产生的白色沉淀不溶于稀 ,则该沉淀是 ,则该沉淀是 |
您最近一年使用:0次
2024-04-04更新
|
377次组卷
|
2卷引用:天津市第二十中学2023-2024学年高一下学期学情调研(二)(期中)化学试卷
名校
解题方法
8 . 向一定质量的Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250mL,当固体物质完全溶解后生成Cu(NO3)2和2.24LNO气体(标况下)。在所得溶液中加入0.5mol/L的NaOH溶液1.0L,生成沉淀的质量为19.6g,此时溶液呈中性且铜离子已完全沉淀。下列有关说法正确的是
| A.Cu、Cu2O与硝酸反应后剩余的HNO3为0.1mol |
| B.原稀硝酸中HNO3的物质的量浓度为2.6mol/L |
| C.铜离子刚好沉淀完全,溶液中溶质为NaNO3,浓度为0.5mol/L |
| D.原固体混合物中Cu和Cu2O的物质的量之比为1:2 |
您最近一年使用:0次
2024-04-02更新
|
322次组卷
|
3卷引用:天津市第二十中学2023-2024学年高一下学期学情调研(二)(期中)化学试卷
名校
解题方法
9 . 利用微生物燃料电池(MFC)可以将废水中的 降解为N2。某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
降解为N2。某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
 降解为N2。某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是
降解为N2。某课题组设计出如图所示的微生物燃料电池进行同步硝化和反硝化脱氮研究,下列说法不正确的是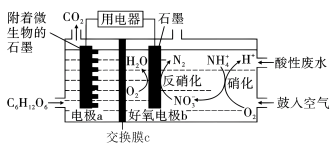
A.好氧电极b上发生的反硝化反应为2 +10e-+12H+=N2↑+6H2O +10e-+12H+=N2↑+6H2O |
| B.好氧电极b上的副反应为O2+4e-+4H+=2H2O |
| C.交换膜c为质子交换膜,质子从电极a区域通过质子交换膜移向电极b区域 |
D.理论上每消耗1molC6H12O6,可以处理 的物质的量为4.8mol 的物质的量为4.8mol |
您最近一年使用:0次
2024-04-02更新
|
1129次组卷
|
4卷引用:天津市第二十中学2023-2024学年高一下学期学情调研(二)(期中)化学试卷
10 . 实验室制取A并进一步制取无水FeCl3的实验装置如图所示。
已知:无水FeCl3在空气中易与水发生作用,加热易升华。
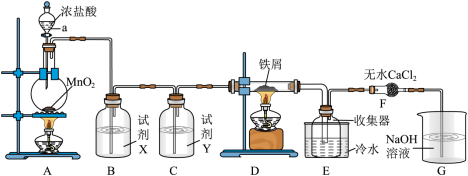
回答下列问题:
(1)仪器a的名称是_______ ,装置A所发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为_______ 。
(2)试剂X是_______ 。
(3)装置F中无水CaCl2的作用是_______
(4)某温度下,将氯气通入G装置中,反应得到NaCl,NaClO和NaClO3的混合溶液,经测定ClO-与ClO 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______ 。
已知:无水FeCl3在空气中易与水发生作用,加热易升华。

回答下列问题:
(1)仪器a的名称是
(2)试剂X是
(3)装置F中无水CaCl2的作用是
(4)某温度下,将氯气通入G装置中,反应得到NaCl,NaClO和NaClO3的混合溶液,经测定ClO-与ClO
 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近一年使用:0次




