解题方法
1 . 钙钛矿是指通式为 的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
Ⅰ.最早发现的钙钛矿石中含 的立方晶胞如图1所示。
的立方晶胞如图1所示。
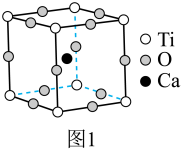
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ , 中组成元素的电负性大小顺序是
中组成元素的电负性大小顺序是___________ 。
(2)金属离子与氧离子之间的化学键为___________ 。
(3)晶胞中与 距离最近且相等的
距离最近且相等的 数目为
数目为___________ 。
Ⅱ.一种立方钙钛矿结构的金属卤化物光电材料的组成为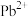 、
、 和有机碱离子
和有机碱离子 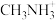 ,其晶胞如图2所示。
,其晶胞如图2所示。
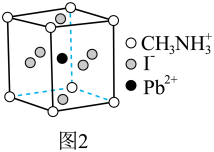
(4)图1中与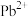 具有相同的空间位置的微粒是
具有相同的空间位置的微粒是
(5)有机碱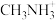 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是___________ 。
(6)若晶胞参数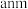 ,则晶体密度为
,则晶体密度为___________ 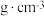 (用
(用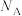 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕 盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
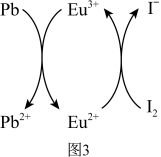
(7)用离子方程式表示该原理___________ 、___________ 。
 的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。Ⅰ.最早发现的钙钛矿石中含
 的立方晶胞如图1所示。
的立方晶胞如图1所示。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 中组成元素的电负性大小顺序是
中组成元素的电负性大小顺序是(2)金属离子与氧离子之间的化学键为
(3)晶胞中与
 距离最近且相等的
距离最近且相等的 数目为
数目为Ⅱ.一种立方钙钛矿结构的金属卤化物光电材料的组成为
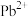 、
、 和有机碱离子
和有机碱离子 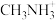 ,其晶胞如图2所示。
,其晶胞如图2所示。
(4)图1中与
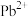 具有相同的空间位置的微粒是
具有相同的空间位置的微粒是A. | B.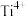 | C. | D.无 |
(5)有机碱
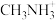 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是(6)若晶胞参数
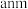 ,则晶体密度为
,则晶体密度为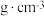 (用
(用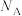 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕
 盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
(7)用离子方程式表示该原理
您最近一年使用:0次
解题方法
2 . 含氯消毒剂在生产、生活中被广泛用于杀菌、消毒和漂白。常见的含氯消毒剂有84消毒液、漂白粉、二氯异氰尿酸钠、三氯异氰尿酸等。
(1)84消毒液的有效成分为___________ (填编号)。
A.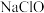 B.
B. C.
C.
实验原理为:
二氯异氟尿酸钠为白色固体,难溶于冷水,是一种高效、安全的氧化性消毒剂。实验室可用如图所示装置制备(夹持装置已略去)。

(2)①仪器 中侧管的作用为
中侧管的作用为___________ 。
②装置A中的药品可以选择___________ 。(填编号)
A.浓硫酸 B. C.
C. D.漂白粉
D.漂白粉
(3)①实验后发现装置B中 溶液的利用率较低,改进的方法是
溶液的利用率较低,改进的方法是___________ 。
②当从装置B中观察到___________ 时,加入 的吡啶溶液。实验过程中B的温度必须保持在
的吡啶溶液。实验过程中B的温度必须保持在 控制在
控制在 ,则该实验的受热方式是
,则该实验的受热方式是___________ 。
③反应结束后,装置B中的悬浊液,经过滤、___________ 、干燥,得粗产品二氯异氰尿酸钠。
有效氯是二氯异氰尿酸钠产品质量的重要指标。通过下列步骤可检测二氯异氰尿酸钠样品的有效氯。
(a)准确称取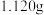 样品,用容量瓶配成
样品,用容量瓶配成 溶液;
溶液;
(b)取 上述溶液于碘量瓶中,加入适量稀硫酸和过量
上述溶液于碘量瓶中,加入适量稀硫酸和过量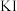 溶液,密封,在暗处静置
溶液,密封,在暗处静置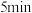 ;
;
(c)用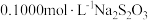 标准溶液滴定至溶液呈微黄色,加入淀粉,继续滴定至终点,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉,继续滴定至终点,平均消耗 溶液的体积为
溶液的体积为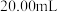 。
。
已知:
ⅰ.部分反应: 、
、
ⅱ.
(4)①步骤(1)中使用的容量瓶是否需要进行干燥___________ 。(填“是”或“否”)
②该样品的有效氯测定值
___________ 。(结果保留两位小数)
③滴定至溶液蓝色刚好褪去,振荡后又恢复,此时停止滴定可能会导致样品的有效氯测定值___________ 。(填“偏高”或“偏低”或“无影响”)
(1)84消毒液的有效成分为
A.
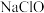 B.
B. C.
C.
实验原理为:

二氯异氟尿酸钠为白色固体,难溶于冷水,是一种高效、安全的氧化性消毒剂。实验室可用如图所示装置制备(夹持装置已略去)。

(2)①仪器
 中侧管的作用为
中侧管的作用为②装置A中的药品可以选择
A.浓硫酸 B.
 C.
C. D.漂白粉
D.漂白粉(3)①实验后发现装置B中
 溶液的利用率较低,改进的方法是
溶液的利用率较低,改进的方法是②当从装置B中观察到
 的吡啶溶液。实验过程中B的温度必须保持在
的吡啶溶液。实验过程中B的温度必须保持在 控制在
控制在 ,则该实验的受热方式是
,则该实验的受热方式是③反应结束后,装置B中的悬浊液,经过滤、
有效氯是二氯异氰尿酸钠产品质量的重要指标。通过下列步骤可检测二氯异氰尿酸钠样品的有效氯。
(a)准确称取
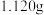 样品,用容量瓶配成
样品,用容量瓶配成 溶液;
溶液;(b)取
 上述溶液于碘量瓶中,加入适量稀硫酸和过量
上述溶液于碘量瓶中,加入适量稀硫酸和过量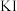 溶液,密封,在暗处静置
溶液,密封,在暗处静置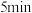 ;
;(c)用
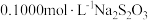 标准溶液滴定至溶液呈微黄色,加入淀粉,继续滴定至终点,平均消耗
标准溶液滴定至溶液呈微黄色,加入淀粉,继续滴定至终点,平均消耗 溶液的体积为
溶液的体积为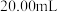 。
。已知:
ⅰ.部分反应:
 、
、
ⅱ.

(4)①步骤(1)中使用的容量瓶是否需要进行干燥
②该样品的有效氯测定值

③滴定至溶液蓝色刚好褪去,振荡后又恢复,此时停止滴定可能会导致样品的有效氯测定值
您最近一年使用:0次
名校
3 . 常温下,用 的
的 标准溶液滴定同浓度
标准溶液滴定同浓度 的
的 溶液。已知:草酸
溶液。已知:草酸 ,
,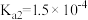 ;一水合氨
;一水合氨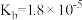 。下列说法不正确的是
。下列说法不正确的是
 的
的 标准溶液滴定同浓度
标准溶液滴定同浓度 的
的 溶液。已知:草酸
溶液。已知:草酸 ,
,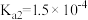 ;一水合氨
;一水合氨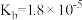 。下列说法不正确的是
。下列说法不正确的是A.滴定过程中,溶液中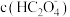 逐渐减小 逐渐减小 |
B. 时: 时: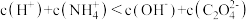 |
C. 时: 时: |
D. 分别为 分别为 和 和 时水的电离程度:前者>后着 时水的电离程度:前者>后着 |
您最近一年使用:0次
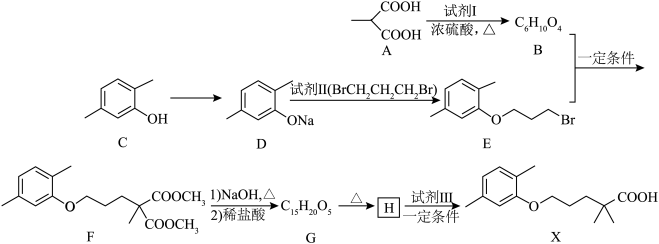
4 . 化合物X是一种临床治疗高血脂症的药物。X的合成路线如下(部分反应条件和试剂略)。
(1)试剂Ⅱ的化学名称是_______ 。
(2)F含有的官能团名称是_______ 。
(3)1molC与溴水反应,最多消耗_______ mol 。
。
(4)H的结构简式是_______ 。
(5)试剂Ⅲ为单碘代烷烃,其结构简式是_______ 。
(6)试剂I蒸气密度是相同状态下甲烷密度的2倍,试剂I中各元素的质量分数分别为:碳37.5%,氢12.5%,氧50%。试剂I的结构简式是_______ 。
(7)A与乙二醇在催化剂的作用下发生聚合反应的化学方程式是_______ 。
(8)HOOCCOOH与A互为同系物,写出以乙醇为原料(其他无机试剂任选)制备HOOCCOOH的合成路线:_______ 。
已知: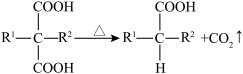 (
( 和
和 代表烷基)
代表烷基)
(1)试剂Ⅱ的化学名称是
(2)F含有的官能团名称是
(3)1molC与溴水反应,最多消耗
 。
。(4)H的结构简式是
(5)试剂Ⅲ为单碘代烷烃,其结构简式是
(6)试剂I蒸气密度是相同状态下甲烷密度的2倍,试剂I中各元素的质量分数分别为:碳37.5%,氢12.5%,氧50%。试剂I的结构简式是
(7)A与乙二醇在催化剂的作用下发生聚合反应的化学方程式是
(8)HOOCCOOH与A互为同系物,写出以乙醇为原料(其他无机试剂任选)制备HOOCCOOH的合成路线:
您最近一年使用:0次
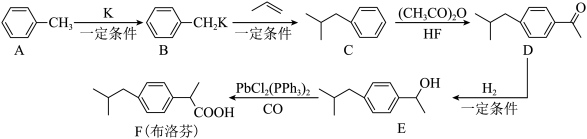
5 . 布洛芬可有效缓解发烧和全身酸痛。其合成路线如下:
(1)A的名称是___________ 。
(2)布洛芬中官能团的名称为___________ 。
(3)E的分子式为___________ 。
(4)C→D的反应类型为___________ 。
(5)由A制备TNT(三硝基甲苯)的化学方程式为___________ 。
(6)终止剂可将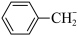 转化为
转化为 ,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是
,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是___________ (填序号)。
a. b.
b. c.
c.
(7)M与F(布洛芬)互为同系物,M分子中有8个C原子,写出符合下列条件的M的同分异构体的结构简式___________ 。
①属于芳香族化合物
②能发生银镜反应,也能发生水解反应
③核磁共振氢谱有4组峰且峰面积之比为1∶2∶2∶3
(8)根据要求,补齐由布洛芬合成缓释布洛芬的流程。___________ ,条件①:___________ ,物质Y的结构简式:___________ 。
(1)A的名称是
(2)布洛芬中官能团的名称为
(3)E的分子式为
(4)C→D的反应类型为
(5)由A制备TNT(三硝基甲苯)的化学方程式为
(6)终止剂可将
 转化为
转化为 ,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是
,从而使B→C反应终止,下列物质中最适合作为终止剂的物质是a.
 b.
b. c.
c.
(7)M与F(布洛芬)互为同系物,M分子中有8个C原子,写出符合下列条件的M的同分异构体的结构简式
①属于芳香族化合物
②能发生银镜反应,也能发生水解反应
③核磁共振氢谱有4组峰且峰面积之比为1∶2∶2∶3
(8)根据要求,补齐由布洛芬合成缓释布洛芬的流程。

您最近一年使用:0次
6 . 常温下,浓度均为0.1mol/L的三种溶液:① ②
② ③
③ ,下列说法正确的是
,下列说法正确的是
 ②
② ③
③ ,下列说法正确的是
,下列说法正确的是A.溶液①: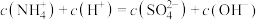 |
B.溶液②: |
C.溶液③: |
D.三种溶液中,②中的 浓度最大 浓度最大 |
您最近一年使用:0次
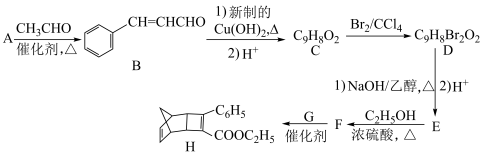
7 . 化合物H是一种有机光电材料中间体。实验室由芳香醛A制备H的一种合成路线如下。
(1)H中所含官能团的名称为___________ 。
(2)B与新制的 反应的化学方程式为
反应的化学方程式为___________ 。
(3)C生成D和E生成F的反应类型分别是___________ 、___________ 。
(4)D与 的乙醇溶液反应的化学方程式为
的乙醇溶液反应的化学方程式为___________ 。
(5)F的结构简式为___________ 。
(6)G的结构为 ,其分子式为
,其分子式为___________ 。
(7)写出用A为原料(其他无机试剂任选)制备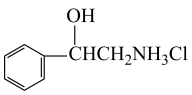 的合成路线:
的合成路线:___________ 。
已知: 。
。
(1)H中所含官能团的名称为
(2)B与新制的
 反应的化学方程式为
反应的化学方程式为(3)C生成D和E生成F的反应类型分别是
(4)D与
 的乙醇溶液反应的化学方程式为
的乙醇溶液反应的化学方程式为(5)F的结构简式为
(6)G的结构为
 ,其分子式为
,其分子式为(7)写出用A为原料(其他无机试剂任选)制备
 的合成路线:
的合成路线:
您最近一年使用:0次
8 . 二氧化钒( )是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以
)是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(
的氧钒( )碱式碳酸铵晶体。过程如下:
)碱式碳酸铵晶体。过程如下:
(1)步骤i中生成 的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
的同时还产生一种无色无污染的气体,所发生反应的化学方程式为___________ 。只用浓盐酸与 反应也能制备
反应也能制备 溶液,从安全与环保角度分析,该反应不被推广的主要原因是
溶液,从安全与环保角度分析,该反应不被推广的主要原因是___________ 。
(2)步骤ii可用如图仪器组装完成。___________ (用各接口字母表示)。
②B装置的作用是___________ 。
③反应结束后,将三颈烧瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是___________ ,用无水乙醇洗涤的目的是___________ 。
(3)测定氧钒( )碱式碳酸铵晶体粗产品中钒的含量。
)碱式碳酸铵晶体粗产品中钒的含量。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%  溶液至稍过量。再用尿素除去过量的
溶液至稍过量。再用尿素除去过量的 ,滴入几滴铁氰化钾{
,滴入几滴铁氰化钾{ }溶液,最后用c mol/L
}溶液,最后用c mol/L  标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
标准溶液滴定至终点,消耗体积为b mL。滴定反应为: 。
。
① 溶液的作用是
溶液的作用是___________ 。
②粗产品中钒的质量分数的表达式为___________ 。
 )是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以
)是一种新型热敏材料,+4价的钒化合物在弱酸性条件下易被氧化,实验室以 为原料合成用于制备
为原料合成用于制备 的氧钒(
的氧钒( )碱式碳酸铵晶体。过程如下:
)碱式碳酸铵晶体。过程如下:
(1)步骤i中生成
 的同时还产生一种无色无污染的气体,所发生反应的化学方程式为
的同时还产生一种无色无污染的气体,所发生反应的化学方程式为 反应也能制备
反应也能制备 溶液,从安全与环保角度分析,该反应不被推广的主要原因是
溶液,从安全与环保角度分析,该反应不被推广的主要原因是(2)步骤ii可用如图仪器组装完成。
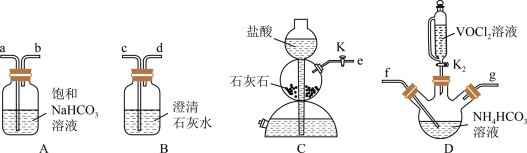
②B装置的作用是
③反应结束后,将三颈烧瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和
 溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和
溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和 溶液洗涤除去的阴离子主要是
溶液洗涤除去的阴离子主要是(3)测定氧钒(
 )碱式碳酸铵晶体粗产品中钒的含量。
)碱式碳酸铵晶体粗产品中钒的含量。称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L
 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1%  溶液至稍过量。再用尿素除去过量的
溶液至稍过量。再用尿素除去过量的 ,滴入几滴铁氰化钾{
,滴入几滴铁氰化钾{ }溶液,最后用c mol/L
}溶液,最后用c mol/L  标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
标准溶液滴定至终点,消耗体积为b mL。滴定反应为: 。
。①
 溶液的作用是
溶液的作用是②粗产品中钒的质量分数的表达式为
您最近一年使用:0次
2024高三·全国·专题练习
解题方法
9 . Co3O4在磁性材料、电化学领域应用广泛,实验室中可以用CoCO3或CoC2O4煅烧后制得。利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的流程如下:
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为_______ 。
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是_______ 。
(3)检验CoC2O4固体是否洗净的实验操作是_______ 。
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
计算样品中草酸钴晶体(CoC2O4·2H2O)的质量分数_______ (写出计算过程)。
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,_______ 。
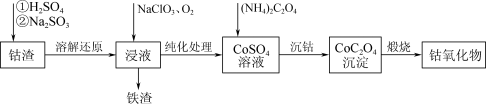
(1)“溶解还原”过程中Co(OH)3发生反应的离子方程式为
(2)“沉钴”时,不能用Na2C2O4溶液代替(NH4)2C2O4溶液,原因是
(3)检验CoC2O4固体是否洗净的实验操作是
(4)为测定某草酸钴样品中草酸钴晶体(CoC2O4·2H2O)的质量分数进行如下实验:
①取草酸钴(CoC2O4·2H2O,摩尔质量为183g·mol-1)样品3.660g,加入100.00mL0.1000mol·L-1酸性KMnO4溶液,加热(该条件下Co2+不被氧化)。
②充分反应后将溶液冷却至室温,加入250mL容量瓶中,定容。
③取25.00mL溶液,用0.1000mol·L-1FeSO4溶液滴定。
④重复步骤③的实验两次,三次测定数据如下:
| 实验序号 | 1 | 2 | 3 |
| 消耗FeSO4标准溶液体积/mL | 18.32 | 18.02 | 17.98 |
(5)以尿素为原料可获得CoCO3并制备Co3O4.已知:尿素水溶液在70℃以上能缓慢水解产生
 ,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
,在pH为1~3时水解速率对生成CoCO3沉淀较为适宜。设计以CoCl2溶液、尿素粉末、盐酸为原料,制备Co3O4的实验方案:取一定体积CoCl2溶液,
您最近一年使用:0次
2024高三·全国·专题练习
10 . 工业上利用黄铁矿(主要成分是FeS2)生产硫酸,同时得到烧渣(主要成分为Fe2O3、少量SiO2和Al2O3),为了“变废为宝”,通过下列生产流程可将烧渣转化为绿矾(FeSO4·7H2O)产品:
(1)滤渣能溶于NaOH,写出该反应的化学方程式:___________ 。
(2)检验“还原”是否完全的实验方法是___________ 。
(3)设计将“还原液”转化为绿矾晶体的实验操作:___________ 得绿矾晶体(在实验过程中须用试剂:FeCO3·H2O、乙醚)。
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:___________ 。
②计算该样品的纯度________ (写出计算过程)。

| 金属离子 | 开始沉淀的pH | 完全沉淀的pH | 沉淀开始溶解的pH | 沉淀完全溶解的pH |
| Fe2+ | 7.6 | 9.6 | / | / |
| Fe3+ | 2.7 | 3.7 | / | / |
| Al3+ | 4.0 | 5.2 | 7.8 | 10.8 |
(2)检验“还原”是否完全的实验方法是
(3)设计将“还原液”转化为绿矾晶体的实验操作:
(4)检测所得绿矾(FeSO4·7H2O)产品的纯度,称取35.00g样品,配成250mL溶液,取25.00mL所配溶液放入锥形瓶中,然后滴加0.1000mol·L-1的酸性高锰酸钾溶液,至恰好完全反应时用去21.00mL。
①已知酸性高锰酸钾反应时有Mn2+生成,写出该反应的离子方程式:
②计算该样品的纯度
您最近一年使用:0次



