名校
1 . 下列指定反应的离子方程式书写正确的是
A.NO2与水反应: |
B.氨水吸收足量SO2的反应: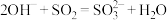 |
C.过量Fe和稀HNO3的反应: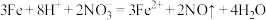 |
D.向 溶液中通入少量SO2: 溶液中通入少量SO2: |
您最近一年使用:0次
名校
2 . 二氧化硫对环境有一定的负面影响,对 的处理和利用是科学研究的重要课题之一。
的处理和利用是科学研究的重要课题之一。
 .用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下:
.用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下: 的一种常用方法,其总反应的化学方程式为
的一种常用方法,其总反应的化学方程式为___________ 。
②研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示。___________ 。
a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率
d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(2)生产中,需要向反应的溶液中加入适量强还原剂,其目的是___________ 。
(3)反应 所得的滤液中所含阳离子的电子式为
所得的滤液中所含阳离子的电子式为___________ ,检验该滤液中所含阴离子的方法是:取少量滤液于试管中,___________ 。
(4)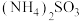 可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用
可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用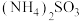 溶液吸收NO的离子方程式
溶液吸收NO的离子方程式___________ 。
 .
. 还原法也是处理硫酸厂废气的方法之一、400℃时,将
还原法也是处理硫酸厂废气的方法之一、400℃时,将 和含
和含 的尾气按一定比例混合,以一定流速通过装有
的尾气按一定比例混合,以一定流速通过装有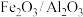 的负载型催化剂(
的负载型催化剂( 为催化剂,
为催化剂, 为载体),发生反应。
为载体),发生反应。
(5)该反应生成s单质和水,其中氧化剂和还原剂的物质的量之比为___________ 。
 的处理和利用是科学研究的重要课题之一。
的处理和利用是科学研究的重要课题之一。 .用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下:
.用石灰石、氨水等脱硫。以硫酸工业的二氧化硫尾气、氨水、石灰石、碳酸氢铵和氯化钾等为原料,可以制备有重要应用价值的硫酸钾、亚硫酸铵等物质,制备流程如下:
 的一种常用方法,其总反应的化学方程式为
的一种常用方法,其总反应的化学方程式为②研究发现,pH和温度对石灰石浆液的脱硫效率有一定影响。当烟气通入速度一定时,石灰石浆液的脱硫率与浆液pH的关系如图所示。

a.烟气通入石灰石浆液时的温度越高,吸收越快,吸收率越高
b.反应时需鼓入足量的空气以保证
 被充分氧化生成
被充分氧化生成
c.将脱硫后的气体通入
 溶液,可粗略判断烟气脱硫效率
溶液,可粗略判断烟气脱硫效率d.石灰石浆液pH>5.7烟气脱硫效果降低,是因为石灰石的溶解程度增大
(2)生产中,需要向反应的溶液中加入适量强还原剂,其目的是
(3)反应
 所得的滤液中所含阳离子的电子式为
所得的滤液中所含阳离子的电子式为(4)
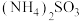 可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用
可用于电厂等烟道气中脱氮。将氮氧化物转化为氮气,同时生成一种氨肥。写出用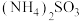 溶液吸收NO的离子方程式
溶液吸收NO的离子方程式 .
. 还原法也是处理硫酸厂废气的方法之一、400℃时,将
还原法也是处理硫酸厂废气的方法之一、400℃时,将 和含
和含 的尾气按一定比例混合,以一定流速通过装有
的尾气按一定比例混合,以一定流速通过装有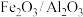 的负载型催化剂(
的负载型催化剂( 为催化剂,
为催化剂, 为载体),发生反应。
为载体),发生反应。(5)该反应生成s单质和水,其中氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
3 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。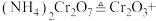
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)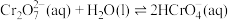
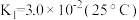
(ⅱ)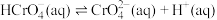

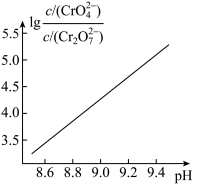
 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时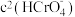 与
与 的比值保持不变
的比值保持不变
②25℃时,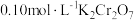 溶液中
溶液中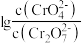 随pH的变化关系如图。当
随pH的变化关系如图。当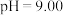 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
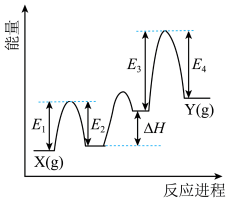
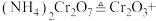
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
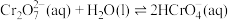
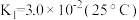
(ⅱ)
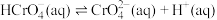

 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
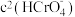 与
与 的比值保持不变
的比值保持不变②25℃时,
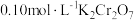 溶液中
溶液中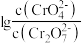 随pH的变化关系如图。当
随pH的变化关系如图。当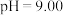 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度
您最近一年使用:0次
4 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
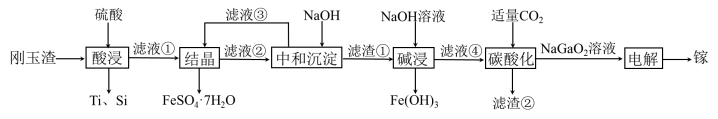
回答下列问题:
(1)镓原子结构示意图为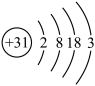 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
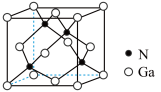
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为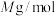 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为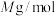 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
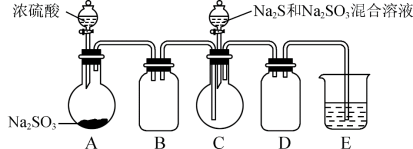
5 . 工业上常利用含硫废水生产Na2S2O3·5H2O,某小组同学用如下图装置(略去加热仪器等)模拟生产过程。
已知:
ⅰ.烧瓶C中发生反应如下:
Na2S(aq)+H2O(1)+SO2(g)=Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)=3S(s)+2H2O(1) (b)
S(s)+Na2SO3(aq) Na2S2O3(aq)(c)
Na2S2O3(aq)(c)
ⅱ.Na2S和Na2SO3能被空气中的O2氧化。
(1)A中发生的化学方程式为___________ 。C中反应前先通一会儿SO2的原因为___________ 。
(2)模拟实验的操作步骤(说明:仪器中旋塞或玻璃塞的开或关不必叙述):检查装置的气密性,并按图示加入试剂:向A烧瓶中分批滴加足量浓硫酸,___________ ,所得溶液经蒸发浓缩、冷却结晶、过滤洗涤、真空干燥后即得到产品。
(3)Na2S2O3常用作脱氯剂。
① 离子的空间构型为
离子的空间构型为___________ 。
②Na2S2O3溶液与足量Cl2反应产生 的离子方程式为
的离子方程式为___________ 。
(4)Na2SO3可以用于测定粗硒中硒的含量的操作步骤如下:
Ⅰ.用浓H2SO4将样品中的Se氧化为SeO2;
Ⅱ.用KI溶液还原SeO2为Se,同时生成I2;
Ⅲ.以淀粉为指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2 =2I-+
=2I-+ )。
)。
实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol/L的Na2S2O3溶液22.00mL,则粗硒样品中硒的质量分数为___________ (写出计算过程)。

已知:
ⅰ.烧瓶C中发生反应如下:
Na2S(aq)+H2O(1)+SO2(g)=Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)=3S(s)+2H2O(1) (b)
S(s)+Na2SO3(aq)
 Na2S2O3(aq)(c)
Na2S2O3(aq)(c)ⅱ.Na2S和Na2SO3能被空气中的O2氧化。
(1)A中发生的化学方程式为
(2)模拟实验的操作步骤(说明:仪器中旋塞或玻璃塞的开或关不必叙述):检查装置的气密性,并按图示加入试剂:向A烧瓶中分批滴加足量浓硫酸,
(3)Na2S2O3常用作脱氯剂。
①
 离子的空间构型为
离子的空间构型为②Na2S2O3溶液与足量Cl2反应产生
 的离子方程式为
的离子方程式为(4)Na2SO3可以用于测定粗硒中硒的含量的操作步骤如下:
Ⅰ.用浓H2SO4将样品中的Se氧化为SeO2;
Ⅱ.用KI溶液还原SeO2为Se,同时生成I2;
Ⅲ.以淀粉为指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2
 =2I-+
=2I-+ )。
)。实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol/L的Na2S2O3溶液22.00mL,则粗硒样品中硒的质量分数为
您最近一年使用:0次
名校
解题方法
6 . 84消毒液是一种常见的含氯消毒剂,广泛用于家庭、医院的消毒。某兴趣小组对84 消毒液的组成、性质与使用进行探究。所用试剂:84消毒液(含 )、医用酒精(乙醇体积分数为70~75%)
)、医用酒精(乙醇体积分数为70~75%)
Ⅰ.探究84消毒液的成分
(1)实测该84消毒液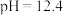 ,能使
,能使 试纸先变
试纸先变___________ 色后褪色,因此其成分中,除了 、
、 ,还含有少量
,还含有少量___________ (填化学式)。
(2)84消毒液露置于空气中,消毒效果先增强,而再将其光照后消毒效果又降低。消毒效果降低的原因是(用化学方程式表示)___________ 。
Ⅱ.探究84消毒液的性质与使用
(3)84消毒液具有氧化性,预测的依据是___________ 。巴西奥运会期间,由于工作人员将84消毒液与双氧水混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长该反应的化学方程式为
促进藻类快速生长该反应的化学方程式为___________ 。
Ⅲ.84消毒液能否与医用酒精混用实验装置如图所示
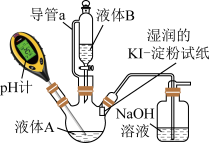
已知: 是常见的还原剂;单质碘(
是常见的还原剂;单质碘( )遇淀粉变蓝。
)遇淀粉变蓝。
(4)判断实验②中生成了 的依据是
的依据是___________ 。
(5)图中 溶液的作用是
溶液的作用是___________ 。
(6)实验过程中混合溶液的 逐渐增大至13.1,预测酒精与
逐渐增大至13.1,预测酒精与 反应还可能生成
反应还可能生成 ,但得补充以下实验③,才能说明反应中有
,但得补充以下实验③,才能说明反应中有 生成。填写表中空白完成实验设计。
生成。填写表中空白完成实验设计。
结论:医用酒精可与84消毒液发生反应,二者不可混用。
 )、医用酒精(乙醇体积分数为70~75%)
)、医用酒精(乙醇体积分数为70~75%)Ⅰ.探究84消毒液的成分
(1)实测该84消毒液
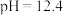 ,能使
,能使 试纸先变
试纸先变 、
、 ,还含有少量
,还含有少量(2)84消毒液露置于空气中,消毒效果先增强,而再将其光照后消毒效果又降低。消毒效果降低的原因是(用化学方程式表示)
Ⅱ.探究84消毒液的性质与使用
(3)84消毒液具有氧化性,预测的依据是
 与
与 反应产生
反应产生 促进藻类快速生长该反应的化学方程式为
促进藻类快速生长该反应的化学方程式为Ⅲ.84消毒液能否与医用酒精混用实验装置如图所示

已知:
 是常见的还原剂;单质碘(
是常见的还原剂;单质碘( )遇淀粉变蓝。
)遇淀粉变蓝。| 序号 | 液体A | 液体B | 现象 |
| ① |  ( (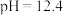 )的84消毒液 )的84消毒液 |  蒸馏水 蒸馏水 | 溶液中无明显现象;溶液 变为12.0;淀粉- 变为12.0;淀粉- 试纸在 试纸在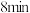 时变蓝, 时变蓝, 时蓝色完全褪去 时蓝色完全褪去 |
| ② |  ( (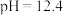 )的84消毒液 )的84消毒液 |  医用酒精 医用酒精 | 产生气泡,颜色无明显变化;溶液 升高到13.1,淀粉- 升高到13.1,淀粉- 试纸在 试纸在 时变蓝, 时变蓝,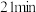 时蓝色完全褪去 时蓝色完全褪去 |
(4)判断实验②中生成了
 的依据是
的依据是(5)图中
 溶液的作用是
溶液的作用是(6)实验过程中混合溶液的
 逐渐增大至13.1,预测酒精与
逐渐增大至13.1,预测酒精与 反应还可能生成
反应还可能生成 ,但得补充以下实验③,才能说明反应中有
,但得补充以下实验③,才能说明反应中有 生成。填写表中空白完成实验设计。
生成。填写表中空白完成实验设计。| 序号 | 液体A | 液体B | 现象 |
| ③ |  ( (  溶液 溶液 |  医用酒精 医用酒精 | 溶液 升高到12.6 升高到12.6 |
您最近一年使用:0次
名校
解题方法
7 . 某同学类比镁在二氧化碳中的燃烧反应,认为钠和二氧化碳也可以发生反应,他在实验室中选择以下装置对该反应能否发生进行了实验探究。
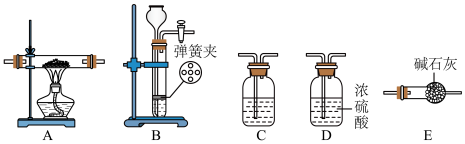
依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置___________ (填装置下方对应字母),反应的化学方程式为___________ 。
(2)装置 C所装的试剂是___________ ,发生的反应为(用离子方程式表示)___________ 。
(3)为达到实验目的,选择上图中的装置,其连接顺序为:按二氧化碳的发生装置→___________ 。(按气流方向,填写装置的大写字母)。
(4)操作中通空气和加热的先后顺序为___________ 。
(5)该同学在制取 的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。
的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。
(6)若反应过程中 足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为
足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为 ;②生成的固体物质为
;②生成的固体物质为 和C的混合物③生成的固体物质为
和C的混合物③生成的固体物质为 和
和 的混合物;④生成的固体物质为
的混合物;④生成的固体物质为 和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是
和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是___________ ;则钠与 反应的化学方程式为
反应的化学方程式为___________ 。
(7)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知, 溶液可以吸收
溶液可以吸收 ,同时得到黑色的
,同时得到黑色的 和一种酸。于是他在装置后加装一个盛
和一种酸。于是他在装置后加装一个盛 溶液的吸收装置,该装置中发生反应的化学方程式为
溶液的吸收装置,该装置中发生反应的化学方程式为___________ 。

依据要求回答问题:
(1)二氧化碳的发生装置应选用上述装置
(2)装置 C所装的试剂是
(3)为达到实验目的,选择上图中的装置,其连接顺序为:按二氧化碳的发生装置→
(4)操作中通空气和加热的先后顺序为
(5)该同学在制取
 的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。
的过程中,向装置B中加入某酸后,发现固体与酸没有接触,为使反应顺利进行,下列可再加入的试剂是___________。| A.稀硝酸 | B. 溶液 溶液 |
| C.煤油 | D. (无色有机溶剂,与水互不相溶,密度比水大) (无色有机溶剂,与水互不相溶,密度比水大) |
(6)若反应过程中
 足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为
足量,反应结束后,该同学对硬质玻璃管中生成的固体提出了以下猜想:①生成的固体物质为 ;②生成的固体物质为
;②生成的固体物质为 和C的混合物③生成的固体物质为
和C的混合物③生成的固体物质为 和
和 的混合物;④生成的固体物质为
的混合物;④生成的固体物质为 和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是
和C的混合物。报告给老师后,老师认为可以排除其中的3种情况,老师排除的理由是 反应的化学方程式为
反应的化学方程式为(7)该同学经过反思,认为上述实验设计中存在缺陷。他查阅资料后得知,
 溶液可以吸收
溶液可以吸收 ,同时得到黑色的
,同时得到黑色的 和一种酸。于是他在装置后加装一个盛
和一种酸。于是他在装置后加装一个盛 溶液的吸收装置,该装置中发生反应的化学方程式为
溶液的吸收装置,该装置中发生反应的化学方程式为
您最近一年使用:0次
2023-11-28更新
|
126次组卷
|
2卷引用:广东省广州市第二中学教育集团联考2023-2024学年高一上学期11月期中考试化学试题
名校
解题方法
8 . 运用氧化还原反应和离子反应知识回答下列问题:
Ⅰ.将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。
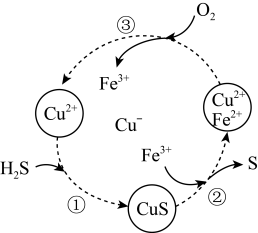
(1)写出过程②和过程中③发生反应的离子方程式:
i.过程②___________ 。
ii.过程③___________ 。
iii.整个转化过程中可以循环使用的离子是___________ 。
Ⅱ.新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温反应得到的。
(2)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于___________ 。
(3)MFe2O4中Fe元素的化合价为___________ 。
(4)在酸性条件下,Fe2O 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O 、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O
、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O 转化为Fe2+的离子方程式
转化为Fe2+的离子方程式___________ 。
(5)已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O(反应前后H元素化合价未发生变化),请用单线桥法标出电子转移的方向和数目___________ 。
Ⅰ.将H2S和空气的混合气体通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其转化如图所示(CuS不溶于水)。

(1)写出过程②和过程中③发生反应的离子方程式:
i.过程②
ii.过程③
iii.整个转化过程中可以循环使用的离子是
Ⅱ.新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Zn、Ni,且均为+2价,下同)是由铁酸盐MFe2O4经过高温反应得到的。
(2)将纳米材料氧缺位铁酸盐分散在蒸馏水中,所形成的分散系属于
(3)MFe2O4中Fe元素的化合价为
(4)在酸性条件下,Fe2O
 容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O
容易转化为Fe2+,某反应体系中共存在下列6种粒子:Fe2O 、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O
、Fe2+、H+、H2O、Cu2O、Cu2+,则Fe2O 转化为Fe2+的离子方程式
转化为Fe2+的离子方程式(5)已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O(反应前后H元素化合价未发生变化),请用单线桥法标出电子转移的方向和数目
您最近一年使用:0次
名校
解题方法
9 . 铁及其化合物在生产生活中有着广泛的用途。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式: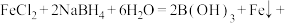
______ 。
②相同条件下,向水样Ⅰ和Ⅱ(含少量( )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是______ 。
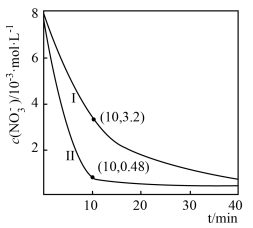
③在0~10 min内,Ⅱ中 的平均反应速率为
的平均反应速率为______ 。
(2)KSCN溶液可检验水样中的 .发生的反应为
.发生的反应为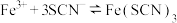 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。
(3)邻苯二酚类配体(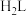 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、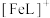 、
、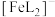 、
、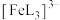 、
、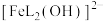 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
已知: 及
及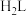 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,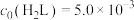 mol⋅L
mol⋅L 。
。
常温下,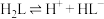
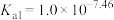 ,
,
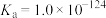 。
。
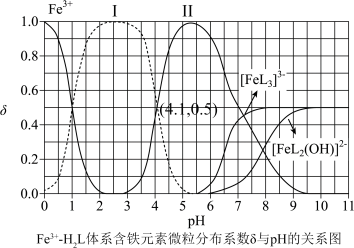
①苯酚酸性比邻甲基苯酚______ (填“强”“弱”或“无法判断”),邻苯二酚的熔点比对苯二酚低的原因为______ 。
②图中代表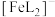 的曲线是
的曲线是______ (填“Ⅰ”或“Ⅱ”)。计算该温度下溶液中反应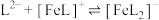 的平衡常数
的平衡常数
______ (写出计算过程)。
(1)纳米零价铁可用于去除水体中的硝酸盐等污染物。
①完成制备纳米零价铁的化学方程式:
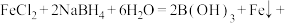
②相同条件下,向水样Ⅰ和Ⅱ(含少量(
 )中分别加入等量纳米铁粉,水样中
)中分别加入等量纳米铁粉,水样中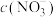 随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
随时间的变化如图所示,Ⅰ和Ⅱ产生差异的原因可能是
③在0~10 min内,Ⅱ中
 的平均反应速率为
的平均反应速率为(2)KSCN溶液可检验水样中的
 .发生的反应为
.发生的反应为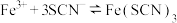 ,下列有关该反应说法正确的有______。(填标号)。
,下列有关该反应说法正确的有______。(填标号)。| A.增大KSCN溶液的浓度,平衡常数增大 |
B.加入少量铁粉,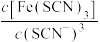 减小 减小 |
| C.加水稀释,平衡向左移动,溶液颜色变浅 |
D.加入少量 固体,平衡向右移动 固体,平衡向右移动 |
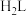 )与
)与 形成的配合物可应用于医药、水处理和材料等研究领域。某
形成的配合物可应用于医药、水处理和材料等研究领域。某 溶液体系中含铁元素的微粒组分为
溶液体系中含铁元素的微粒组分为 、
、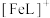 、
、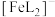 、
、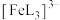 、
、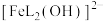 。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。
。体系中含铁元素微粒的分布系数δ与pH的关系如图所示。已知:
 及
及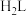 的起始浓度分别为
的起始浓度分别为 mol⋅L
mol⋅L ,
,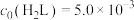 mol⋅L
mol⋅L 。
。常温下,
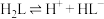
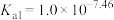 ,
,
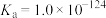 。
。
①苯酚酸性比邻甲基苯酚
②图中代表
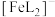 的曲线是
的曲线是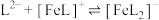 的平衡常数
的平衡常数
您最近一年使用:0次
2023-09-08更新
|
435次组卷
|
3卷引用:广东省江门市新会第一中学2023-2024学年高三上学期期中考试化学试题
名校
10 . 氨既是重要的化工产品,也是重要的化工原料。合成氨及氨氧化制硝酸的流程如图所示,下列说法错误的是
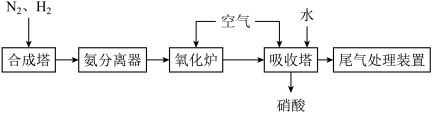
| A.酸 雨和光化学烟雾的形成均与氮氧化物有关 |
B.吸收塔中若转移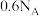 个电子,则反应的NO物质的量为0.1mol 个电子,则反应的NO物质的量为0.1mol |
C.氧化炉中发生反应的化学方程式为 |
| D.从氨分离器中分离出氨,主要利用了其易液化的性质 |
您最近一年使用:0次
2023-05-31更新
|
468次组卷
|
2卷引用:广东省广州市第一一三中学2023-2024学年高一下学期4月期中考试化学试题



