名校
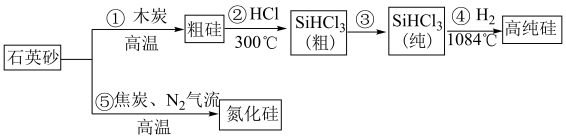
1 . 如今,半导体“硅”已经成为信息时代高科技的代名词,高纯硅是现代信息、半导体和光伏发电等产业的基础材料。制备高纯硅的主要工艺流程如图所示: 极易水解,反应过程中会产生氢气。
极易水解,反应过程中会产生氢气。
回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒, 的晶体类型为
的晶体类型为________ 。
(2)写出④的化学方程式为________ 。
(3)以上①~⑤的流程中,包含置换反应的是______ (填序号)。整个操作流程都需隔绝空气,原因是________ (答出两条即可)。
(4)氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为____ 。
(5)在硅酸盐中, 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为_____ ,其化学式为______ 。
 极易水解,反应过程中会产生氢气。
极易水解,反应过程中会产生氢气。回答下列问题:
(1)二氧化硅和硅酸盐是构成地壳中大部分岩石、沙子和土壤的主要微粒,
 的晶体类型为
的晶体类型为(2)写出④的化学方程式为
(3)以上①~⑤的流程中,包含置换反应的是
(4)氮化硼陶瓷基复合材料电推进系统及以SiC单晶制作器件,在航空航天特殊环境下具有广泛的应用前景。科学家用金属钠、四氯化碳和四氯化硅制得了SiC纳米棒,反应的化学方程式为
(5)在硅酸盐中,
 四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为
四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式。图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为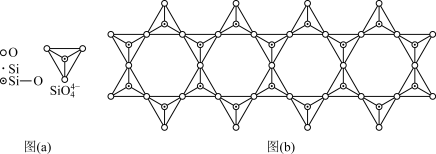
您最近半年使用:0次
名校
解题方法
2 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。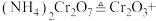
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)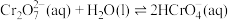
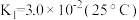
(ⅱ)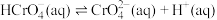

 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时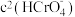 与
与 的比值保持不变
的比值保持不变
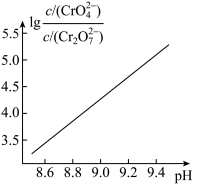
②25℃时,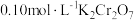 溶液中
溶液中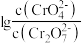 随pH的变化关系如图。当
随pH的变化关系如图。当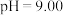 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
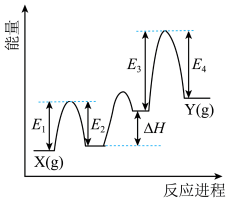
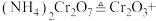
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
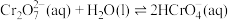
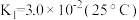
(ⅱ)
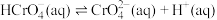

 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
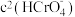 与
与 的比值保持不变
的比值保持不变②25℃时,
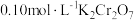 溶液中
溶液中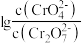 随pH的变化关系如图。当
随pH的变化关系如图。当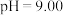 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度
您最近半年使用:0次
3 . 铬铁渣是火法炼铬所产生的废渣,其中铬以低价态的 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是
 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是A.焙烧后,含铬化合物主要以 存在 存在 |
| B.加水浸取过滤,滤渣1的主要成分应含有铁元素 |
| C.除铝步骤,为使杂质沉淀彻底,应加入足量稀硫酸 |
D.还原步骤发生的离子反应是: |
您最近半年使用:0次
名校
4 . 高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为___________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将 、NO、
、NO、 转化为
转化为 。
。
①在SCR脱硝的反应中还原剂为___________ (填化学式)。
②若 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理___________ (用化学方程式表示)。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量( 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量___________ (用 表示,写出计算过程)。
表示,写出计算过程)。
 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成
 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将
 、NO、
、NO、 转化为
转化为 。
。①在SCR脱硝的反应中还原剂为
②若
 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(
 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量 表示,写出计算过程)。
表示,写出计算过程)。
您最近半年使用:0次
名校
5 . 铬是一种具有战略意义的金属,它具有多种价态,单质铬熔点为1857℃。工业上以铬铁矿[主要成分是 ]为原料冶炼铬的流程如图所示:
]为原料冶炼铬的流程如图所示: 中各元素化合价均为整数,则铬的化合价为
中各元素化合价均为整数,则铬的化合价为___________ ,写出基态铬原子的外围电子排布式___________ 。
(2)操作a由两步反应构成,其分别是①___________ 、②与铝粉混合高温下发生铝热反应。
(3) 是两性氢氧化物,写出其与NaOH反应的离子方程式
是两性氢氧化物,写出其与NaOH反应的离子方程式___________ 。
(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(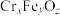 ):先向含
):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分 )并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
①写出 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式
的离子方程式___________ 。
②若处理含1mol (不考虑其他含铬微粒)的污水时恰好消耗10mol
(不考虑其他含铬微粒)的污水时恰好消耗10mol  ,则当铁铬氧体中
,则当铁铬氧体中 时,则铁铬氧体的化学式为
时,则铁铬氧体的化学式为___________ 。
 ]为原料冶炼铬的流程如图所示:
]为原料冶炼铬的流程如图所示: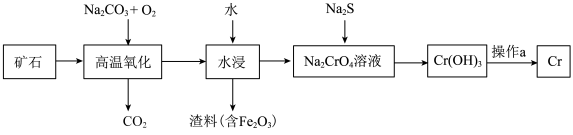
 中各元素化合价均为整数,则铬的化合价为
中各元素化合价均为整数,则铬的化合价为(2)操作a由两步反应构成,其分别是①
(3)
 是两性氢氧化物,写出其与NaOH反应的离子方程式
是两性氢氧化物,写出其与NaOH反应的离子方程式(4)水中的铬元素对水质及环境均有严重的损害作用,必须进行无害化处理。转化为重要产品磁性铁铬氧体(
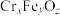 ):先向含
):先向含 的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分
的污水中加入适量的硫酸及硫酸亚铁,待充分反应后再通入适量空气(氧化部分 )并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。
)并加入NaOH,就可以使铬、铁元素全部转化为磁性铁铬氧体。①写出
 在酸性条件下被
在酸性条件下被 还原为
还原为 的离子方程式
的离子方程式②若处理含1mol
 (不考虑其他含铬微粒)的污水时恰好消耗10mol
(不考虑其他含铬微粒)的污水时恰好消耗10mol  ,则当铁铬氧体中
,则当铁铬氧体中 时,则铁铬氧体的化学式为
时,则铁铬氧体的化学式为
您最近半年使用:0次
名校
解题方法
6 . 某钒催化剂在一定条件下形成相邻的氧化还原位和酸性吸附位,该催化剂催化 脱除电厂烟气中NO的反应机理如图所示。
脱除电厂烟气中NO的反应机理如图所示。
 脱除电厂烟气中NO的反应机理如图所示。
脱除电厂烟气中NO的反应机理如图所示。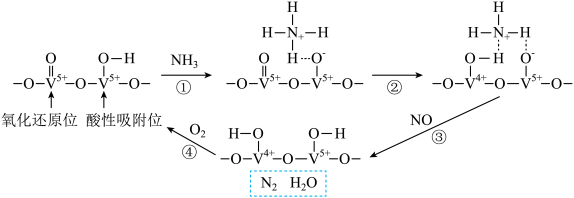
| A.反应①~④均为氧化还原反应 |
B.消耗1mol  ,理论上可处理2mol NO ,理论上可处理2mol NO |
C.反应②为 |
D.总反应方程式 |
您最近半年使用:0次
名校
解题方法
7 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图装置制备 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为___________ 。
a.浓硫酸 b.足量 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液
请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):___________ 。
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
相关反应为:① ,
,
② 。
。
流程如下: 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法___________ 。
(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是___________ ,可进一步证实B中含 。
。
实验三:探究 的产生途径。
的产生途径。
猜想1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
猜想2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:___________ 。
(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率___________ (填“快”或“慢”)。
(6)实验探究可知, 在
在___________ (选填“酸性”“中性”“碱性”)溶液中更易被氧化为 。
。
 与
与 溶液的反应。
溶液的反应。实验一:用如图装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的
 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为a.浓硫酸 b.足量
 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为
 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。相关反应为:①
 ,
,②
 。
。流程如下:

 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为
 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是 。
。实验三:探究
 的产生途径。
的产生途径。猜想1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。猜想2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加
 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有
 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率(6)实验探究可知,
 在
在 。
。
您最近半年使用:0次
2024-05-05更新
|
286次组卷
|
2卷引用:辽宁省实验中学2022-2023学年高一下学期期中测试化学试题
名校
解题方法
8 . 将足量SO2通入AgNO3溶液中,产生沉淀。探究反应原理及沉淀成分,装置如下(加热、夹持等装置略)。
资料:ⅰ.Ag2SO4微溶于水;Ag2SO3难溶于水。
ⅱ.Ag2SO4、Ag2SO3均溶于氨水。___________ 。
②用NaOH溶液吸收尾气中的SO2,产物是___________ 。
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
推测白色沉淀(t1)可能为Ag2SO4、Ag2SO3或二者混合物。探究如下:
①t1时,C中产生白色沉淀的离子方程式是___________ 。
②试剂a是___________ 。
③产生白色沉淀Y的原因是___________ 。
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤。向滤出的沉淀中加入浓HNO3,证实沉淀含Ag。现象是___________ 。
(4)通过检测SO 探究产生Ag的原因。
探究产生Ag的原因。___________ 。(用化学方程式表示)
综上可知,化学反应的产物与反应速率和限度有关。
资料:ⅰ.Ag2SO4微溶于水;Ag2SO3难溶于水。
ⅱ.Ag2SO4、Ag2SO3均溶于氨水。

②用NaOH溶液吸收尾气中的SO2,产物是
(2)探究沉淀成分。实验发现,沉淀的颜色与取样时间有关,对比实验记录如下:
| 时间 | 反应开始时(t1) | 一段时间后(t2) | 较长时间后(t3) |
| 颜色 | 白色 | 灰黑色 | 灰黑色加深 |

①t1时,C中产生白色沉淀的离子方程式是
②试剂a是
③产生白色沉淀Y的原因是
(3)推测灰黑色沉淀(t2)含Ag。探究如下:
取灰黑色沉淀,加入氨水,部分沉淀溶解,过滤。向滤出的沉淀中加入浓HNO3,证实沉淀含Ag。现象是
(4)通过检测SO
 探究产生Ag的原因。
探究产生Ag的原因。实验: (已排除O2的影响)
(已排除O2的影响)
综上可知,化学反应的产物与反应速率和限度有关。
您最近半年使用:0次
名校
解题方法
9 . 某课外小组探究Cu(Ⅱ)盐与Na2S2O3溶液的反应。
【查阅资料】
ⅰ. 2 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):
ⅱ. 2NH3+Cu+ [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
ⅲ. 易被氧化为
易被氧化为 或
或 。
。
【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;
假设2:Cu(Ⅱ)有氧化性,Cu2+与 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。
【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是___________ (填化学式)。
(2)甲同学认为实验一可证明假设2成立,他的理由是___________ 。
实验二:探究CuCl2与Na2S2O3的反应。___________ (补全实验方案),则说明含Cu(Ⅰ)。
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:___________ 。
(5)经检验氧化产物以 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:___________ 。
【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n( ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生___________ 的趋势减弱;
②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和 发生
发生___________ 的趋势。
【查阅资料】
ⅰ. 2
 +Cu2+
+Cu2+ [Cu(S2O3)2]2-(绿色),2
[Cu(S2O3)2]2-(绿色),2 +Cu+
+Cu+ [Cu(S2O3)2]3-(无色):
[Cu(S2O3)2]3-(无色):ⅱ. 2NH3+Cu+
 [Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);
[Cu(NH3)2]+(无色),[Cu(NH3)2]+遇空气容易被氧化成[Cu(NH3)4]2+ (蓝色);ⅲ.
 易被氧化为
易被氧化为 或
或 。
。【猜想假设】
同学们根据资料认为Cu(Ⅱ)盐与Na2S2O3可能会发生两种反应:
假设1:Cu2+与
 在溶液中发生配合反应生成[Cu(S2O3)2]2-;
在溶液中发生配合反应生成[Cu(S2O3)2]2-;假设2:Cu(Ⅱ)有氧化性,Cu2+与
 在溶液中发生氧化还原反应。
在溶液中发生氧化还原反应。【实验操作及现象分析】
实验一:探究CuSO4与Na2S2O3溶液的反应。
| 实验操作 | 实验序号 | V1(mL) | V2(mL) | 逐滴加入Na2S2O3溶液时的实验现象 |
| a | 1.5 | 0.5 | 溶液逐渐变为绿色,静置无变化 |
| b | 1.0 | 1.0 | 溶液先变为绿色,后逐渐变成浅绿色,静置无变化 | |
| c | 0 | 2.0 | 溶液先变为绿色,后逐渐变浅至无色,静置无变化 |
(1)根据实验a的现象可推测溶液中生成的含Cu微粒是
(2)甲同学认为实验一可证明假设2成立,他的理由是
实验二:探究CuCl2与Na2S2O3的反应。
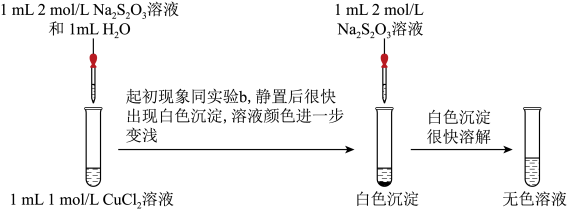
(4)经检验白色沉淀中含CuCl,请写出继续加Na2S2O3溶液后CuCl沉淀溶解的离子方程式:
(5)经检验氧化产物以
 形式存在,写出Cu2+与
形式存在,写出Cu2+与 发生氧化还原反应得到无色溶液的离子方程式:
发生氧化还原反应得到无色溶液的离子方程式:【获得结论】
(6)综合以上实验,同学们认为Cu(Ⅱ)盐与Na2S2O3在溶液中的反应与多种因素有关,得到实验结论,选择合适的选项填入下面的横线中。
A配合反应 B.氧化还原反应 C.置换反应 D.复分解反应
①随n(
 ):n(Cu2+)的增大,二者发生
):n(Cu2+)的增大,二者发生②Cu(Ⅱ)盐的阴离子为Cl-时能增大Cu2+和
 发生
发生
您最近半年使用:0次
名校
解题方法
10 . 氮、磷、砷 、锑
、锑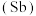 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1) 中
中 键和
键和 键的数目比例是
键的数目比例是___________ ,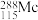 的中子数为
的中子数为___________ 。
(2)①已知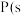 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;
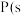 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;
由此推知,其中最稳定的磷单质是___________ 。
②比较氮和磷氢化物的热稳定性:
___________  (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式___________ 。
③ 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。
下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是___________ (填序号)。
 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解
(3)已知 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为___________ 、___________ 。
(4) 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(5)某工厂采用辉铋矿(主要成分为 ,含有
,含有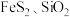 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示: 分解为
分解为 转变为
转变为 ;
;
②金属活动性: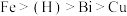 ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
① 在元素周期表中的位置是
在元素周期表中的位置是___________ ,基态原子价层电子排布式为___________ 。
② 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
③滤渣的主要成分为___________ (填化学式)。
④生成气体 的离子方程式为
的离子方程式为___________ 。
⑤加入金属 的目的是
的目的是___________ 。
 、锑
、锑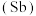 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:(1)
 中
中 键和
键和 键的数目比例是
键的数目比例是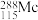 的中子数为
的中子数为(2)①已知
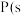 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;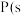 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;由此推知,其中最稳定的磷单质是
②比较氮和磷氢化物的热稳定性:

 (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式③
 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。下列对
 与
与 反应产物的推断正确的是
反应产物的推断正确的是 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解(3)已知
 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为(4)
 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式(5)某工厂采用辉铋矿(主要成分为
 ,含有
,含有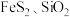 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示:
 分解为
分解为 转变为
转变为 ;
;②金属活动性:
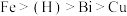 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
 在元素周期表中的位置是
在元素周期表中的位置是②
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为③滤渣的主要成分为
④生成气体
 的离子方程式为
的离子方程式为⑤加入金属
 的目的是
的目的是
您最近半年使用:0次




