名校
解题方法
1 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应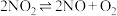 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
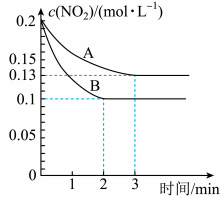
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,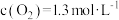 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
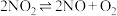 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,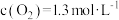 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
68次组卷
|
2卷引用:黑龙江省鸡西市新兴实验学校2023-2024学年高三上学期11月期中考试化学试题
2 . 高锰酸钾是一种重要的氧化剂,在消毒杀菌等方面应用广泛。实验室以固体碱熔氧化法制备高锰酸钾,其部分流程如下:

回答下列问题:
(1)为提高第③步的浸出速率,可采取的措施之一是_________________________________ 。
(2)第④步通入 ,将溶液的pH调至10-11时,
,将溶液的pH调至10-11时, 完全转化为
完全转化为 和
和 。第①步碱熔时发生反应的化学方程式为
。第①步碱熔时发生反应的化学方程式为___________________________ 。
(3)第⑥步母液中主要含有的溶质一定有 、
、 和
和__________ 。该流程中,除了浓缩结晶的母液之外,还可以循环使用的物质是_________________ 。
(4)调节溶液pH可实现工业废气 的捕获和释放。已知25℃时碳酸的电离常数为
的捕获和释放。已知25℃时碳酸的电离常数为 、
、 ,当溶液
,当溶液 时,
时, 1:
1:____________ :___________ (用 、
、 表示)。
表示)。
(5)工业上可采用如图所示装置电解 溶液制备
溶液制备

①该装置中的离子交换膜是___________ 交换膜(填“阴离子”或“阳离子”)。
②电解时阳极的电极反应式是________________________________ 。

回答下列问题:
(1)为提高第③步的浸出速率,可采取的措施之一是
(2)第④步通入
 ,将溶液的pH调至10-11时,
,将溶液的pH调至10-11时, 完全转化为
完全转化为 和
和 。第①步碱熔时发生反应的化学方程式为
。第①步碱熔时发生反应的化学方程式为(3)第⑥步母液中主要含有的溶质一定有
 、
、 和
和(4)调节溶液pH可实现工业废气
 的捕获和释放。已知25℃时碳酸的电离常数为
的捕获和释放。已知25℃时碳酸的电离常数为 、
、 ,当溶液
,当溶液 时,
时, 1:
1: 、
、 表示)。
表示)。(5)工业上可采用如图所示装置电解
 溶液制备
溶液制备

①该装置中的离子交换膜是
②电解时阳极的电极反应式是
您最近一年使用:0次
解题方法
3 . 碲(Te)广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为 ,还含有金、银、铂等)回收碲的工艺流程如下:
,还含有金、银、铂等)回收碲的工艺流程如下:
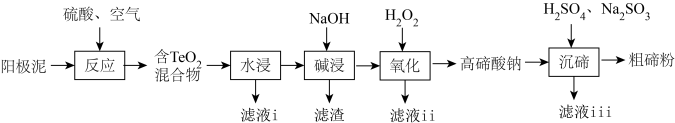
已知: 有强还原性,且
有强还原性,且 、
、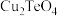 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式: 。
。
回答下列问题:
(1)为提高“反应”效率,可采取的措施为_______ (任答一条)。
(2)滤液i的主要成分是_______ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释铜的浸出率随温度变化的可能原因_______ 。

(3)“氧化”过程中发生反应的离子方程式为_______ 。滤液ⅱ可循环使用,应将其导入到_______ (写操作单元名称)操作中。
(4)“沉碲”过程中发生反应的离子方程式为_______ 。
 ,还含有金、银、铂等)回收碲的工艺流程如下:
,还含有金、银、铂等)回收碲的工艺流程如下:
已知:
 有强还原性,且
有强还原性,且 、
、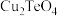 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式: 。
。回答下列问题:
(1)为提高“反应”效率,可采取的措施为
(2)滤液i的主要成分是

(3)“氧化”过程中发生反应的离子方程式为
(4)“沉碲”过程中发生反应的离子方程式为
您最近一年使用:0次
4 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
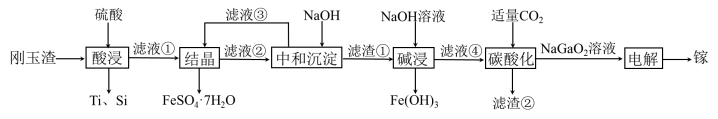
回答下列问题:
(1)镓原子结构示意图为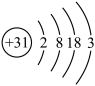 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
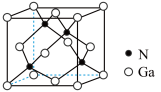
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为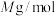 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为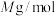 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
解题方法
5 . 铁的化合物有广泛用途,如三草酸合铁(Ⅲ)酸钾晶体 是一种光敏材料,也可作催化剂;碳酸亚铁(
是一种光敏材料,也可作催化剂;碳酸亚铁( )可作补血剂等。以废铁屑(含
)可作补血剂等。以废铁屑(含 及少量
及少量 和
和 )为原料制备以上物质的流程如下:
)为原料制备以上物质的流程如下:

已知:①25℃, ,
, ,
, 。
。
②金属离子浓度 时,可认为该金属离子已沉淀完全。
时,可认为该金属离子已沉淀完全。
③ 为可溶于水、难溶于乙醇的翠绿色晶体。
为可溶于水、难溶于乙醇的翠绿色晶体。
回答下列问题:
(1)滤液Ⅰ中含有 、
、 ,检验
,检验 所用的试剂为
所用的试剂为___________ 溶液(填化学式)。
(2)室温下,若滤液Ⅰ中 为2.0
为2.0 ,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中
,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中 至少应大于
至少应大于___________  。
。
(3)将滤液Ⅱ与饱和 溶液混合,发生反应的离子方程式为
溶液混合,发生反应的离子方程式为___________ 。已知饱和 溶液的
溶液的 大于11,是否能用饱和
大于11,是否能用饱和 溶液代替饱和
溶液代替饱和 溶液来制备
溶液来制备 ?
?___________ (填“是”或“否”)。
(4)滤液Ⅰ与足量空气发生反应的离子方程式为___________ 。甲同学认为该步反应用稀 溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是
溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是___________ 。
(5)用乙醇洗涤翠绿色晶体而不用水洗涤的目的为___________ 。
 是一种光敏材料,也可作催化剂;碳酸亚铁(
是一种光敏材料,也可作催化剂;碳酸亚铁( )可作补血剂等。以废铁屑(含
)可作补血剂等。以废铁屑(含 及少量
及少量 和
和 )为原料制备以上物质的流程如下:
)为原料制备以上物质的流程如下:
已知:①25℃,
 ,
, ,
, 。
。②金属离子浓度
 时,可认为该金属离子已沉淀完全。
时,可认为该金属离子已沉淀完全。③
 为可溶于水、难溶于乙醇的翠绿色晶体。
为可溶于水、难溶于乙醇的翠绿色晶体。回答下列问题:
(1)滤液Ⅰ中含有
 、
、 ,检验
,检验 所用的试剂为
所用的试剂为(2)室温下,若滤液Ⅰ中
 为2.0
为2.0 ,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中
,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中 至少应大于
至少应大于 。
。(3)将滤液Ⅱ与饱和
 溶液混合,发生反应的离子方程式为
溶液混合,发生反应的离子方程式为 溶液的
溶液的 大于11,是否能用饱和
大于11,是否能用饱和 溶液代替饱和
溶液代替饱和 溶液来制备
溶液来制备 ?
?(4)滤液Ⅰ与足量空气发生反应的离子方程式为
 溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是
溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是(5)用乙醇洗涤翠绿色晶体而不用水洗涤的目的为
您最近一年使用:0次
解题方法
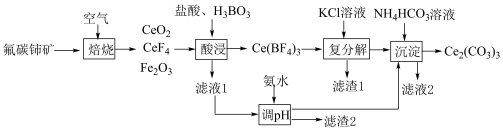
6 . 铈可用作优良的环保材料。现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备碳酸铈的工艺流程如下:___________ 。
(2)“酸浸”步骤中产生的气体为___________ (化学式)。
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是___________ (已知Ksp[Fe(OH)3]=8×10-38;Ksp[Ce(OH)3]=1×10-22;lg2=0.3,离子浓度小于1×10-5mol/L认为沉淀完全)。
(4)“沉淀”步骤中发生反应的离子方程式为___________ 。
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为___________ 。
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;___________ 。
(2)“酸浸”步骤中产生的气体为
(3)“滤液1”中c(Ce3+)=0.1mol·L-1,用氨水调pH的范围是
(4)“沉淀”步骤中发生反应的离子方程式为
(5)Ce2(CO3)3在空气中焙烧可制得CeO2,该反应的化学方程式为
(6)用过量铝粉还原CeO2即可得Ce.铝粉必须过量的原因是:使CeO2充分被还原,提高Ce的产率;
您最近一年使用:0次
名校
解题方法
7 . 工业上用铝土矿(主要成份是 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
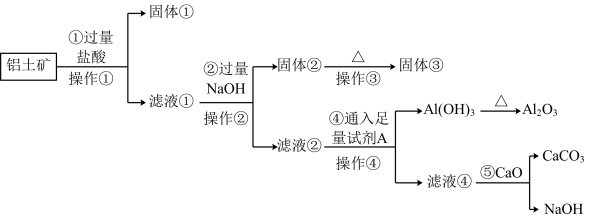
请回答下列问题:
(1)操作①的名称是_______ ,操作③用到的仪器有酒精灯、三脚架、泥三角、_______ 。
(2)写出加入过量 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:________ 。
(3)流程中的 最好选用
最好选用________ ,发生反应的离子方程式为________ 。
(4)写出反应⑤的化学反应方程式______ ,上述流程中可以循环利用的物质为____ (填化学式)。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为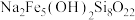 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为______ 。将 该矿石用足量
该矿石用足量______ (填盐酸或硫酸)溶解后,加入过量铜粉使溶液中的铁元素全部变为 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
请回答下列问题:
(1)操作①的名称是
(2)写出加入过量
 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:(3)流程中的
 最好选用
最好选用(4)写出反应⑤的化学反应方程式
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为
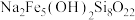 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为 该矿石用足量
该矿石用足量 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-03-03更新
|
211次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
名校
解题方法
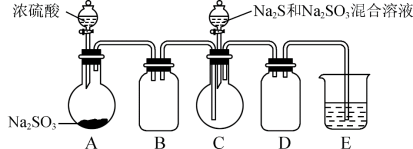
8 . 工业上常利用含硫废水生产Na2S2O3·5H2O,某小组同学用如下图装置(略去加热仪器等)模拟生产过程。
已知:
ⅰ.烧瓶C中发生反应如下:
Na2S(aq)+H2O(1)+SO2(g)=Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)=3S(s)+2H2O(1) (b)
S(s)+Na2SO3(aq) Na2S2O3(aq)(c)
Na2S2O3(aq)(c)
ⅱ.Na2S和Na2SO3能被空气中的O2氧化。
(1)A中发生的化学方程式为___________ 。C中反应前先通一会儿SO2的原因为___________ 。
(2)模拟实验的操作步骤(说明:仪器中旋塞或玻璃塞的开或关不必叙述):检查装置的气密性,并按图示加入试剂:向A烧瓶中分批滴加足量浓硫酸,___________ ,所得溶液经蒸发浓缩、冷却结晶、过滤洗涤、真空干燥后即得到产品。
(3)Na2S2O3常用作脱氯剂。
① 离子的空间构型为
离子的空间构型为___________ 。
②Na2S2O3溶液与足量Cl2反应产生 的离子方程式为
的离子方程式为___________ 。
(4)Na2SO3可以用于测定粗硒中硒的含量的操作步骤如下:
Ⅰ.用浓H2SO4将样品中的Se氧化为SeO2;
Ⅱ.用KI溶液还原SeO2为Se,同时生成I2;
Ⅲ.以淀粉为指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2 =2I-+
=2I-+ )。
)。
实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol/L的Na2S2O3溶液22.00mL,则粗硒样品中硒的质量分数为___________ (写出计算过程)。

已知:
ⅰ.烧瓶C中发生反应如下:
Na2S(aq)+H2O(1)+SO2(g)=Na2SO3(aq)+H2S(aq) (a)
2H2S(aq)+SO2(g)=3S(s)+2H2O(1) (b)
S(s)+Na2SO3(aq)
 Na2S2O3(aq)(c)
Na2S2O3(aq)(c)ⅱ.Na2S和Na2SO3能被空气中的O2氧化。
(1)A中发生的化学方程式为
(2)模拟实验的操作步骤(说明:仪器中旋塞或玻璃塞的开或关不必叙述):检查装置的气密性,并按图示加入试剂:向A烧瓶中分批滴加足量浓硫酸,
(3)Na2S2O3常用作脱氯剂。
①
 离子的空间构型为
离子的空间构型为②Na2S2O3溶液与足量Cl2反应产生
 的离子方程式为
的离子方程式为(4)Na2SO3可以用于测定粗硒中硒的含量的操作步骤如下:
Ⅰ.用浓H2SO4将样品中的Se氧化为SeO2;
Ⅱ.用KI溶液还原SeO2为Se,同时生成I2;
Ⅲ.以淀粉为指示剂,用Na2S2O3标准溶液滴定Ⅱ中生成的I2(I2+2
 =2I-+
=2I-+ )。
)。实验中准确称量0.4000g粗硒样品,滴定中消耗0.8000mol/L的Na2S2O3溶液22.00mL,则粗硒样品中硒的质量分数为
您最近一年使用:0次
名校
解题方法
9 . 某实验小组以含硒废料(主要成分为Se、S等)提取硒,并测定产品硒的纯度。回答下列问题:
Ⅰ.提取硒的实验步骤如下:
i.含硒废料用NaNO3和硫酸混合溶液溶解,得到H2SeO3和H2SeO4混合溶液;
ii.控制反应温度为80℃,使H2SeO4转化为H2SeO3;
iii.调节溶液pH,通入SO2,得到硒单质沉淀。
(1)步骤i中使用硫酸的主要目的为___________ 。
(2)用如图所示装置进行实验。___________ ,装置A的加热方法为___________ 。
②装置B的主要作用为___________ 。
③步骤iii生成硒单质的化学方程式为___________ 。
Ⅱ.测定产品硒的纯度,实验步骤如下:
i.准确称取0.8400g产品并充分研磨,加适量浓硫酸煮沸生成H2SeO3,再稀释配成500mL的溶液。
ii.准确量取25.00mL待测液于锥形瓶中,用0.0100mol·L-1酸性KMnO4标准溶液进行滴定,滴定过程中未见浑浊,重复三次实验,实验数据见下表。
(3)该产品硒的纯度为___________ %(结果保留四位有效数字)。
(4)达到滴定终点时,若读数时仰视刻度线,则会导致测定结果___________ (填“偏大”、“偏小”或“不变”)。
Ⅰ.提取硒的实验步骤如下:
i.含硒废料用NaNO3和硫酸混合溶液溶解,得到H2SeO3和H2SeO4混合溶液;
ii.控制反应温度为80℃,使H2SeO4转化为H2SeO3;
iii.调节溶液pH,通入SO2,得到硒单质沉淀。
(1)步骤i中使用硫酸的主要目的为
(2)用如图所示装置进行实验。
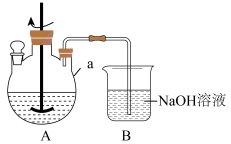
②装置B的主要作用为
③步骤iii生成硒单质的化学方程式为
Ⅱ.测定产品硒的纯度,实验步骤如下:
i.准确称取0.8400g产品并充分研磨,加适量浓硫酸煮沸生成H2SeO3,再稀释配成500mL的溶液。
ii.准确量取25.00mL待测液于锥形瓶中,用0.0100mol·L-1酸性KMnO4标准溶液进行滴定,滴定过程中未见浑浊,重复三次实验,实验数据见下表。
| 实验次数 | 滴定前读数/mL | 滴定后读数/mL |
| 1 | 0.10 | 20.20 |
| 2 | 1.85 | 21.75 |
| 3 | 0.00 | 25.06 |
(3)该产品硒的纯度为
(4)达到滴定终点时,若读数时仰视刻度线,则会导致测定结果
您最近一年使用:0次
2024-01-07更新
|
180次组卷
|
3卷引用:华大新高考联盟卷2023-2024学年高三上学期11月理综试卷
名校
10 . 氧化钻(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。
某铜钻矿石主要含有CoO(OH)、CoCO3、Cu(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ、将粉碎的矿石用过量的稀H2SO4和Na2SO4溶液浸泡。
Ⅱ、浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ、向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b.
Ⅳ、Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V、将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃煅烧,即得Co2O3
请回答:
(1)I中,稀硫酸溶解CoCO3的化学方程式是_____ 。
(2)根据图1、图2分析:
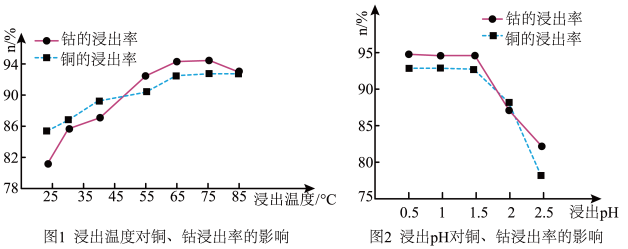
矿石粉末浸泡的适宜条件应是_____ 。
(3)Ⅱ中,漫出液中的金属离子与NaClO3反应的离子方程式:_____ 。
ClO +_____+_____ =Cl-+_____+_____
+_____+_____ =Cl-+_____+_____
(4)Ⅱ中,检验铁元素完全除去的试剂是_____ 。实验现象是 _____ 。
(5)Ⅱ、Ⅳ中,加Na2CO3的作用分别是_____ 、_____ 。
(6)V中,分离出纯净的CoC2O4⋅2H2O的操作是_____ 。
某铜钻矿石主要含有CoO(OH)、CoCO3、Cu(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ、将粉碎的矿石用过量的稀H2SO4和Na2SO4溶液浸泡。
Ⅱ、浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ、向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b.
Ⅳ、Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V、将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃煅烧,即得Co2O3
请回答:
(1)I中,稀硫酸溶解CoCO3的化学方程式是
(2)根据图1、图2分析:

矿石粉末浸泡的适宜条件应是
(3)Ⅱ中,漫出液中的金属离子与NaClO3反应的离子方程式:
ClO
 +_____+_____ =Cl-+_____+_____
+_____+_____ =Cl-+_____+_____(4)Ⅱ中,检验铁元素完全除去的试剂是
(5)Ⅱ、Ⅳ中,加Na2CO3的作用分别是
(6)V中,分离出纯净的CoC2O4⋅2H2O的操作是
您最近一年使用:0次



