名校
解题方法
1 . 化学小组实验探究 与
与 溶液的反应。
溶液的反应。
实验一:用如图装置制备 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为___________ 。
a.浓硫酸 b.足量 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液
请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):___________ 。
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
相关反应为:① ,
,
② 。
。
流程如下: 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法___________ 。
(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是___________ ,可进一步证实B中含 。
。
实验三:探究 的产生途径。
的产生途径。
猜想1:实验一中, 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。
猜想2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:___________ 。
(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率___________ (填“快”或“慢”)。
(6)实验探究可知, 在
在___________ (选填“酸性”“中性”“碱性”)溶液中更易被氧化为 。
。
 与
与 溶液的反应。
溶液的反应。实验一:用如图装置制备
 ,并将足量
,并将足量 通入
通入 溶液中,迅速反应,得到无色溶液A和白色沉淀B。
溶液中,迅速反应,得到无色溶液A和白色沉淀B。
(1)制备的
 中会混有少量的
中会混有少量的 ,原因可能为浓硫酸或硫酸铜受热分解产生
,原因可能为浓硫酸或硫酸铜受热分解产生 ,为了排除
,为了排除 的干扰,试剂a可以为
的干扰,试剂a可以为a.浓硫酸 b.足量
 溶液 c.足量NaHS溶液 d.足量饱和
溶液 c.足量NaHS溶液 d.足量饱和 溶液
溶液请写出试剂a所有不能选择的试剂的理由(用相应的离子方程式回答):
实验二:验证白色沉淀B的成分。
分析:沉淀B可能为
 、
、 或两者混合物。滴加氨水可释出其阴离子,便于后续检验。
或两者混合物。滴加氨水可释出其阴离子,便于后续检验。相关反应为:①
 ,
,②
 。
。流程如下:

 是否已经过量,请简述实验方法
是否已经过量,请简述实验方法(3)沉淀D加入过量盐酸后,只有少量沉淀剩余,则表明大部外沉淀为
 。向滤液E中加入
。向滤液E中加入 溶液,产生的现象是
溶液,产生的现象是 。
。实验三:探究
 的产生途径。
的产生途径。猜想1:实验一中,
 在
在 溶液中被氧化生成
溶液中被氧化生成 ,随沉淀B进入D。
,随沉淀B进入D。猜想2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。(4)取少量溶液A,滴加过量盐酸,产生白色沉淀。静置后,取上层清液再滴加
 溶液,未出现白色沉淀,可判断猜想1不合理。理由是:
溶液,未出现白色沉淀,可判断猜想1不合理。理由是:(5)不同反应的速率也有所不同。将实验一所得混合物放置一段时间,也会有
 生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率
生成,同时生成单质Ag。请从化学反应速率的角度分析沉淀反应的速率比氧化还原反应的速率(6)实验探究可知,
 在
在 。
。
您最近一年使用:0次
2024-05-05更新
|
341次组卷
|
2卷引用:辽宁省实验中学2022-2023学年高一下学期期中测试化学试题
名校
解题方法
2 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应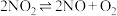 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
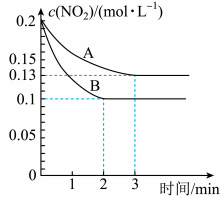
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,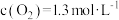 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
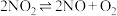 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,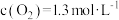 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
68次组卷
|
2卷引用:黑龙江省鸡西市新兴实验学校2023-2024学年高三上学期11月期中考试化学试题
3 . 高锰酸钾是一种重要的氧化剂,在消毒杀菌等方面应用广泛。实验室以固体碱熔氧化法制备高锰酸钾,其部分流程如下:

回答下列问题:
(1)为提高第③步的浸出速率,可采取的措施之一是_________________________________ 。
(2)第④步通入 ,将溶液的pH调至10-11时,
,将溶液的pH调至10-11时, 完全转化为
完全转化为 和
和 。第①步碱熔时发生反应的化学方程式为
。第①步碱熔时发生反应的化学方程式为___________________________ 。
(3)第⑥步母液中主要含有的溶质一定有 、
、 和
和__________ 。该流程中,除了浓缩结晶的母液之外,还可以循环使用的物质是_________________ 。
(4)调节溶液pH可实现工业废气 的捕获和释放。已知25℃时碳酸的电离常数为
的捕获和释放。已知25℃时碳酸的电离常数为 、
、 ,当溶液
,当溶液 时,
时, 1:
1:____________ :___________ (用 、
、 表示)。
表示)。
(5)工业上可采用如图所示装置电解 溶液制备
溶液制备

①该装置中的离子交换膜是___________ 交换膜(填“阴离子”或“阳离子”)。
②电解时阳极的电极反应式是________________________________ 。

回答下列问题:
(1)为提高第③步的浸出速率,可采取的措施之一是
(2)第④步通入
 ,将溶液的pH调至10-11时,
,将溶液的pH调至10-11时, 完全转化为
完全转化为 和
和 。第①步碱熔时发生反应的化学方程式为
。第①步碱熔时发生反应的化学方程式为(3)第⑥步母液中主要含有的溶质一定有
 、
、 和
和(4)调节溶液pH可实现工业废气
 的捕获和释放。已知25℃时碳酸的电离常数为
的捕获和释放。已知25℃时碳酸的电离常数为 、
、 ,当溶液
,当溶液 时,
时, 1:
1: 、
、 表示)。
表示)。(5)工业上可采用如图所示装置电解
 溶液制备
溶液制备

①该装置中的离子交换膜是
②电解时阳极的电极反应式是
您最近一年使用:0次
4 . 回答下列问题:
(1)①H2+CuO Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有______ (填序号)。
(2)用双线桥法表示下述反应的电子转移的方向和数目______ 。
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为______ 。
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)______ 。
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)______ 。
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。______ 。
(1)①H2+CuO
 Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH
Cu+H2O②CaCO3+2HCl=CaCl2+CO2↑+H2O③3S+6NaOH 2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有
2Na2S+Na2SO3+3H2O④Cu2O+4HCl=2HCuCl2+H2O,上述反应中,属于氧化还原反应的有(2)用双线桥法表示下述反应的电子转移的方向和数目
MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。(3)在反应KClO3+6HCl=3Cl2+KCl+3H2O中,氧化剂与还原剂的系数之比为
(4)配平下面两个反应:
____H2O+____Cl2+____SO2=____H2SO4+____HCl,(系数是1的也请填上)
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O(系数是1的也请填上)
根据以上两个反应反应,写出由KMnO4、K2SO4、MnSO4、SO2、H2O、H2SO4这六种物质组成的氧化还原反应的方程式并配平。
您最近一年使用:0次
解题方法
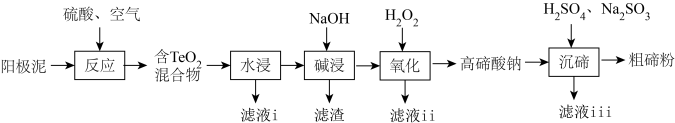
5 . 碲(Te)广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为 ,还含有金、银、铂等)回收碲的工艺流程如下:
,还含有金、银、铂等)回收碲的工艺流程如下:
已知: 有强还原性,且
有强还原性,且 、
、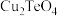 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式: 。
。
回答下列问题:
(1)为提高“反应”效率,可采取的措施为_______ (任答一条)。
(2)滤液i的主要成分是_______ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释铜的浸出率随温度变化的可能原因_______ 。

(3)“氧化”过程中发生反应的离子方程式为_______ 。滤液ⅱ可循环使用,应将其导入到_______ (写操作单元名称)操作中。
(4)“沉碲”过程中发生反应的离子方程式为_______ 。
 ,还含有金、银、铂等)回收碲的工艺流程如下:
,还含有金、银、铂等)回收碲的工艺流程如下:
已知:
 有强还原性,且
有强还原性,且 、
、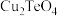 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式: 。
。回答下列问题:
(1)为提高“反应”效率,可采取的措施为
(2)滤液i的主要成分是

(3)“氧化”过程中发生反应的离子方程式为
(4)“沉碲”过程中发生反应的离子方程式为
您最近一年使用:0次
6 . 金属镓有“电子工业脊梁”的美誉,镓与铝的化学性质类似.从刚玉渣(含钛、镓的低硅铁合金,还含有少量氧化铝)回收镓的一种流程如图所示:
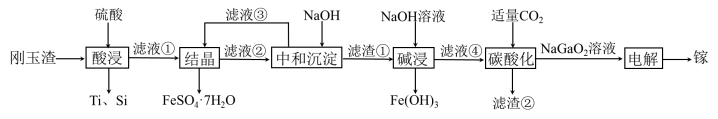
回答下列问题:
(1)镓原子结构示意图为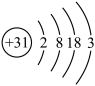 ,则其在元素周期表第
,则其在元素周期表第_________ 周期__________ 族。
(2)“酸浸”过程中禁止明火加热,原因是___________________________ ;为提高镓的浸出率,可采用的措施是__________________ (填一种即可)。
(3)“结晶”过程中得到 的操作主要为
的操作主要为__________________________ 。
(4)滤渣②的主要成分为_________________ 。
(5)“碳酸化”过程中不能通入过量 的原因为
的原因为______________________ (用离子方程式表示)。
(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为_____________________________ 。
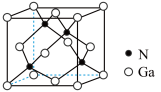
(7) 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为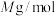 ,则该晶体的密度为
,则该晶体的密度为___________  (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

回答下列问题:
(1)镓原子结构示意图为
 ,则其在元素周期表第
,则其在元素周期表第(2)“酸浸”过程中禁止明火加热,原因是
(3)“结晶”过程中得到
 的操作主要为
的操作主要为(4)滤渣②的主要成分为
(5)“碳酸化”过程中不能通入过量
 的原因为
的原因为(6)氮化镓具有优异的光电性能.工业上常采用在1100℃条件下,利用Ga与
 反应可制备
反应可制备 ,该反应的化学方程式为
,该反应的化学方程式为(7)
 晶体的一种立方晶胞如图所示,已知晶胞参数为
晶体的一种立方晶胞如图所示,已知晶胞参数为 ,
, 的摩尔质量为
的摩尔质量为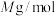 ,则该晶体的密度为
,则该晶体的密度为 (列出计算式,设
(列出计算式,设 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
7 . 按要求写出下列反应的离子方程式:
(1)碳酸氢钠溶液与稀盐酸混合:______________ 。
(2)少量二氧化碳通入澄清石灰水中:______________ 。
(3)氧化钠与稀盐酸反应:______________ 。
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:______________ 。
(5)配平下列离子方程式:
①Fe3++SO2+H2O=Fe2++ +H+
+H+____________________ ;
② +
+ +H+=CO2↑+Mn2++H2O
+H+=CO2↑+Mn2++H2O____________________ 。
(1)碳酸氢钠溶液与稀盐酸混合:
(2)少量二氧化碳通入澄清石灰水中:
(3)氧化钠与稀盐酸反应:
(4)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液呈中性:
(5)配平下列离子方程式:
①Fe3++SO2+H2O=Fe2++
 +H+
+H+②
 +
+ +H+=CO2↑+Mn2++H2O
+H+=CO2↑+Mn2++H2O
您最近一年使用:0次
解题方法
8 . 尿素[CO(NH2)2]合成的发展体现了化学科学与技术的不断进步。
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是___________ 。
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):
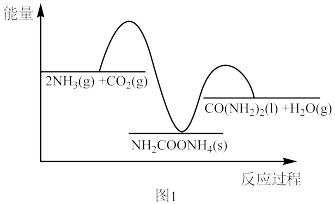
已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施___________ 。
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是___________ 。
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是___________ 。
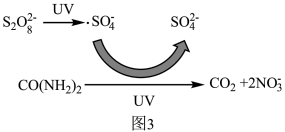
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为___________ 。
(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,
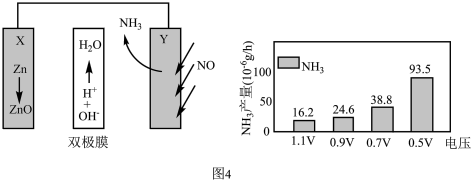
已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率= ×100%
×100%
①写出正极的电极反应式___________ 。
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为___________ 。(保留两位小数)
(1)十九世纪初,用氰酸银(AgOCN)与NH4Cl在一定条件下反应制得CO(NH2)2,实现了由无机物到有机物的合成。该反应的化学方程式是
(2)二十世纪初,工业上以CO2和NH3为原料在一定温度和压强下合成尿素。反应分两步(反应过程中能量变化如图1所示):

已知:Ⅰ.CO2和NH3生成NH2COONH4
Ⅱ.NH2COONH4分解生成尿素
①为防止反应Ⅰ中NH2COONH4分解为CO2和NH3,应采取的措施
A.升温 B.降温 C.增大压强 D.减少压强
②密闭体系中除发生Ⅰ和Ⅱ外,尿素会发生水解、尿素缩合生成缩二脲[(NH2CO)2NH]和尿素转化为氰酸铵等副反应。尿素生产中实际投入NH3和CO2物质的量之比为4:1,其实际投料比值远大于理论值的原因是
(3)尿素[CO(NH)2]溶液可吸收含SO2、NO烟气中SO2,其反应为:SO2+CO(NH2)2+2H2O=(NH4)2SO3+CO2,若吸收烟气时同时通入少量C1O2,可同时实现脱硫、脱硝。脱硝的反应分为两步。第一步:5NO+2ClO2+H2O=5NO2+2HCl;第二步:6NO2+4CO(NH2)2=7N2+4CO2+8H2O。将含SO2、NO烟气以一定的流速通过10%的CO(NH2)2溶液,其他条件相同,不通ClO2和通少量ClO2时SO2的去除率如图2所示。

①通少量ClO2时SO2的去除率较低的原因是
②处理后的废水含有尿素,可用过硫酸钠结合紫外线(UV)辐照去除废水中尿素,其过程机理如图3所示,尿素和过硫酸钠溶液发生的离子反应方程式为

(4)电催化NO合成技术凭借其低能耗、绿色环保等优势成为化工行业关注的热点。某科研团队设计的Zn-NO电池装置及在不同电压下NH3的单位时间产量如图4所示,

已知:a.双极膜中H2O电离出的H+和OH−在电场作用下可以向两极迁移;
b.法拉第效率=
 ×100%
×100%①写出正极的电极反应式
②0.7V电压下连续放电10小时,外电路通过1.8×10-4mole-,则法拉第效率为
您最近一年使用:0次
解题方法
9 . KIO3是常见的食盐加碘剂,某小组制备KIO3晶体的流程如下,请回答下列问题:

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为___________ 。
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是___________ (填字母)。
a. b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是___________ 。
(4)步骤⑧后,往滤液中加入一定量___________ ,再次抽滤,可提高产品收率。
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为___________ 。
②KIO3在酸性条件下氧化KI的离子方程式为___________ 。
③产品的质量分数为___________ (保留4位有效数字)。
④在确认滴定操作无误的情况下,质量分数异常的原因可能是___________ 。

已知:①碘易溶于乙醚;乙醚微溶于水,沸点:34.5℃,密度:0.714g∙cm-3,易燃。
②KIO3在水中的溶解度:20℃为8.1g,80℃为21.8g;KIO3难溶于乙醇。
(1)步骤①“氧化”的离子方程式为
(2)步骤②进行萃取操作时,需要放气,下图中正确的放气图示是
a.
 b.
b.  c.
c.
(3)步骤④用带磁力搅拌的电热套控温85℃加热约1h,判断氧化反应已完全的方法是
(4)步骤⑧后,往滤液中加入一定量
(5)为了测定KIO3产品的纯度,可采用碘量法滴定。准确称取1.000g产品,配制成250.00mL溶液,用移液管移取25.00mL溶液于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液充分反应,加淀粉指示剂,用0.1000mol·L−1的Na2S2O3标准溶液滴定,平行测定3次,平均消耗标准溶液28.80mL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O
①滴定管需要用标准溶液润洗,润洗滴定管的具体操作为
②KIO3在酸性条件下氧化KI的离子方程式为
③产品的质量分数为
④在确认滴定操作无误的情况下,质量分数异常的原因可能是
您最近一年使用:0次
解题方法
10 . 铁的化合物有广泛用途,如三草酸合铁(Ⅲ)酸钾晶体 是一种光敏材料,也可作催化剂;碳酸亚铁(
是一种光敏材料,也可作催化剂;碳酸亚铁( )可作补血剂等。以废铁屑(含
)可作补血剂等。以废铁屑(含 及少量
及少量 和
和 )为原料制备以上物质的流程如下:
)为原料制备以上物质的流程如下:

已知:①25℃, ,
, ,
, 。
。
②金属离子浓度 时,可认为该金属离子已沉淀完全。
时,可认为该金属离子已沉淀完全。
③ 为可溶于水、难溶于乙醇的翠绿色晶体。
为可溶于水、难溶于乙醇的翠绿色晶体。
回答下列问题:
(1)滤液Ⅰ中含有 、
、 ,检验
,检验 所用的试剂为
所用的试剂为___________ 溶液(填化学式)。
(2)室温下,若滤液Ⅰ中 为2.0
为2.0 ,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中
,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中 至少应大于
至少应大于___________  。
。
(3)将滤液Ⅱ与饱和 溶液混合,发生反应的离子方程式为
溶液混合,发生反应的离子方程式为___________ 。已知饱和 溶液的
溶液的 大于11,是否能用饱和
大于11,是否能用饱和 溶液代替饱和
溶液代替饱和 溶液来制备
溶液来制备 ?
?___________ (填“是”或“否”)。
(4)滤液Ⅰ与足量空气发生反应的离子方程式为___________ 。甲同学认为该步反应用稀 溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是
溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是___________ 。
(5)用乙醇洗涤翠绿色晶体而不用水洗涤的目的为___________ 。
 是一种光敏材料,也可作催化剂;碳酸亚铁(
是一种光敏材料,也可作催化剂;碳酸亚铁( )可作补血剂等。以废铁屑(含
)可作补血剂等。以废铁屑(含 及少量
及少量 和
和 )为原料制备以上物质的流程如下:
)为原料制备以上物质的流程如下:
已知:①25℃,
 ,
, ,
, 。
。②金属离子浓度
 时,可认为该金属离子已沉淀完全。
时,可认为该金属离子已沉淀完全。③
 为可溶于水、难溶于乙醇的翠绿色晶体。
为可溶于水、难溶于乙醇的翠绿色晶体。回答下列问题:
(1)滤液Ⅰ中含有
 、
、 ,检验
,检验 所用的试剂为
所用的试剂为(2)室温下,若滤液Ⅰ中
 为2.0
为2.0 ,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中
,要保证滤液Ⅰ中不出现沉淀,则滤液Ⅰ中 至少应大于
至少应大于 。
。(3)将滤液Ⅱ与饱和
 溶液混合,发生反应的离子方程式为
溶液混合,发生反应的离子方程式为 溶液的
溶液的 大于11,是否能用饱和
大于11,是否能用饱和 溶液代替饱和
溶液代替饱和 溶液来制备
溶液来制备 ?
?(4)滤液Ⅰ与足量空气发生反应的离子方程式为
 溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是
溶液代替空气效果更好,乙同学不同意甲同学的观点,乙同学的理由是(5)用乙醇洗涤翠绿色晶体而不用水洗涤的目的为
您最近一年使用:0次



