1 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+aNa2O2═2Na2FeO4+bX+2Na2SO4+cO2↑
该反应中物质X应是___________ ,b与c的关系是___________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式:___________ 。
②每生成1molFeO 转移
转移___________ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为___________ mol。
(1)干法制备高铁酸钠的主要反应为:2FeSO4+aNa2O2═2Na2FeO4+bX+2Na2SO4+cO2↑
该反应中物质X应是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1molFeO
 转移
转移
您最近一年使用:0次
名校
2 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质:资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)
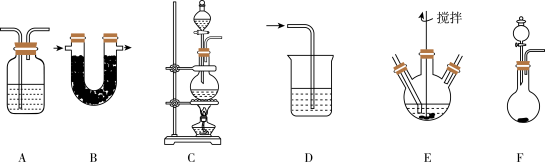
①请写出该过程中制备氯气的离子反应方程式_______ (锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_______ →E→_______ 。(上述装置不一定全部用到,装置可以重复选用)
③E中得到紫色固体和溶液。E中生成高铁酸钾的反应为_______ ;反应充分进行后,E中溶液中主要的阴离子为_______ 。
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl−而产生Cl2,设计以下方案:
①由方案Ⅰ中溶液变红可知a中含有_______ 离子,但该离子的产生不能判断一定是K2FeO4将Cl−氧化,还可能由_______ 产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是_______ 。
(1)制备K2FeO4(夹持装置略)

①请写出该过程中制备氯气的离子反应方程式
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为
③E中得到紫色固体和溶液。E中生成高铁酸钾的反应为
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl−而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,有Cl2产生。 |
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是
您最近一年使用:0次
名校
3 . Cl2在70℃的NaOH水溶液中自身发生氧化还原反应,完全反应后,测得溶液中有NaCl、NaClO、NaClO3,其中NaClO与NaClO3的个数之比为4︰1,则溶液中NaCl与NaClO的个数之比为
| A.1︰1 | B.5︰4 | C.9︰4 | D.11︰2 |
您最近一年使用:0次
2022-09-11更新
|
1144次组卷
|
7卷引用:湖北省蕲春县2020-2021学年高一上学期期中教学质量检测化学试题
名校
解题方法
4 . I.固体化合物X由3种元素组成。某学习小组进行了如下实验:

请回答:
(1)由现象 1 得出化合物X含有_______ 元素(填元素符号)。
(2)固体混合物Y由两种物质组成,请写出其成分_______ (填化学式)。
(3)X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到棕黄色溶液,该反应的化学方程式是_______ 。
II.某校化学研究性学习小组为探究金属钠能否与二氧化碳气体反应设计了如下实验:将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,结果发现钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。为确定白色产物,该小组同学进一步展开探究。
(1)通过分析,对白色产物成分的可能情况提出了如下几种假设:
假设1:白色产物为Na2O
假设2:白色产物为Na2CO3
假设3:_______
(2)为验证假设3正确,请设计实验方案验证_______
限选试剂:蒸馏水、2mol/L H2SO4、BaCl2溶液、澄清石灰水、酚酞试剂

请回答:
(1)
(2)固体混合物Y由两种物质组成,请写出其成分
(3)X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到棕黄色溶液,该反应的化学方程式是
II.某校化学研究性学习小组为探究金属钠能否与二氧化碳气体反应设计了如下实验:将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,结果发现钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上黏附着白色物质。为确定白色产物,该小组同学进一步展开探究。
(1)通过分析,对白色产物成分的可能情况提出了如下几种假设:
假设1:白色产物为Na2O
假设2:白色产物为Na2CO3
假设3:
(2)为验证假设3正确,请设计实验方案验证
限选试剂:蒸馏水、2mol/L H2SO4、BaCl2溶液、澄清石灰水、酚酞试剂
您最近一年使用:0次
2021-04-07更新
|
372次组卷
|
3卷引用:浙江省余姚中学2020-2021 学年高一上学期期中考试化学试题
名校
5 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用 固体来配制
固体来配制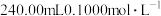 的
的 酸性溶液。
酸性溶液。
①计算所需 固体的质量为
固体的质量为_______  (计算结果保留两位小数)
(计算结果保留两位小数)
②需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、_______ 。
③下列操作导致所配溶液物质的量浓度偏小的是_______ (填序号)
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.定容加水时超过刻度线后,立即吸出多余的水
d.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
(2)用上述酸性 溶液来测定
溶液来测定 溶液中
溶液中 的物质的量浓度,原理是用一定物质的量浓度的
的物质的量浓度,原理是用一定物质的量浓度的 溶液与一定体积的
溶液与一定体积的 溶液恰好完全反应。该反应的化学方程式为:
溶液恰好完全反应。该反应的化学方程式为:
①用双线桥法标出该反应电子转移的方向和数目_______ 。

②实验时应测定的数据有:量取 溶液的体积和
溶液的体积和_______ 。
(3) 溶液也可以与草酸(
溶液也可以与草酸( )反应,
)反应, 被还原为
被还原为 。若称取
。若称取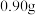 草酸溶于稀硫酸后,用上述
草酸溶于稀硫酸后,用上述 溶液与草酸反应,恰好完全反应时消耗
溶液与草酸反应,恰好完全反应时消耗 溶液
溶液 。则
。则 的氧化产物化学式为
的氧化产物化学式为_______ 。
(1)实验室里欲用
 固体来配制
固体来配制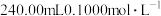 的
的 酸性溶液。
酸性溶液。①计算所需
 固体的质量为
固体的质量为 (计算结果保留两位小数)
(计算结果保留两位小数)②需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、
③下列操作导致所配溶液物质的量浓度偏小的是
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.定容加水时超过刻度线后,立即吸出多余的水
d.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
(2)用上述酸性
 溶液来测定
溶液来测定 溶液中
溶液中 的物质的量浓度,原理是用一定物质的量浓度的
的物质的量浓度,原理是用一定物质的量浓度的 溶液与一定体积的
溶液与一定体积的 溶液恰好完全反应。该反应的化学方程式为:
溶液恰好完全反应。该反应的化学方程式为:
①用双线桥法标出该反应电子转移的方向和数目

②实验时应测定的数据有:量取
 溶液的体积和
溶液的体积和(3)
 溶液也可以与草酸(
溶液也可以与草酸( )反应,
)反应, 被还原为
被还原为 。若称取
。若称取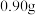 草酸溶于稀硫酸后,用上述
草酸溶于稀硫酸后,用上述 溶液与草酸反应,恰好完全反应时消耗
溶液与草酸反应,恰好完全反应时消耗 溶液
溶液 。则
。则 的氧化产物化学式为
的氧化产物化学式为
您最近一年使用:0次
2021-03-26更新
|
362次组卷
|
2卷引用:江苏省苏州市新区实验中学2020-2021学年高一上学期期中考试化学试卷
19-20高三·江苏苏州·期末
名校
6 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
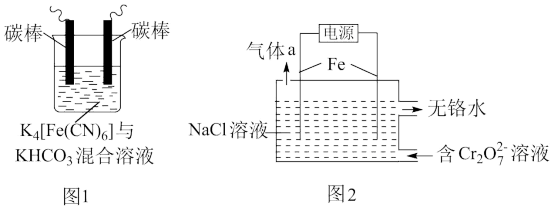
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
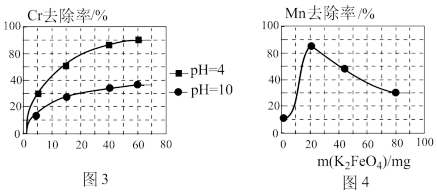
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:【苏州新东方】化学试卷
(已下线)【苏州新东方】化学试卷江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题
7 . 按要求回答下列问题:
I.O4是意大利的一位科学家合成的一种新型氧分子,一个分子由四个氧原子构成,在相同条件下,等质量的O4和O3氧原子数之比为______ ;两种气体的体积之比为______ 。
II.LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:
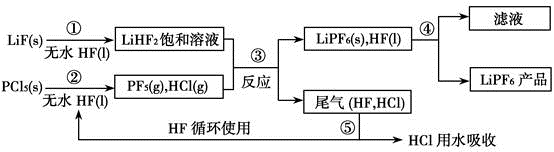
已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是______ 、______ 。反应设备不能用玻璃材质的原因是______ (用化学方程式表示)。
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:______ 。
(3)第④步分离采用的方法是______ ;第⑤步分离尾气中HF、HCl采用的方法是______ 。
(4)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:
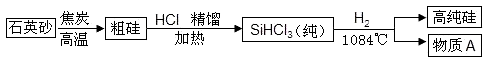
①制备粗硅的化学方程式为______ ;
②物质A的化学式为______ 。
③已知SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:______ ;H2还原SiHCl3过程中若混入O2,可能引起的后果是______ ;整个制备过程必须严格控制______ 。
I.O4是意大利的一位科学家合成的一种新型氧分子,一个分子由四个氧原子构成,在相同条件下,等质量的O4和O3氧原子数之比为
II.LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是-85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是
(2)该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:
(3)第④步分离采用的方法是
(4)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:

①制备粗硅的化学方程式为
②物质A的化学式为
③已知SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:
您最近一年使用:0次
名校
解题方法
8 . 碘(I2)与硫代硫酸钠(Na2S2O3)之间的氧化还原反应是一个在定量分析中常见的化学反应。用碘液滴定硫代硫酸钠溶液时,25.0 mL 0.100 mol/L的硫代硫酸钠溶液,恰好消耗了12.5 mL 0.100 mol/L的碘液,并把I2还原为I-。则 转化为
转化为
 转化为
转化为| A.S2- | B. | C.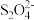 | D. |
您最近一年使用:0次
名校
解题方法
9 . 铑(Rh)是铂系金属中的一种,其氧化态性质稳定且极难溶解而其氢氧化物是一种两性化合物,含铑催化剂化学工业中都有广泛的应用。以下是一种从废铑催化剂(杂质主要为有机杂质和少量Cu)中回收铑的工艺流程:

(1)焚烧的目的是________ 。
(2)实验室探究焚烧温度对铑回收率的影响,结果如图,当焚烧温度选择320℃时,回收效果最好,请解释选择此温度的可能的原因是:_________ 。

(3)用KHSO4熔融的目的是将焚烧后的铑和铜转化成可溶性的Rh2(SO4)3和CuSO4,写出铑和KHSO4反应的化学方程式_________ 。
(4)用氨水除杂的原理是(用离子方程式和简要文字表述)_________ ,此步骤中,pH不能太高(实际调节pH在8左右)的原因是_________ 。
(5)电解还原时,铑将在_____ 极(填“阳”或者“阴”)析出。
(6)铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为_______ 。

(1)焚烧的目的是
(2)实验室探究焚烧温度对铑回收率的影响,结果如图,当焚烧温度选择320℃时,回收效果最好,请解释选择此温度的可能的原因是:

(3)用KHSO4熔融的目的是将焚烧后的铑和铜转化成可溶性的Rh2(SO4)3和CuSO4,写出铑和KHSO4反应的化学方程式
(4)用氨水除杂的原理是(用离子方程式和简要文字表述)
(5)电解还原时,铑将在
(6)铑的某配合物的化学式为CsRh(SO4)2,该物质易溶于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成,该盐溶于水的电离方程式为
您最近一年使用:0次
名校
解题方法
10 . 下列离子方程式书写正确的是( )
A.用Na2SO3溶液吸收少量Cl2:3 +Cl2+H2O═2 +Cl2+H2O═2 +2Cl﹣+ +2Cl﹣+ |
| B.FeI2溶液中滴入过量溴水:2Fe2++2I﹣+2Br2═2Fe3++I2+4Br﹣ |
C.草酸使酸性高锰酸钾溶液褪色:2 +5 +5 +16H+═2Mn2++10CO2↑+8H2O +16H+═2Mn2++10CO2↑+8H2O |
D.向NH4HCO3溶液中滴加少量NaOH溶液: +OH﹣═NH3•H2O +OH﹣═NH3•H2O |
您最近一年使用:0次
2020-12-25更新
|
1200次组卷
|
6卷引用:辽宁省大连市第二十四中学2021届高三上学期期中考试化学试题
辽宁省大连市第二十四中学2021届高三上学期期中考试化学试题(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)湖南省衡阳市2022届高三下学期联考 (三模)化学试题辽宁省大连市第一〇三中学2022届高三第八次考试化学试题



