名校
解题方法
1 . 如图是无机物 在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体,
在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体, 都含有相同的元素。
都含有相同的元素。
(1)写出反应①的化学方程式:_______ 。
(2)在①②③④中属于氮的固定的是_______ (填序号)。
(3)下列说法正确的是_______(填字母)。
(4) 易溶于水。已知某温度压强下
易溶于水。已知某温度压强下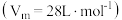 ,将体积为
,将体积为 的试管充满
的试管充满 后倒扣在水中。
后倒扣在水中。
①最终试管中所得 的物质的量浓度为(不考虑
的物质的量浓度为(不考虑 的扩散)
的扩散)_______  。
。
②若 按物质的量之比
按物质的量之比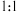 被
被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是_______ 。为提高吸收速率与效率,最好选用_______ 装置(填字母)。 制取
制取 ,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗
,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗 的
的 制取
制取 ,在该过程中至少消耗的
,在该过程中至少消耗的 的物质的量为
的物质的量为_______  。
。
(6)实验室里检验 中阳离子的方法是
中阳离子的方法是_______ 。
 在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体,
在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体, 都含有相同的元素。
都含有相同的元素。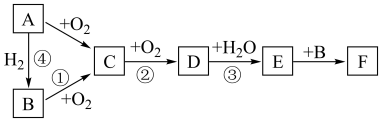
(1)写出反应①的化学方程式:
(2)在①②③④中属于氮的固定的是
(3)下列说法正确的是_______(填字母)。
A.通过水可以除去 中含有的少量D 中含有的少量D |
B.物质 均可以用向上排空气法收集 均可以用向上排空气法收集 |
C. 的浓溶液的存放方法是保存在无色细口玻璃瓶 的浓溶液的存放方法是保存在无色细口玻璃瓶 |
D.物质 中只含离子键 中只含离子键 |
(4)
 易溶于水。已知某温度压强下
易溶于水。已知某温度压强下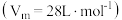 ,将体积为
,将体积为 的试管充满
的试管充满 后倒扣在水中。
后倒扣在水中。①最终试管中所得
 的物质的量浓度为(不考虑
的物质的量浓度为(不考虑 的扩散)
的扩散) 。
。②若
 按物质的量之比
按物质的量之比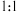 被
被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是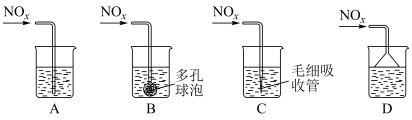
 制取
制取 ,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗
,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗 的
的 制取
制取 ,在该过程中至少消耗的
,在该过程中至少消耗的 的物质的量为
的物质的量为 。
。(6)实验室里检验
 中阳离子的方法是
中阳离子的方法是
您最近一年使用:0次
名校
2 . 氧化还原反应在人类的生产、生活中有着重要的应用。回答下列问题:
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为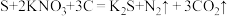 。该反应中,被还原的元素是
。该反应中,被还原的元素是________ (填元素符号),消耗的还原剂和氧化剂质量比为_________ 。
(2)实验室制备Cl2有三种常用方法:
a.
b.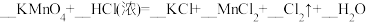
c.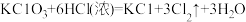
①配平反应b的方程式:___________ 。
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应_____ (填“a”“b”或“c”)。
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:___________ 。
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
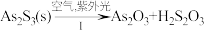 ,
,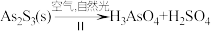 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I______ Ⅱ(填“>”“<”或“=”),转移的电子数之比为_______ 。
(1)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭按一定比例混合而成的,爆炸时发生的反应为
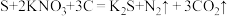 。该反应中,被还原的元素是
。该反应中,被还原的元素是(2)实验室制备Cl2有三种常用方法:
a.

b.
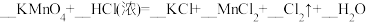
c.
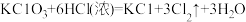
①配平反应b的方程式:
②当三个反应中参与反应的HCl的质量相同时,得到Cl2的质量最多的是反应
(3)以MnO2为原料在加热熔融条件下可以制取K2MnO4,该反应中包含的所有物质为MnO2、K2 MnO4、KCl、KOH、KClO3、H2O。写出该反应的化学方程式:
(4)油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄(As2S3,As为+3价,S为-2价)褪色的主要原因是发生了以下两种化学反应:
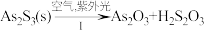 ,
,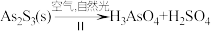 。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
。则反应I和Ⅱ中氧化相同量的As2S3,消耗O2与H2O的化学计量数之比:I
您最近一年使用:0次
名校
3 . 某反应的氧化剂与还原剂及部分产物如下所示: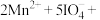 ∙∙∙∙∙∙
∙∙∙∙∙∙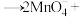 ∙∙∙∙∙∙已知该反应体系还包括
∙∙∙∙∙∙已知该反应体系还包括 、
、 与另一种含碘微粒。对于该氧化还原反应说法正确的是
与另一种含碘微粒。对于该氧化还原反应说法正确的是
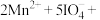 ∙∙∙∙∙∙
∙∙∙∙∙∙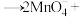 ∙∙∙∙∙∙已知该反应体系还包括
∙∙∙∙∙∙已知该反应体系还包括 、
、 与另一种含碘微粒。对于该氧化还原反应说法正确的是
与另一种含碘微粒。对于该氧化还原反应说法正确的是A. 是氧化剂, 是氧化剂, 是还原剂 是还原剂 | B.随着反应进行,溶液酸性降低 |
C.体系中另一种含碘微粒为 | D.每有1个 参加反应,转移2个电子 参加反应,转移2个电子 |
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.高铁酸钠(Na2FeO4)是过程中使用的一种新型净水剂,它的氧化性比高锰酸钾还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O。
(1)高铁酸钠中,铁元素的化合价是___________ ;上述制取高铁酸钠的反应过程中,铁元素被___________ (填“还原”或“氧化”)。
(2)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下:
步骤1:准确量取VmL溶液加入锥形瓶中;
步骤2:在强碱溶液中,用过量 与
与 反应生成Fe(OH)3和
反应生成Fe(OH)3和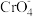 ;
;
步骤3:加足量稀硫酸,使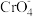 转化为
转化为 ,
, 转化为Cr3+,Fe(OH)3转化为Fe3+;
转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤4:加入二苯胺磺酸钠作指示剂,用(NH4)Fe(SO4)2溶液滴加至终点,消耗(NH4)Fe(SO4)2标准溶液V1mL,此时 恰好完全转化为Cr3+。(已知Fe2+会被
恰好完全转化为Cr3+。(已知Fe2+会被 氧化为Fe3+)
氧化为Fe3+)
写出步骤4发生反应的离子方程式为:___________ 。
Ⅱ.次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银,已知氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4:1,则氧化产物为___________ (填化学式)。
②从分类来看,NaH2PO2属于___________ (填序号)。。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(4)H3PO2的工业制法如下,请配平方程式____________ 。
_____P4+___Ba(OH)2+_____H2O=_____Ba(H2PO2)2+___PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下:
步骤1:准确量取VmL溶液加入锥形瓶中;
步骤2:在强碱溶液中,用过量
 与
与 反应生成Fe(OH)3和
反应生成Fe(OH)3和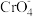 ;
;步骤3:加足量稀硫酸,使
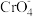 转化为
转化为 ,
, 转化为Cr3+,Fe(OH)3转化为Fe3+;
转化为Cr3+,Fe(OH)3转化为Fe3+;步骤4:加入二苯胺磺酸钠作指示剂,用(NH4)Fe(SO4)2溶液滴加至终点,消耗(NH4)Fe(SO4)2标准溶液V1mL,此时
 恰好完全转化为Cr3+。(已知Fe2+会被
恰好完全转化为Cr3+。(已知Fe2+会被 氧化为Fe3+)
氧化为Fe3+)写出步骤4发生反应的离子方程式为:
Ⅱ.次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银,已知氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4:1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(4)H3PO2的工业制法如下,请配平方程式
_____P4+___Ba(OH)2+_____H2O=_____Ba(H2PO2)2+___PH3↑
您最近一年使用:0次
5 . 某学习小组按如下实验流程从海带中提取碘单质。

已知:3I2+6NaOH=5NaI+NaIO3+3H2O,I2的沸点高于CCl4根据以上流程,判断下列说法正确的是

已知:3I2+6NaOH=5NaI+NaIO3+3H2O,I2的沸点高于CCl4根据以上流程,判断下列说法正确的是
| A.步骤X“分液”时,应打开旋塞,先将水层放出 |
B.加入H2SO4溶液后发生反应的离子方程式为: 5I-+IO +6H+=3I2+3H2O +6H+=3I2+3H2O |
| C.方案甲采用蒸馏法时,碘蒸气先汽化冷凝,在锥形瓶中先得到I2 |
| D.步骤Y中应加入过量的稀NaOH溶液 |
您最近一年使用:0次
2023-05-17更新
|
931次组卷
|
2卷引用:安徽省亳州市第二完全中学2022-2023学年高一下学期期中考试化学试题(特培班)
名校
解题方法
6 . 以黄铜矿( )和硫黄为原料制取Cu和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
)和硫黄为原料制取Cu和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
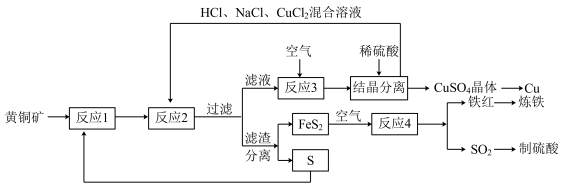
已知:反应2的离子方程式为 。
。
回答下列问题:
(1)铁红的化学式为___________ 。
(2)反应1的产物为___________ (填化学式)。
(3)请配平反应3中的离子方程式:___________ 。
_______ _______
_______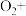 _______
_______ _______
_______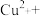 ______
______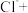 _______
_______
(4)写出反应4的化学方程式:___________ 。
(5)某硫酸厂为测定反应4所得气体中 的体积分数,取280mL(已折算成标准状况)气体(内含氮气、氧气、二氧化碳、二氧化硫等),缓缓通过足量的溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥、称量,沉淀的质量为0.233g。
的体积分数,取280mL(已折算成标准状况)气体(内含氮气、氧气、二氧化碳、二氧化硫等),缓缓通过足量的溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥、称量,沉淀的质量为0.233g。
①写出 与溴水反应的化学方程式:
与溴水反应的化学方程式:___________ 。
②反应4所得气体中 的体积分数为
的体积分数为___________ 。
(6)传统工艺制铜是将黄铜矿等铜矿与空气在高温下煅烧,这种方法的缺点是要消耗大量的热能以及___________ 。
 )和硫黄为原料制取Cu和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
)和硫黄为原料制取Cu和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
已知:反应2的离子方程式为
 。
。回答下列问题:
(1)铁红的化学式为
(2)反应1的产物为
(3)请配平反应3中的离子方程式:
_______
 _______
_______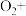 _______
_______ _______
_______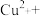 ______
______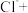 _______
_______
(4)写出反应4的化学方程式:
(5)某硫酸厂为测定反应4所得气体中
 的体积分数,取280mL(已折算成标准状况)气体(内含氮气、氧气、二氧化碳、二氧化硫等),缓缓通过足量的溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥、称量,沉淀的质量为0.233g。
的体积分数,取280mL(已折算成标准状况)气体(内含氮气、氧气、二氧化碳、二氧化硫等),缓缓通过足量的溴水,在所得溶液中加入过量的氯化钡溶液,产生白色沉淀,将沉淀洗涤、干燥、称量,沉淀的质量为0.233g。①写出
 与溴水反应的化学方程式:
与溴水反应的化学方程式:②反应4所得气体中
 的体积分数为
的体积分数为(6)传统工艺制铜是将黄铜矿等铜矿与空气在高温下煅烧,这种方法的缺点是要消耗大量的热能以及
您最近一年使用:0次
名校
解题方法
7 . 草酸(H2C2O4)用途广泛,是一种易溶于水的二元有机弱酸,具有还原性,为探究草酸被氧化的速率问题,高二化学小组进行如下实验:
Ⅰ.探究H2C2O4与KMnO4溶液反应
(1)在酸性条件下反应,写出H2C2O4与KMnO4溶液反应的离子方程式:___________
(2)为探究外界条件对反应速率的影响,阳阳进行了如下实验:
对比实验___________ (填实验编号),可探究草酸浓度对反应速率的影响;实验测得t3< t2,由此得出的结论是____________
Ⅱ.探究H2C2O4与 溶液反应
溶液反应
查阅资料:H2C2O4与 溶液反应很慢,需数月时间才能完成,但加入
溶液反应很慢,需数月时间才能完成,但加入 可促进H2C2O4与
可促进H2C2O4与 的反应。依据此资料,阳阳设计如下实验证实了这一点。
的反应。依据此资料,阳阳设计如下实验证实了这一点。
(3)实验Ⅳ的目的是:___________ 。
(4)对实验Ⅱ继续进行探究,发现溶液中 浓度变化如图:
浓度变化如图:
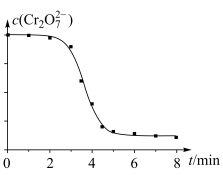
小宇认为此变化是通过两个过程实现的。
过程ⅰ: 与H2C2O4反应生成了
与H2C2O4反应生成了 。
。
过程ⅱ: 可加快草酸与重铬酸钾的反应
可加快草酸与重铬酸钾的反应
①查阅资料:溶液中 能被
能被 氧化为
氧化为 。针对过程ⅰ,小宇设计如下方法证实:
。针对过程ⅰ,小宇设计如下方法证实:
将 加入到
加入到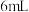
___________ 中,固体完全溶解;从中取出少量溶液,加入过量 固体,充分反应后静置,观察到
固体,充分反应后静置,观察到___________ 。
②小宇继续设计实验方案证实了过程ⅱ成立,他的实验方案如下:将2mL0.3moL/L H2C2O4溶液与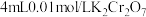 溶液混合,调至pH=2,加入
溶液混合,调至pH=2,加入 固体,6分钟后现象为:
固体,6分钟后现象为:___________ 。综合以上实验可知,草酸发生氧化反应的速率与___________ 有关。
Ⅰ.探究H2C2O4与KMnO4溶液反应
(1)在酸性条件下反应,写出H2C2O4与KMnO4溶液反应的离子方程式:
(2)为探究外界条件对反应速率的影响,阳阳进行了如下实验:
| 实验编号 | 所加试剂及用量/mL | 条件 | 溶液颜色褪至无色所需时间/min | |||
| 0.01mol/L H2C2O4溶液 | 0.01mol/L KMnO4溶液 | 3.0mol/L稀硫酸 | 水 | 温度/℃ | ||
| 1 | 8.0 | 2.0 | 2.0 | 3.0 | 20 | t1 |
| 2 | 6.0 | 2.0 | 2.0 | 5.0 | 20 | t2 |
| 3 | 6.0 | 2.0 | 2.0 | 5.0 | 30 | t3 |
| 4 | 5.0 | 2.0 | 2.0 | 5.0 | 30 | t4 |
Ⅱ.探究H2C2O4与
 溶液反应
溶液反应查阅资料:H2C2O4与
 溶液反应很慢,需数月时间才能完成,但加入
溶液反应很慢,需数月时间才能完成,但加入 可促进H2C2O4与
可促进H2C2O4与 的反应。依据此资料,阳阳设计如下实验证实了这一点。
的反应。依据此资料,阳阳设计如下实验证实了这一点。| 实验Ⅱ | 实验Ⅲ | 实验Ⅳ | |
| 实验操作 | 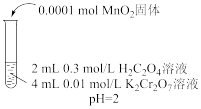 |  | 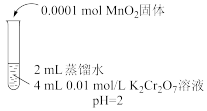 |
| 实验现象 | 6min后固体完全溶解,溶液橙色变浅,温度不变 | 6min后固体未溶解,溶液颜色无明显变化 | 6min后固体未溶解,溶液颜色无明显变化 |
(4)对实验Ⅱ继续进行探究,发现溶液中
 浓度变化如图:
浓度变化如图:
小宇认为此变化是通过两个过程实现的。
过程ⅰ:
 与H2C2O4反应生成了
与H2C2O4反应生成了 。
。过程ⅱ:
 可加快草酸与重铬酸钾的反应
可加快草酸与重铬酸钾的反应①查阅资料:溶液中
 能被
能被 氧化为
氧化为 。针对过程ⅰ,小宇设计如下方法证实:
。针对过程ⅰ,小宇设计如下方法证实:将
 加入到
加入到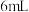
 固体,充分反应后静置,观察到
固体,充分反应后静置,观察到②小宇继续设计实验方案证实了过程ⅱ成立,他的实验方案如下:将2mL0.3moL/L H2C2O4溶液与
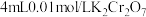 溶液混合,调至pH=2,加入
溶液混合,调至pH=2,加入 固体,6分钟后现象为:
固体,6分钟后现象为:
您最近一年使用:0次
2021-11-20更新
|
511次组卷
|
2卷引用:安徽省合肥市第六中学2021-2022学年高二上学期期中教学检测化学试题
名校
解题方法
8 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
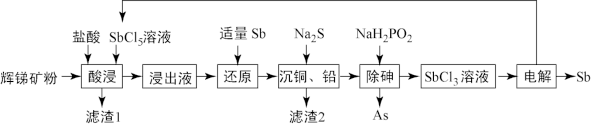
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1110次组卷
|
3卷引用:安徽省黄山市屯溪第一中学2021-2022学年高一上学期期中考试化学试题
名校
9 . 图是一种综合处理 SO2废气的工艺流程。下列说法正确的是
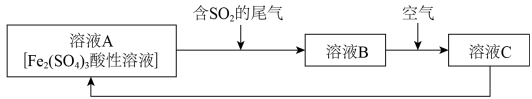

| A.向B溶液中滴加KSCN 溶液,溶液一定变为红色 |
| B.溶液 B 转化为溶液C发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O |
| C.溶液酸性 A>B>C |
| D.加氧化亚铁可以使溶液 C 转化为溶液 A |
您最近一年使用:0次
名校
10 . 图中展示的是乙烯催化氧化的过程(部分配平相关离子未画出),下列描述错误的是


A.PbCl 和Cu2+在反应中都起到催化剂的作用 和Cu2+在反应中都起到催化剂的作用 |
| B.该转化过程中,仅O2和Cu2+均体现了氧化性 |
| C.该转化过程中,涉及反应4Cu+ +O2+4H+=4Cu2++2H2O |
D.乙烯催化氧化的反应方程式为2CH2=CH2 + O2  2CH3CHO 2CH3CHO |
您最近一年使用:0次
2020-12-18更新
|
1672次组卷
|
15卷引用:安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题
安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题河北省唐山市一中2020-2021学年高二下学期期中考试化学试题安徽省六校教育研究会2022届高三第一次素质测试化学试题安徽省合肥市第六中学2022届高三上学期开学考试化学试题辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题重庆市第八中学校2021届高三高考适应性月考卷(三)化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)湖南省岳阳市2021届高三二模考试化学试题湖南省郴州市2022届高三上学期第一次月考化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题辽宁省协作体2021-2022学年下学期高三第一次模拟考试化学试题辽宁省阜新市实验中学2021-2022学年高三下学期第一次模拟考试化学试题天津市和平区2023届高三下学期第一次质量调查化学试题湖北省武汉市重点中学5G联合体2022-2023学年高二下学期期末考试化学试题



