名校
解题方法
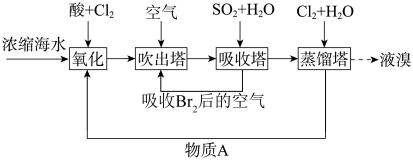
1 . 海洋资源的利用具有广阔的前景。利用空气吹出法从海水中提取溴的流程如图:
(1)“吸收塔”中发生反应的离子方程式为_______ 。
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在_____ (填序号)。
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A_____ (填化学式)可以循环利用。
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的 的百分含量如图:
的百分含量如图: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①结合实际生产,“氧化”的适宜条件为______ 。
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为______ 。
③吸收后的空气进行循环利用,吹出时,吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:______ 。
(1)“吸收塔”中发生反应的离子方程式为
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的
 的百分含量如图:
的百分含量如图: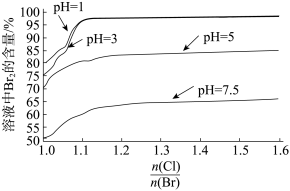
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①结合实际生产,“氧化”的适宜条件为
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为
③吸收后的空气进行循环利用,吹出时,吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:
您最近半年使用:0次
名校
2 . 某同学设计如图实验方案,从海带中提取 。下列说法正确的是
。下列说法正确的是
 。下列说法正确的是
。下列说法正确的是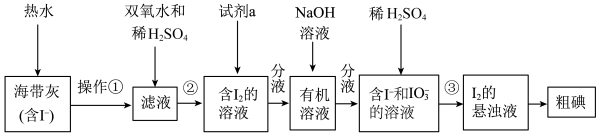
| A.操作①是萃取 |
| B.②中双氧水作还原剂 |
C.③的离子方程式是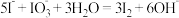 |
D.含 的溶液经3步转化为 的溶液经3步转化为 的悬浊液,其目的是富集,便于分离提纯 的悬浊液,其目的是富集,便于分离提纯 |
您最近半年使用:0次
解题方法
3 .  广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。
② 下,
下, 的
的 的
的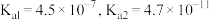 ,
, 的
的 。
。
③当离子浓度 时,可视为沉淀完全。
时,可视为沉淀完全。
回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为_______ ,“滤渣1”的主要成分是 、
、_______ (填化学式)。
(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
(3)等浓度的① 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为_______ (用标号表示)。
(4)室温时,“沉铝”过程发生反应的离子方程式为_______ 。用 调节溶液的
调节溶液的
_______ (保留一位小数),“沉铝”完全。
(5)“沉锌”工序中生成 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式:_______ ;“滤液”的主要成分为 ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:_______ 。
 广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为
广泛应用于油漆颜料、合成橡胶、电池、阻燃剂、药膏等产品。某锌矿的主要成分为 ,杂质为
,杂质为 等元素的化合物,提取氧化锌的工艺流程如图。
等元素的化合物,提取氧化锌的工艺流程如图。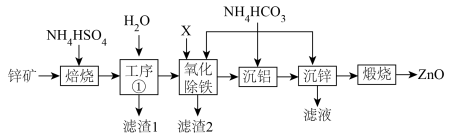
②
 下,
下, 的
的 的
的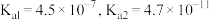 ,
, 的
的 。
。③当离子浓度
 时,可视为沉淀完全。
时,可视为沉淀完全。回答下列问题:
(1)为了提高“焙烧”效率,可采取的措施为
 、
、(2)若考虑环保因素,“氧化除铁”工序加入的X应选择_______(填标号)最合适。
A. | B. | C. | D. |
(3)等浓度的①
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ 溶液的
溶液的 从小到大的顺序为
从小到大的顺序为(4)室温时,“沉铝”过程发生反应的离子方程式为
 调节溶液的
调节溶液的
(5)“沉锌”工序中生成
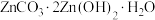 沉淀,写出发生反应的离子方程式:
沉淀,写出发生反应的离子方程式: ,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
,经蒸发浓缩结晶,所得晶体可返回“焙烧”工序循环利用,写出结晶过程发生反应的化学方程式:
您最近半年使用:0次
4 . 利用粗盐制备绿色消毒剂 (二氧化氯,可用于水果保鲜)的流程如下:
(二氧化氯,可用于水果保鲜)的流程如下: 气体能被多种稳定剂吸收,稳定剂加酸后释放
气体能被多种稳定剂吸收,稳定剂加酸后释放 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。 ,反应池中反应为
,反应池中反应为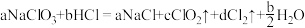 。下列叙述正确的是
。下列叙述正确的是
 (二氧化氯,可用于水果保鲜)的流程如下:
(二氧化氯,可用于水果保鲜)的流程如下: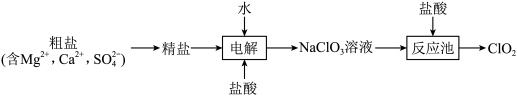
 气体能被多种稳定剂吸收,稳定剂加酸后释放
气体能被多种稳定剂吸收,稳定剂加酸后释放 的浓度随时间的变化如图所示。
的浓度随时间的变化如图所示。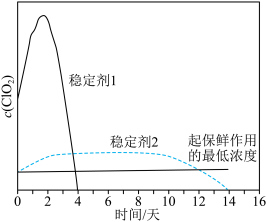
 ,反应池中反应为
,反应池中反应为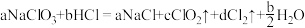 。下列叙述正确的是
。下列叙述正确的是A.粗盐提纯中所加试剂顺序可以为 |
B.若反应池中反应通过原电池实现,则 是负极产物 是负极产物 |
C.反应池中反应的化学计量数: |
D.若将 用于水果保鲜,效果较好的是稳定剂1 用于水果保鲜,效果较好的是稳定剂1 |
您最近半年使用:0次
名校
5 . SO2、NOx为常见的空气污染物,会引起酸雨、光化学烟雾等污染问题。研究者以多种方法进行“脱硫”“脱硝”。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:___________ ;
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为___________ 。
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:___________ 。
②反应b中的氧化剂和还原剂的物质的量之比为___________ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示: 、NO
、NO 。
。
①NO在吸收过程中,反应的离子方程式是___________ 。
②50℃时,吸收液中烟气转化生成的Cl‒和NO 的物质的量之比为
的物质的量之比为___________ 。
③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为___________ mg·L‒1。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:
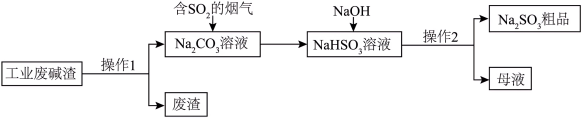
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:
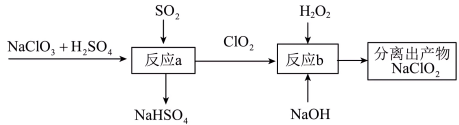
②反应b中的氧化剂和还原剂的物质的量之比为
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示:
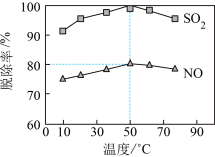
 、NO
、NO 。
。①NO在吸收过程中,反应的离子方程式是
②50℃时,吸收液中烟气转化生成的Cl‒和NO
 的物质的量之比为
的物质的量之比为③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO
 ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
您最近半年使用:0次
名校
6 . 氮在自然界中的循环涉及地球上生物圈的方方面面。

| A.细菌对氮元素的循环有重要作用 |
| B.硝化过程和反硝化过程均为氧化还原反应 |
| C.氨氧化过程中氧化产物和还原产物的质量比为1∶1 |
D.Fe3+将NH 转化为N2的离子方程式为Fe3++2NH 转化为N2的离子方程式为Fe3++2NH =Fe2++N2↑+8H+ =Fe2++N2↑+8H+ |
您最近半年使用:0次
名校
7 . 氰化氢(HCN,一元弱酸,易挥发)主要应用于电镀、采矿、药物合成等工业生产。HCN,CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,___________ 。
(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是___________ 。
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是___________ 。 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g) NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0
除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是___________ 。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是
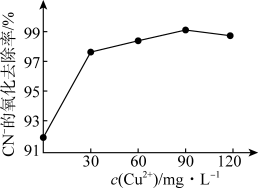
 ,其反应的离子方程式为
,其反应的离子方程式为(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g)
 NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近半年使用:0次
名校
解题方法
8 . V2O5(五氧化二钒)可作化学工业中的催化剂。为回收利用含钒催化剂,研制了一种利用废催化剂(含有V2O5、VOSO4、不溶性硅酸盐)回收V2O5的新工艺流程如下:
②部分含钒物质常温下在水中的溶解性如表所示:
③ +2OH-
+2OH-
 +H2O
+H2O
回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为___________ 。
(2)在第Ⅱ步中需要加入氨水,请结合 +2OH-
+2OH-
 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为___________ 。
(3)需在流动空气中加热NH4VO3的原因可能是___________ 。
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为___________ (保留4位有效数字)。(已知:I2+2 Na2S2O3= Na2S4O6+2NaI,写出计算过程)

②部分含钒物质常温下在水中的溶解性如表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
 +2OH-
+2OH-
 +H2O
+H2O回答下列问题:
(1)在滤渣1中加入Na2SO3和过量H2SO4溶液发生反应生成VOSO4的化学方程式为
(2)在第Ⅱ步中需要加入氨水,请结合
 +2OH-
+2OH-
 +H2O,用平衡移动原理解释加入氨水的作用为
+H2O,用平衡移动原理解释加入氨水的作用为(3)需在流动空气中加热NH4VO3的原因可能是
(4)将0.250g产品溶于强碱溶液中,加热煮沸,调节pH为8~8.5,向反应后的溶液中加入硫酸酸化的KI溶液(过量),溶液中的还原产物为V3+离子,滴加指示剂,用0.250mol/LNa2S2O3溶液滴定,达到终点时消耗Na2S2O3标准溶液20.00mL,则该产品的纯度为
您最近半年使用:0次
名校
9 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为___________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2 +H2O
+H2O
2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2
 +H2O
+H2O2NO2+2OH-=
 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。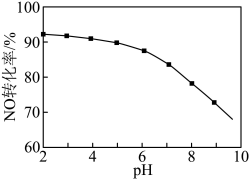
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近半年使用:0次
解题方法
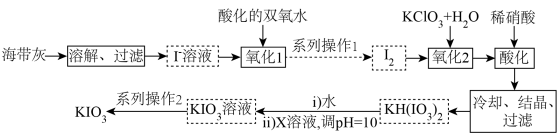
10 . 1833年,布森戈提出用富含碘的盐治疗甲肿,这是第一位提出向盐中添加碘防治甲肿的人。我国政府规定:碘盐添加KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图所示。
(1) KIO3属于__________ (填“酸”“碱”“盐”或“氧化物”),其中I的化合价为__________ 价。
(2)“氧化1”中发生反应的离子方程式为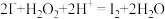 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:______________ ,该氧化过程中需要控制温度不宜过高,其原因是______________ 。系列操作2包括蒸发浓缩_______________ 过滤、乙醇洗涤、干燥等。
(3)X的化学式为______________ 。
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应: (未配平)。
(未配平)。
①根据上述数据,测得产品中碘元素质量分数为__________ (用含w、c、V的表达式表示)。
②如果将稀硫酸换成稀硝酸,则测得结果会__________ (填“偏高”“偏低”或“无影响”)。
(1) KIO3属于
(2)“氧化1”中发生反应的离子方程式为
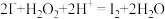 ,用单线桥法标出该反应中电子转移的方向和数目:
,用单线桥法标出该反应中电子转移的方向和数目:(3)X的化学式为
(4)测定产品纯度:称取wg产品溶于蒸馏水,滴加适量稀硫酸,加入VmLcmol/LKI溶液恰好完全反应,发生反应:
 (未配平)。
(未配平)。①根据上述数据,测得产品中碘元素质量分数为
②如果将稀硫酸换成稀硝酸,则测得结果会
您最近半年使用:0次



