真题
解题方法
1 . 填空
(1)铜的价层电子排布式是______ , 与
与 中半径较大的是
中半径较大的是______ 。
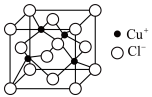
(2)铜的一种化合物的晶胞如图所示,其化学式为______ 。
(3)在H2O2作用下,铜与浓盐酸的反应可用于制备 ,写出该反应化学方程式:
,写出该反应化学方程式:______ 。反应中,H2O2实际消耗量总是大于理论的原因是______ 。H2O2电子式为______ 。
(4)上述制备反应中,下列物质均可替代H2O2作氧化剂,最适合的是是______ (填序号)。
a. b.
b. c.
c.
(5)Cu2+和I-的反应可用于Cu含量的定量分析。向CuCl2溶液中滴入KI溶液,生成一种碘化物白色沉淀,且上层溶液可使淀粉溶液变蓝。该白色沉淀的化学式为______ 。反应中KI的作用为______ 。
(1)铜的价层电子排布式是
 与
与 中半径较大的是
中半径较大的是(2)铜的一种化合物的晶胞如图所示,其化学式为

(3)在H2O2作用下,铜与浓盐酸的反应可用于制备
 ,写出该反应化学方程式:
,写出该反应化学方程式:(4)上述制备反应中,下列物质均可替代H2O2作氧化剂,最适合的是是
a.
 b.
b. c.
c.
(5)Cu2+和I-的反应可用于Cu含量的定量分析。向CuCl2溶液中滴入KI溶液,生成一种碘化物白色沉淀,且上层溶液可使淀粉溶液变蓝。该白色沉淀的化学式为
您最近半年使用:0次
2 . 固态化合物Y的组成为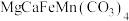 ,以Y为原料实现如下转化。
,以Y为原料实现如下转化。
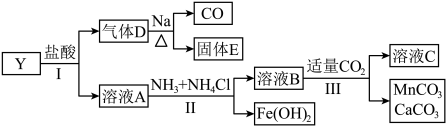
已知: 与溶液A中金属离子均不能形成配合物。
与溶液A中金属离子均不能形成配合物。
请回答:
(1)依据步骤Ⅲ, 、
、 和
和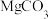 中溶解度最大的是
中溶解度最大的是_______ 。写出溶液C中的所有阴离子_______ 。步骤Ⅱ中,加入 的作用是
的作用是_______ 。
(2)下列说法正确的是_______。
(3)酸性条件下,固体 (微溶于水,其还原产物为无色的
(微溶于水,其还原产物为无色的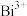 )可氧化
)可氧化 为
为 ,根据该反应原理,设计实验验证Y中含有
,根据该反应原理,设计实验验证Y中含有 元素
元素_______ ;写出 转化为
转化为 的离子方程式
的离子方程式_______ 。
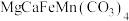 ,以Y为原料实现如下转化。
,以Y为原料实现如下转化。
已知:
 与溶液A中金属离子均不能形成配合物。
与溶液A中金属离子均不能形成配合物。请回答:
(1)依据步骤Ⅲ,
 、
、 和
和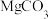 中溶解度最大的是
中溶解度最大的是 的作用是
的作用是(2)下列说法正确的是_______。
| A.气体D是形成酸雨的主要成分 | B.固体E可能含有 |
C.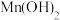 可溶于 可溶于 溶液 溶液 | D.碱性: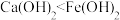 |
(3)酸性条件下,固体
 (微溶于水,其还原产物为无色的
(微溶于水,其还原产物为无色的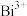 )可氧化
)可氧化 为
为 ,根据该反应原理,设计实验验证Y中含有
,根据该反应原理,设计实验验证Y中含有 元素
元素 转化为
转化为 的离子方程式
的离子方程式
您最近半年使用:0次
2024-02-02更新
|
1231次组卷
|
2卷引用:2024年浙江高考真题化学(1月)
2022·北京·高考真题
3 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
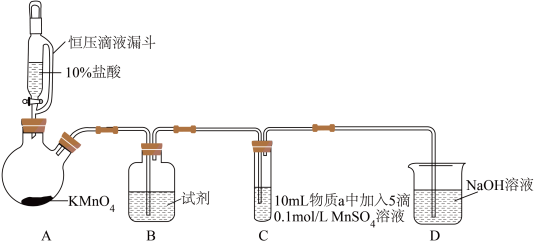
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近半年使用:0次
2023-11-29更新
|
606次组卷
|
29卷引用:2022年北京市高考真题化学试题(部分试题)
(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
2023·河北·高考真题
4 . 闭环循环有利于提高资源利用率和实现绿色化学的目标。利用氨法浸取可实现废弃物铜包钢的有效分离,同时得到的 可用于催化、医药、冶金等重要领域。工艺流程如下:
可用于催化、医药、冶金等重要领域。工艺流程如下:
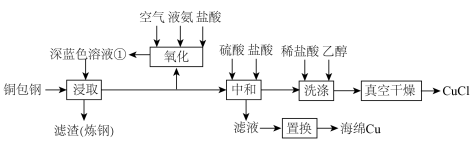
已知:室温下的 。
。
回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为_______ (填化学式)。
(2)滤渣的主要成分为_______ (填化学式)。
(3)浸取工序的产物为 ,该工序发生反应的化学方程式为
,该工序发生反应的化学方程式为_______ 。浸取后滤液的一半经氧化工序可得深蓝色溶液①,氧化工序发生反应的离子方程式为_______ 。
(4)浸取工序宜在 之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是
之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是_______ 。
(5)补全中和工序中主反应的离子方程式
_______ +_______ 。
(6)真空干燥的目的为_______ 。
 可用于催化、医药、冶金等重要领域。工艺流程如下:
可用于催化、医药、冶金等重要领域。工艺流程如下:
已知:室温下的
 。
。回答下列问题:
(1)首次浸取所用深蓝色溶液①由铜毛丝、足量液氨、空气和盐酸反应得到,其主要成分为
(2)滤渣的主要成分为
(3)浸取工序的产物为
 ,该工序发生反应的化学方程式为
,该工序发生反应的化学方程式为(4)浸取工序宜在
 之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是
之间进行,当环境温度较低时,浸取液再生后不需额外加热即可进行浸取的原因是(5)补全中和工序中主反应的离子方程式

(6)真空干燥的目的为
您最近半年使用:0次
2023-11-29更新
|
3110次组卷
|
4卷引用:2023年河北省高考化学试卷
(已下线)2023年河北省高考化学试卷2023年河北省高考化学试卷(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)北京市首都师范大学附属中学2023-2024学年高三下学期开学练习化学试题
真题
5 . 煤的化学活性是评价煤气化或燃烧性能的一项重要指标,可用与焦炭(由煤样制得)反应的 的转化率
的转化率 来表示。研究小组设计测定
来表示。研究小组设计测定 的实验装置如下:
的实验装置如下:
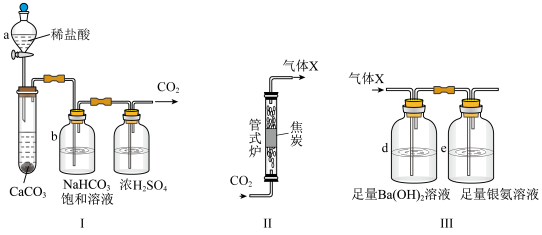
(1)装置Ⅰ中,仪器 的名称是
的名称是_______ ;b中除去的物质是_______ (填化学式)。
(2)①将煤样隔绝空气在 加热1小时得焦炭,该过程称为
加热1小时得焦炭,该过程称为_______ 。
②装置Ⅱ中,高温下发生反应的化学方程式为_______ 。
③装置Ⅲ中,先通入适量的气体X,再通入足量 气。若气体X被完全吸收,则可依据
气。若气体X被完全吸收,则可依据 和
和 中分别生成的固体质量计算
中分别生成的固体质量计算 。
。
i.d中的现象是_______ 。
ii.e中生成的固体为 ,反应的化学方程式为
,反应的化学方程式为_______ 。
iii.d和e的连接顺序颠倒后将造成
_______ (填“偏大”“偏小”或“不变”)。
iiii.在工业上按照国家标准测定 :将干燥后的
:将干燥后的 (含杂质
(含杂质 的体积分数为
的体积分数为 )以一定流量通入装置Ⅱ反应,用奥氏气体分析仪测出反应后某时段气体中
)以一定流量通入装置Ⅱ反应,用奥氏气体分析仪测出反应后某时段气体中 的体积分数为
的体积分数为 ,此时
,此时 的表达式为
的表达式为_______ 。
 的转化率
的转化率 来表示。研究小组设计测定
来表示。研究小组设计测定 的实验装置如下:
的实验装置如下:
(1)装置Ⅰ中,仪器
 的名称是
的名称是(2)①将煤样隔绝空气在
 加热1小时得焦炭,该过程称为
加热1小时得焦炭,该过程称为②装置Ⅱ中,高温下发生反应的化学方程式为
③装置Ⅲ中,先通入适量的气体X,再通入足量
 气。若气体X被完全吸收,则可依据
气。若气体X被完全吸收,则可依据 和
和 中分别生成的固体质量计算
中分别生成的固体质量计算 。
。i.d中的现象是
ii.e中生成的固体为
 ,反应的化学方程式为
,反应的化学方程式为iii.d和e的连接顺序颠倒后将造成

iiii.在工业上按照国家标准测定
 :将干燥后的
:将干燥后的 (含杂质
(含杂质 的体积分数为
的体积分数为 )以一定流量通入装置Ⅱ反应,用奥氏气体分析仪测出反应后某时段气体中
)以一定流量通入装置Ⅱ反应,用奥氏气体分析仪测出反应后某时段气体中 的体积分数为
的体积分数为 ,此时
,此时 的表达式为
的表达式为
您最近半年使用:0次
真题
解题方法
6 . 实验室模拟“镁法工业烟气脱硫”并制备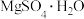 ,其实验过程可表示为
,其实验过程可表示为
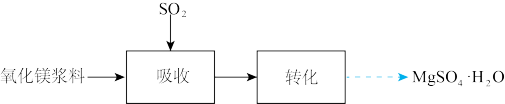
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 气体,生成
气体,生成 ,反应为
,反应为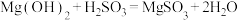 ,其平衡常数K与
,其平衡常数K与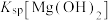 、
、 、
、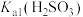 、
、 的代数关系式为
的代数关系式为
___________ ;下列实验操作一定能提高氧化镁浆料吸收 效率的有
效率的有___________ (填序号)。
A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入 气体的速率
气体的速率
D.通过多孔球泡向氧化镁浆料中通
(2)在催化剂作用下 被
被 氧化为
氧化为 。已知
。已知 的溶解度为0.57g(20℃),
的溶解度为0.57g(20℃), 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为___________ ;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 被
被 氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中
氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是___________ 。

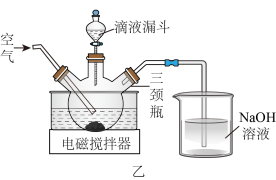
(3)制取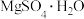 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的
晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与
浆料与 溶液充分反应。
溶液充分反应。 浆料与
浆料与 溶液的加料方式是
溶液的加料方式是___________ ;补充完整制取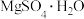 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中,___________ 。(已知: 、
、 在
在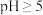 时完全转化为氢氧化物沉淀;室温下从
时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出
饱和溶液中结晶出 ,
, 在150~170℃下干燥得到
在150~170℃下干燥得到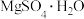 ,实验中需要使用MgO粉末)
,实验中需要使用MgO粉末)
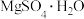 ,其实验过程可表示为
,其实验过程可表示为
(1)在搅拌下向氧化镁浆料中匀速缓慢通入
 气体,生成
气体,生成 ,反应为
,反应为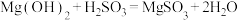 ,其平衡常数K与
,其平衡常数K与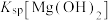 、
、 、
、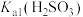 、
、 的代数关系式为
的代数关系式为
 效率的有
效率的有A.水浴加热氧化镁浆料
B.加快搅拌速率
C.降低通入
 气体的速率
气体的速率D.通过多孔球泡向氧化镁浆料中通

(2)在催化剂作用下
 被
被 氧化为
氧化为 。已知
。已知 的溶解度为0.57g(20℃),
的溶解度为0.57g(20℃), 氧化溶液中
氧化溶液中 的离子方程式为
的离子方程式为 被
被 氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中
氧化的速率随pH的变化如题图甲所示。在pH=6~8范围内,pH增大,浆料中 的氧化速率增大,其主要原因是
的氧化速率增大,其主要原因是
(3)制取
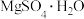 晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的
晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 浆料与
浆料与 溶液充分反应。
溶液充分反应。 浆料与
浆料与 溶液的加料方式是
溶液的加料方式是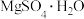 晶体的实验方案:向含有少量
晶体的实验方案:向含有少量 、
、 的
的 溶液中,
溶液中, 、
、 在
在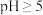 时完全转化为氢氧化物沉淀;室温下从
时完全转化为氢氧化物沉淀;室温下从 饱和溶液中结晶出
饱和溶液中结晶出 ,
, 在150~170℃下干燥得到
在150~170℃下干燥得到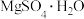 ,实验中需要使用MgO粉末)
,实验中需要使用MgO粉末)
您最近半年使用:0次
真题
解题方法
7 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(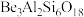 ,还含有一定量的FeO和
,还含有一定量的FeO和 )生产BeO的一种工艺流程如下。
)生产BeO的一种工艺流程如下。
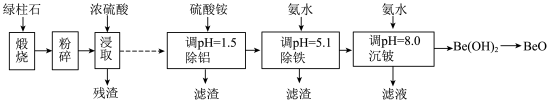
回答问题:
(1)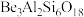 中Be的化合价为
中Be的化合价为_______ 。
(2)粉碎的目的是_______ ;残渣主要成分是_______ (填化学式)。
(3)该流程中能循环使用的物质是_______ (填化学式)。
(4)无水 可用作聚合反应的催化剂。BeO、
可用作聚合反应的催化剂。BeO、 与足量C在600~800℃制备
与足量C在600~800℃制备 的化学方程式为
的化学方程式为_______ 。
(5)沉铍时,将pH从8.0提高到8.5,则铍的损失降低至原来的_______ %。
 ,还含有一定量的FeO和
,还含有一定量的FeO和 )生产BeO的一种工艺流程如下。
)生产BeO的一种工艺流程如下。
回答问题:
(1)
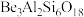 中Be的化合价为
中Be的化合价为(2)粉碎的目的是
(3)该流程中能循环使用的物质是
(4)无水
 可用作聚合反应的催化剂。BeO、
可用作聚合反应的催化剂。BeO、 与足量C在600~800℃制备
与足量C在600~800℃制备 的化学方程式为
的化学方程式为(5)沉铍时,将pH从8.0提高到8.5,则铍的损失降低至原来的
您最近半年使用:0次
8 . 工业上煅烧含硫矿物产生的 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
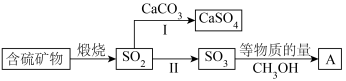
已知: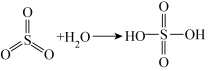
请回答:
(1)富氧煅烧燃煤产生的低浓度的 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式___________ 。
(2)煅烧含硫量高的矿物得到高浓度的 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。
①下列说法正确的是___________ 。
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的 也可用浓
也可用浓 吸收
吸收
②一定压强下,化合物A的沸点低于硫酸的原因是___________ 。
(3)设计实验验证化合物A中含有S元素_____ ;写出实验过程中涉及的反应方程式____ 。
 可以按如下流程脱除或利用。
可以按如下流程脱除或利用。
已知:
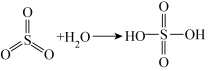
请回答:
(1)富氧煅烧燃煤产生的低浓度的
 可以在炉内添加
可以在炉内添加 通过途径Ⅰ脱除,写出反应方程式
通过途径Ⅰ脱除,写出反应方程式(2)煅烧含硫量高的矿物得到高浓度的
 ,通过途径Ⅱ最终转化为化合物A。
,通过途径Ⅱ最终转化为化合物A。①下列说法正确的是
A.燃煤中的有机硫主要呈正价 B.化合物A具有酸性
C.化合物A是一种无机酸酯 D.工业上途径Ⅱ产生的
 也可用浓
也可用浓 吸收
吸收②一定压强下,化合物A的沸点低于硫酸的原因是
(3)设计实验验证化合物A中含有S元素
您最近半年使用:0次
9 . 油画创作通常需要用到多种无机颜料。研究发现,在不同的空气湿度和光照条件下,颜料雌黄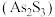 褪色的主要原因是发生了以下两种化学反应:
褪色的主要原因是发生了以下两种化学反应:
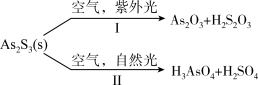
下列说法正确的是
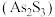 褪色的主要原因是发生了以下两种化学反应:
褪色的主要原因是发生了以下两种化学反应:
下列说法正确的是
A. 和 和 的空间结构都是正四面体形 的空间结构都是正四面体形 |
B.反应Ⅰ和Ⅱ中,元素 和S都被氧化 和S都被氧化 |
C.反应Ⅰ和Ⅱ中,参加反应的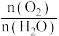 :Ⅰ<Ⅱ :Ⅰ<Ⅱ |
D.反应Ⅰ和Ⅱ中,氧化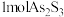 转移的电子数之比为3∶7 转移的电子数之比为3∶7 |
您最近半年使用:0次
2023-06-16更新
|
6485次组卷
|
20卷引用:2023年高考湖南卷化学真题
2023年高考湖南卷化学真题(已下线)专题06 物质结构与性质(已下线)专题09 氧化还原反应(已下线)第3讲 氧化还原反应(已下线)2023年湖南卷高考真题变式题(选择题6-10)浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)考点05 氧化还原反应方程式的配平与计算(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题04 氧化还原反应-2023年高考化学真题题源解密(全国通用)(已下线)专题05 氧化还原反应及其计算-2023年高考化学真题题源解密(新高考专用)河南省商丘市第一高级中学2022-2023学年高二下学期期末考试化学试题江西省吉安市双校联盟2022-2023学年高二下学期期中考试化学试题浙江省义乌五校2023-2024学年高三上学期10月联考化学试题北京大学附属中学预科部2023-2024学年高三上学期10月阶段练习化学试题浙江省三校2023-2024学年高三上学期联考选考模拟化学试题(已下线)题型04 氧化还原反应-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)江西省宜春市丰城市第九中学2023-2024学年高一上学期1月期末化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)河南省济源市高级中学2023-2024学年高三上学期9月高考模拟检测理科综合试题-高中化学山东省菏泽市郓城县第一中学(英华校区)2023-2024学年高三上学期10月阶段性考试化学试题
真题
解题方法
10 . 化合物X由三种元素组成,某学习小组按如下流程进行实验:
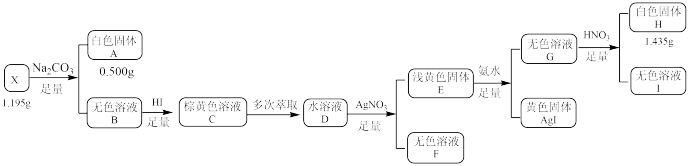
已知:白色固体A用 溶解后,多余的酸用
溶解后,多余的酸用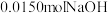 恰好中和,请回答:
恰好中和,请回答:
(1)X的组成元素是___________ ,X的化学式是___________ 。
(2)写出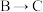 溶液呈棕黄色所发生的化学反应方程式
溶液呈棕黄色所发生的化学反应方程式___________ 。
(3)写出生成白色固体H的离子方程式___________ 。
(4)设计实验检验溶液Ⅰ中的阳离子___________ 。

已知:白色固体A用
 溶解后,多余的酸用
溶解后,多余的酸用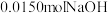 恰好中和,请回答:
恰好中和,请回答:(1)X的组成元素是
(2)写出
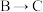 溶液呈棕黄色所发生的化学反应方程式
溶液呈棕黄色所发生的化学反应方程式(3)写出生成白色固体H的离子方程式
(4)设计实验检验溶液Ⅰ中的阳离子
您最近半年使用:0次



