名校
1 . 亚硫酸钠和硫代硫酸钠(Na2S2O3)都是重要的含硫化合物。某化学兴趣小组进行以下有关实验,填写下列空白。
实验Ⅰ:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有___________ (填标号)。
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是___________ 。
实验Ⅱ:制取硫代硫酸钠
利用如图所示装置进行实验___________ 。
(3)装置D的作用是___________ 。
(4)实验中,为使 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是___________ 。
实验Ⅲ:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品7.9g,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用0.1mol·L-1I2标准溶液滴定(发生反应:2S2O +I2=S4O
+I2=S4O +2I-),至滴定终点共消耗标准溶液23.60mL。
+2I-),至滴定终点共消耗标准溶液23.60mL。
(5)样品中Na2S2O3的百分含量为___________ (保留三位有效数字)。
实验Ⅰ:证明Na2SO3中硫元素的价态能发生+4→+6转化
(1)实验中,不需要用到的试剂有
a.稀硫酸 b.H2O2溶液 c.稀盐酸 d.淀粉碘化钾溶液 e.BaCl2溶液
观察到的现象是
实验Ⅱ:制取硫代硫酸钠
利用如图所示装置进行实验
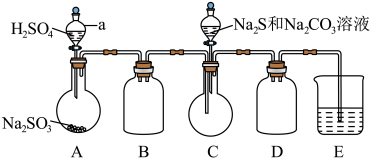
(3)装置D的作用是
(4)实验中,为使
 缓慢通入烧瓶C,采取的操作是
缓慢通入烧瓶C,采取的操作是实验Ⅲ:测定某硫代硫酸钠样品的纯度(设样品中只含Na2SO3杂质)
设计如下方案,并进行实验:
①准确称取该硫代硫酸钠样品7.9g,配制成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加入适量甲醛(防止Na2SO3与I2反应)和少量淀粉溶液,用0.1mol·L-1I2标准溶液滴定(发生反应:2S2O
 +I2=S4O
+I2=S4O +2I-),至滴定终点共消耗标准溶液23.60mL。
+2I-),至滴定终点共消耗标准溶液23.60mL。(5)样品中Na2S2O3的百分含量为
您最近半年使用:0次
2 . 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺流程如下:
(1)K2FeO4中铁元素在周期表中的位置第___________ 周期第___________ 列。
(2)在溶液I中加入KOH固体的目的是___________(填字母)。
(3)“纯化”时需加入饱和的KOH溶液,其作用是___________ 。
(4)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为___________ 。每制得59.4 g K2FeO4,理论上消耗氧化剂的物质的量为___________ mol。
(5)工业上用异丙醇对湿产品进行洗涤,目的是___________ 。
(6)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,写出该反应的离子方程式:___________ 。
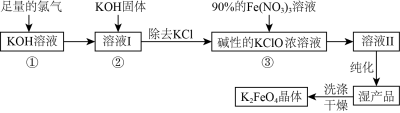
(1)K2FeO4中铁元素在周期表中的位置第
(2)在溶液I中加入KOH固体的目的是___________(填字母)。
| A.为下一步反应提供碱性的环境 |
| B.使KClO3转化为KClO |
| C.与溶液I中过量的Cl2继续反应,生成更多的KClO |
| D.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
(3)“纯化”时需加入饱和的KOH溶液,其作用是
(4)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为
(5)工业上用异丙醇对湿产品进行洗涤,目的是
(6)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,写出该反应的离子方程式:
您最近半年使用:0次
名校
解题方法
3 . 酸性条件下,FeS2催化氧化反应的化学方程式为2FeS2+7O2+2H2O=2Fe2++4SO +4H+该反应的物质间转化如图所示。下列分析正确的是
+4H+该反应的物质间转化如图所示。下列分析正确的是
 +4H+该反应的物质间转化如图所示。下列分析正确的是
+4H+该反应的物质间转化如图所示。下列分析正确的是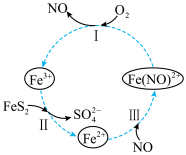
| A.黄铁矿催化氧化反应中NO是中间产物 |
| B.Fe3+是总反应的催化剂 |
| C.反应III是氧化还原反应 |
| D.反应I的离子方程式为4Fe(NO)2++O2+4H+=4Fe3++4NO+2H2O |
您最近半年使用:0次
名校
解题方法
4 . 下列反应的离子方程式书写错误的是:
| A.用硫氰化钾溶液检验Fe3+:Fe3++3SCN-= Fe(SCN)3 |
| B.向海带灰浸出液中加入稀硫酸、双氧水:2I- + 2H+ + H2O2= I2 + 2H2O |
| C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH-= Na2SiO3+H2O |
D.NaHCO3溶液和少量Ba(OH)2溶液混合:2HCO +2OH-+Ba2+=H2O+BaCO3↓+CO +2OH-+Ba2+=H2O+BaCO3↓+CO |
您最近半年使用:0次
名校
解题方法
5 . 根据要求完成下列方程式。
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3] 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。
①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式___________ 。
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式___________ 。
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式___________ 。
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式___________ 。
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式___________ 。(提示:反应中价态不变)
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式___________ 。(已知:氯气遇到黄血盐可以得到赤血盐)
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3]
 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式
您最近半年使用:0次
名校
6 . 无机化合物可根据其组成和性质进行分类,分类比较是研究物质性质常用的一类方法。
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要分离提取 出砷元素,有同学建议用NaOH溶液,理由是_______ 。
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①_______ ;②2AsH3=2As+3H2
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①
您最近半年使用:0次
解题方法
7 .  是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:

(1) 的名称是
的名称是___________ ,若A是一种纯净物,则A的化学式为___________ 。
(2)“还原1”中应充分搅拌,好处是___________ ,反应中消耗的氧化剂与还原剂物质的量之比为___________ ,“还原2”反应的离子方程式为___________ 。
 是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
是化学工业中广泛使用的一种高效的漂白剂和氧化剂,工业上生产它的一种流程如图所示:
(1)
 的名称是
的名称是(2)“还原1”中应充分搅拌,好处是
您最近半年使用:0次
解题方法
8 . 下列有关离子方程式的书写正确的是
A.Na2S2O3溶液与稀硫酸的反应: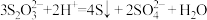 |
B.用纯铜电板电解CuCl2溶液:Cu2++2Cl- Cu+Cl2↑ Cu+Cl2↑ |
C.NH4Al(SO4)2溶液与足量的Ba(OH)2溶液反应: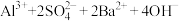 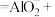 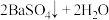 |
D.用Na2CO3溶液吸收少量Cl2: |
您最近半年使用:0次
解题方法
9 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近半年使用:0次
10 . 钯( )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量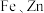 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
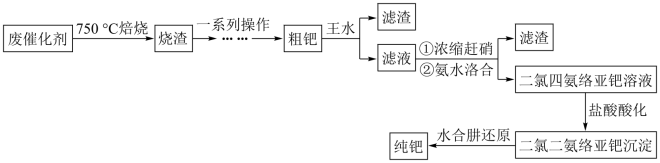
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是_______ 。
(2)“一系列操作”包括向烧渣中加入 ,目的是将
,目的是将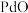 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:___________ 。
(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸( )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
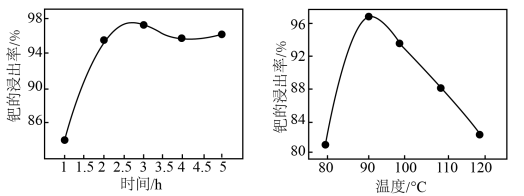
的物质的量之比为_______ 。钯的浸出率与反应的时间、温度的关系如图所示,则最佳的浸取时间和温度为_______ 。
(4)“氨水络合”时需要控制好溶液的 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为______ (保留三位有效数字)。( )
)
(5)海绵状金属钯密度为 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
______ 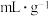 ,氢气的浓度
,氢气的浓度
______ (保留小数点后两位)。(吸附容量 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为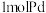 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
 )是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量
)是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。为节约和充分利用资源,以废钯催化剂(主要成分是钯、碳、有机物及少量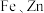 等元素)为原料通过如下工艺流程回收钯。
等元素)为原料通过如下工艺流程回收钯。
回答下列问题:
(1)“焙烧”时通入的空气一定要足量,目的是
(2)“一系列操作”包括向烧渣中加入
 ,目的是将
,目的是将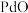 还原得到粗钯,写出反应的化学方程式:
还原得到粗钯,写出反应的化学方程式:(3)得到粗钯后,用王水在一定温度下充分浸取钯,得到氯亚钯酸(
 )和一种有毒的无色气体
)和一种有毒的无色气体 ,该气体遇空气变为红棕色,该反应中消耗的
,该气体遇空气变为红棕色,该反应中消耗的 与
与 的物质的量之比为
的物质的量之比为
(4)“氨水络合”时需要控制好溶液的
 ,已知常温下,
,已知常温下, ,
, ,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于
,要使得溶液中的杂质金属离子沉淀完全(即金属离子浓度低于 ),
), 至少调节为
至少调节为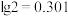 )
)(5)海绵状金属钯密度为
 ,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
,具有优良的吸氢功能,标准状况下,其吸附的氢气是其体积的840倍,则此条件下海绵钯的吸附容量
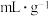 ,氢气的浓度
,氢气的浓度
 即
即 钯吸附氢气的体积;氢气的浓度
钯吸附氢气的体积;氢气的浓度 为
为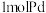 吸附标准状况下氢气的物质的量)
吸附标准状况下氢气的物质的量)
您最近半年使用:0次



