解题方法
1 . 在中国古代,硫酸被炼丹术士称为“绿矾油”。这是因为生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧后,釜中逸出刺激性气味的气体,同时有油状液体流出,残留固体呈红棕色。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①___________ ;
②___________ 。
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①
②
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。
A.若将反应后的气体通入 溶液中,产生的沉淀为 溶液中,产生的沉淀为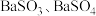 |
B.b中产物用紫色石蕊试液即可检验出其中 和 和 |
C.为检验反应的气态生成物是 ,试管c中应加入的试剂为NaOH溶液 ,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
您最近半年使用:0次
2 . 近来中国隐形战机歼-20换装试飞成功,大大壮我军威。这得益于师昌绪等科学家开发的由新型无机非金属材料制成的新型发动机,热效率高、寿命长。这类材料中研究较多的是化合物G。化合物G的相对分子质量为140,含有硅元素,其质量分数为40%,另含有元素Y。化合物E(含两种元素)与 反应制得G和HCl。
反应制得G和HCl。
(1)G化学式为___________ 。
(2)写出E与 反应的化学方程式:
反应的化学方程式:___________ 。
(3)粉末状G能够与氧气在高温下反应,所得产物中有一种是空气的主要成分,另一种是氧化物,该过程的化学方程式为___________ 。
 反应制得G和HCl。
反应制得G和HCl。(1)G化学式为
(2)写出E与
 反应的化学方程式:
反应的化学方程式:(3)粉末状G能够与氧气在高温下反应,所得产物中有一种是空气的主要成分,另一种是氧化物,该过程的化学方程式为
您最近半年使用:0次
3 . 按要求完成下列化学方程式:
(1)铁丝在氧气中燃烧的产物能溶于稀盐酸,试写出反应的化学方程式___________ 。
(2)“神舟五号”火箭的动力来源是联氨 和四氧化二氮的反应,反应生成无公害物质,试写出反应的化学方程式
和四氧化二氮的反应,反应生成无公害物质,试写出反应的化学方程式___________ 。
(3)已知 和
和 都是易分解的二元弱酸,且
都是易分解的二元弱酸,且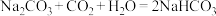 。试写出将过量
。试写出将过量 通入到少量NaOH溶液中反应的化学方程式
通入到少量NaOH溶液中反应的化学方程式___________ 。
(4)已知硫和氧的性质相似,对应化合物的性质也相似,且 (硫代碳酸钠),试写出
(硫代碳酸钠),试写出 和
和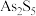 反应的化学方程式
反应的化学方程式___________ 。
(1)铁丝在氧气中燃烧的产物能溶于稀盐酸,试写出反应的化学方程式
(2)“神舟五号”火箭的动力来源是联氨
 和四氧化二氮的反应,反应生成无公害物质,试写出反应的化学方程式
和四氧化二氮的反应,反应生成无公害物质,试写出反应的化学方程式(3)已知
 和
和 都是易分解的二元弱酸,且
都是易分解的二元弱酸,且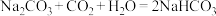 。试写出将过量
。试写出将过量 通入到少量NaOH溶液中反应的化学方程式
通入到少量NaOH溶液中反应的化学方程式(4)已知硫和氧的性质相似,对应化合物的性质也相似,且
 (硫代碳酸钠),试写出
(硫代碳酸钠),试写出 和
和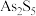 反应的化学方程式
反应的化学方程式
您最近半年使用:0次
4 . 回答下列问题。
(1)向含有NaOH和 的混合溶液中缓缓通入
的混合溶液中缓缓通入 直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
①___________ ;
②___________ ;
③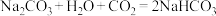 ;
;
④___________ 。
(2)高氯酸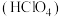 是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
①高氯酸氯的化学式为___________ ,物质类别可归为___________ 。
②高氯酸氯在室温下即发生分解,形成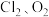 和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:
和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:___________ 。
(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(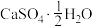 ,一种白色粉末)和生石膏(
,一种白色粉末)和生石膏( ,一种坚硬的固体)两种,固定骨折的石膏是
,一种坚硬的固体)两种,固定骨折的石膏是___________ (填化学式)。固定时发生反应的化学方程式为___________ 。
(4)CO与 溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为___________ ,反应中可能看到的现象是___________ 。
(1)向含有NaOH和
 的混合溶液中缓缓通入
的混合溶液中缓缓通入 直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:
直到过量。其现象为开始出现沉淀,后来沉淀逐渐溶解。请按照先后顺序写出相应反应的化学方程式:①
②
③
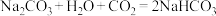 ;
;④
(2)高氯酸
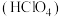 是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。
是最强酸。现有一种不常见的氯的化合物叫作高氯酸氯,其分子中氯的质量分数为0.526,且每个分子中含有4个氧原子。①高氯酸氯的化学式为
②高氯酸氯在室温下即发生分解,形成
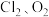 和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:
和另一种氯的氧化物。已知该反应的化学方程式中3种产物的化学计量数相同。请写出该分解反应的化学方程式:(3)医药上可用石膏来固定骨折部位。石膏有熟石膏(
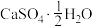 ,一种白色粉末)和生石膏(
,一种白色粉末)和生石膏( ,一种坚硬的固体)两种,固定骨折的石膏是
,一种坚硬的固体)两种,固定骨折的石膏是(4)CO与
 溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
溶液反应产生黑色金属钯粉末(反应中有水参加),用此来检测CO对环境的污染情况,此反应的化学方程式为
您最近半年使用:0次
名校
解题方法
5 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

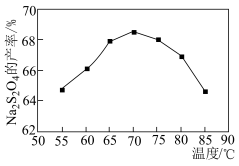
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
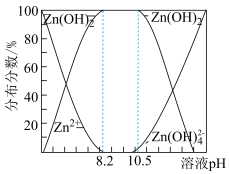
②二价锌在水溶液中的存在形式与pH的关系如图所示。
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近半年使用:0次
2024-02-22更新
|
284次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
名校
6 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+),实现镍、钴、镁元素的回收。
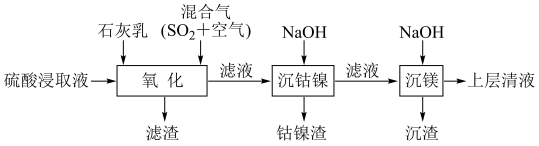
回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为___________ 。(答出一条即可)
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ 。(H2SO5的电离第一步完全,第二步微弱)
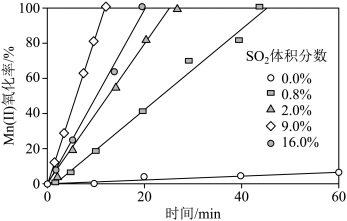
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。
(5)将“钴镍渣”酸溶后,进行如下流程:
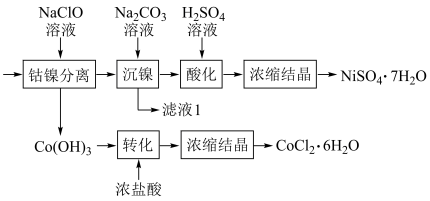
①写出“钴镍分离”时发生反应的离子方程式:___________ 。
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率=___________ (要求写出计算过程)。[已知:Ksp(NiCO3)=1.0×10-7,沉镍率= ]
]

回答下列问题:
(1)在一定温度下,用硫酸浸取已粉碎的镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),写出H2SO5的结构式:
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如图。SO2体积分数为9%时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是

(5)将“钴镍渣”酸溶后,进行如下流程:

①写出“钴镍分离”时发生反应的离子方程式:
②“镍钴分离”后溶液中c(Ni2+)=1.0mol·L-1,若“滤液1”中c(CO
 )=10-5mol·L-1,则沉镍率=
)=10-5mol·L-1,则沉镍率= ]
]
您最近半年使用:0次
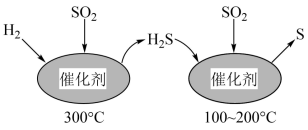
7 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
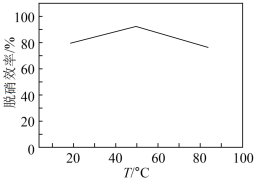
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成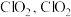 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度 | 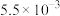 |  |  |  |  |
 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近半年使用:0次
8 . “2060年实现碳中和”的目标提出之后, 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。

(1)HCOOH是有机物,分子中所含官能团的名称为___________ 。
(2)将 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要___________ 能量(填“吸收”或“放出”)。
(3)一定条件下, 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为___________ 。
 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。
(1)HCOOH是有机物,分子中所含官能团的名称为
(2)将
 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要(3)一定条件下,
 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
您最近半年使用:0次
2024-01-12更新
|
186次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
9 . 某化学兴趣小组欲利用下列试剂:铁粉、锌粉、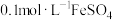 溶液、KSCN溶液、新制氯水,探究
溶液、KSCN溶液、新制氯水,探究 的还原性,请回答下列问题:
的还原性,请回答下列问题:
(1)用所给试剂写出体现 具有还原性的离子反应方程式:
具有还原性的离子反应方程式:_______ ,由此得出,在配制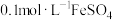 溶液时,
溶液时, 容易被氧化,欲检验
容易被氧化,欲检验 溶液是否变质,应加入的试剂是
溶液是否变质,应加入的试剂是_______ ;
(2)该小组同学用 溶液和NaOH溶液混合制备
溶液和NaOH溶液混合制备 ,观察到沉淀最终变成红褐色,原因是
,观察到沉淀最终变成红褐色,原因是_______ (用化学方程式解释);
(3)酸性条件下,某反应中反应物与生成物有 、
、 、
、 、
、 、
、 和一种未知离子X。
和一种未知离子X。
已知:反应中1mol 得5mol电子。
得5mol电子。
① 中Mn元素的化合价为
中Mn元素的化合价为_______ ,X离子是_______ 。
②该反应的离子方程式是_______ 。
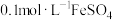 溶液、KSCN溶液、新制氯水,探究
溶液、KSCN溶液、新制氯水,探究 的还原性,请回答下列问题:
的还原性,请回答下列问题:(1)用所给试剂写出体现
 具有还原性的离子反应方程式:
具有还原性的离子反应方程式: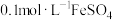 溶液时,
溶液时, 容易被氧化,欲检验
容易被氧化,欲检验 溶液是否变质,应加入的试剂是
溶液是否变质,应加入的试剂是(2)该小组同学用
 溶液和NaOH溶液混合制备
溶液和NaOH溶液混合制备 ,观察到沉淀最终变成红褐色,原因是
,观察到沉淀最终变成红褐色,原因是(3)酸性条件下,某反应中反应物与生成物有
 、
、 、
、 、
、 、
、 和一种未知离子X。
和一种未知离子X。已知:反应中1mol
 得5mol电子。
得5mol电子。①
 中Mn元素的化合价为
中Mn元素的化合价为②该反应的离子方程式是
您最近半年使用:0次
名校
解题方法
10 . 制取漂白液时温度过高会发生副反应: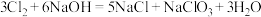 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为
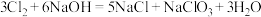 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为A. | B. | C.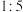 | D.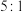 |
您最近半年使用:0次
2023-06-26更新
|
400次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学2022-2023学年高一下学期学业水平强化模拟考试化学试题



