名校
1 . 硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层。以高铝铬铁矿[主要成分为Cr2O3(质量分数为a%)和Al2O3,还含有Fe2O3、FeO、MgO、SiO2等]为原料制备硼化铬和铝的工艺流程如图所示。
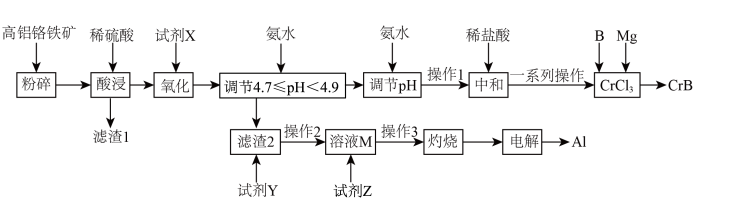
请回答下列问题:
(1)“氧化”的目的是将溶液中的Fe2+转化为 ,试剂X可选用H2O2或Cl2,写出X为H2O2时的离子方程式:
,试剂X可选用H2O2或Cl2,写出X为H2O2时的离子方程式:___________ 。
(2)试剂Y是___________ ,操作1的名称是___________ 。
(3)向溶液M中通入过量CO2,发生反应的离子方程式为___________ 。
(4)第2次加氨水“调节pH”的范围是___________ ;加稀盐酸“中和”前,需要洗涤沉淀,证明沉淀洗涤干净的操作方法是___________ 。
(5)硼化铬是由金属镁、硼、氯化铬在650℃时反应制得的,写出该反应的化学方程式:___________ 。
(6)取1kg高铝铬铁矿【主要成分为Cr2O3(质量分数为a%)】,在上述工艺流程中Cr总转化率为b%,得到mkgCrB,则CrB产率为:___________ 。

| 金属离子 | Fe3+ | Mg2+ | Cr3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 2.3 | 10.4 | 4.9 | 7.5 | 3.4 |
| 沉淀完全的pH | 4.1 | 12.4 | 6.8 | 9.7 | 4.7 |
(1)“氧化”的目的是将溶液中的Fe2+转化为
 ,试剂X可选用H2O2或Cl2,写出X为H2O2时的离子方程式:
,试剂X可选用H2O2或Cl2,写出X为H2O2时的离子方程式:(2)试剂Y是
(3)向溶液M中通入过量CO2,发生反应的离子方程式为
(4)第2次加氨水“调节pH”的范围是
(5)硼化铬是由金属镁、硼、氯化铬在650℃时反应制得的,写出该反应的化学方程式:
(6)取1kg高铝铬铁矿【主要成分为Cr2O3(质量分数为a%)】,在上述工艺流程中Cr总转化率为b%,得到mkgCrB,则CrB产率为:
您最近一年使用:0次
解题方法
2 . 由软锰矿(主要成分为MnO2,含有少量CaO、MgO)制备MnO2的工艺流程如下:
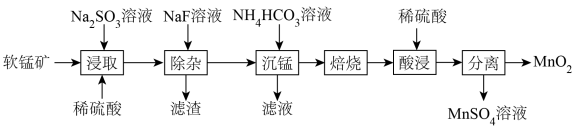
已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为_______ 。
(2)加快“浸取”速率可采取的措施为_______ (答出一种方法即可);“滤渣”的主要成分为_______ 。
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为_______ 。
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:_______ 。
(5)① 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为_______ 、_______ 。
②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是_______ 。
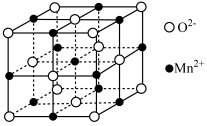
③MnO晶胞结构如图所示,平均每个晶胞中 组成的正四面体空隙有
组成的正四面体空隙有_______ 个,2个 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=_______ g·cm-3。

已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为
(2)加快“浸取”速率可采取的措施为
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:
(5)①
 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是
③MnO晶胞结构如图所示,平均每个晶胞中
 组成的正四面体空隙有
组成的正四面体空隙有 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=
您最近一年使用:0次
2023-12-08更新
|
293次组卷
|
2卷引用:广东省佛山市2023-2024学年高三上学期12月月考化学试题
名校
解题方法
3 . 几种常见其化合物:Na、 、
、 、
、 、NaOH、
、NaOH、 。回答下列问题:
。回答下列问题:
(1)属于钠盐是___________ 。
(2)写出 的一种用途:
的一种用途:___________ 。
(3)向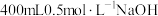 溶液中通入
溶液中通入 3.36L(标准状况),发生反应的离子方程式为
3.36L(标准状况),发生反应的离子方程式为___________ 。
(4)在密闭容器中,将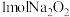 和
和 固体混合物加热至250℃,充分反应后,残留固体为
固体混合物加热至250℃,充分反应后,残留固体为___________ 。
(5)铁酸盐(钠、钾)为六价铁盐,是一种新型消毒剂。干法制备 的主要反应化学方程式为
的主要反应化学方程式为 ___________
___________ ___________
___________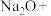 ___________
___________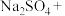 ___________,完成并配平该方程式
___________,完成并配平该方程式_______ 。
 、
、 、
、 、NaOH、
、NaOH、 。回答下列问题:
。回答下列问题:(1)属于钠盐是
(2)写出
 的一种用途:
的一种用途:(3)向
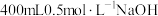 溶液中通入
溶液中通入 3.36L(标准状况),发生反应的离子方程式为
3.36L(标准状况),发生反应的离子方程式为(4)在密闭容器中,将
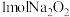 和
和 固体混合物加热至250℃,充分反应后,残留固体为
固体混合物加热至250℃,充分反应后,残留固体为(5)铁酸盐(钠、钾)为六价铁盐,是一种新型消毒剂。干法制备
 的主要反应化学方程式为
的主要反应化学方程式为 ___________
___________ ___________
___________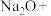 ___________
___________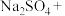 ___________,完成并配平该方程式
___________,完成并配平该方程式
您最近一年使用:0次
名校
解题方法
4 . 硫酸锰(MnSO4•H2O)是一种粉色晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料之一,工业上由天然二氧化锰与硫化锰矿(还含Fe、Al、Mg、Si等元素的氧化物)制备硫酸锰的工艺如图所示。回答下列问题:
②相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
(1)“溶浸”前需将矿石研成粉末,其目的是_______ 。“滤渣1”中含有S和_______ ;“溶浸”时两种含锰化合物与H2SO4反应的化学方程式为_______ 。
(2)“氧化”时添加适量的MnO2的作用是_______ (用离子方程式表示),若省略“氧化”步骤,造成的后果是_______ 。
(3)加入MnF2的目的是_______ 。
(4)滤液经过_______ (写操作A的名称),可得到粉红色MnSO4•H2O晶体。
(5)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。_______ 。
②如图晶体的化学式为_______ ;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为_______ g•cm-3(用NA表示阿伏加德罗常数,列式即可)。
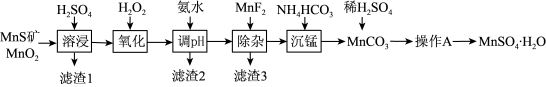
②相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“溶浸”前需将矿石研成粉末,其目的是
(2)“氧化”时添加适量的MnO2的作用是
(3)加入MnF2的目的是
(4)滤液经过
(5)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
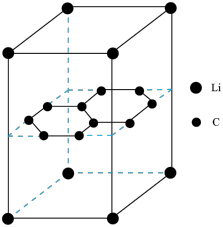
②如图晶体的化学式为
您最近一年使用:0次
名校
解题方法
5 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(Ni2+、Co2+、Fe2+、Fe3+、Mg2+和Mn2+)。实现镍、钴、镁元素的回收。

已知:
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 mol H2SO5中过氧键的数目为___________ 。
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为___________ (H2SO5的电离第一步完全,第二步微弱);滤渣的成分为MnO2、CaSO4和___________ (填化学式)。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为___________ 时,Mn(Ⅱ)氧化速率最大;继续增大SO2体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。

(5)25℃时,“沉镁”中为使Mg2+沉淀完全(Mg2+浓度小于10-5mol/L),需控制pH不低于___________ (精确至0.1)。

已知:
| 物质 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 | Mg(OH)2 |
| Ksp | 10-37.4 | 10-14.7 | 10-14.7 | 10-10.8 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸(H2SO5),1 mol H2SO5中过氧键的数目为
(3)“氧化”中,用石灰乳调节pH=4,Mn2+被H2SO5氧化为MnO2,该反应的离子方程式为
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下。SO2体积分数为

(5)25℃时,“沉镁”中为使Mg2+沉淀完全(Mg2+浓度小于10-5mol/L),需控制pH不低于
您最近一年使用:0次
6 . 少量 与
与 溶液能发生如下反应:
溶液能发生如下反应: (方程式未配平),设
(方程式未配平),设 为阿伏加德罗常数的值,下列说法错误的是
为阿伏加德罗常数的值,下列说法错误的是
A.1L 1  溶液含 溶液含 的数目为2 的数目为2 | B.1mol  可制得 可制得 的胶粒数为 的胶粒数为 |
C.78g  含有共价键的数目为 含有共价键的数目为 | D.每生成1mol X,转移的电子数为 |
您最近一年使用:0次
2023-12-01更新
|
169次组卷
|
6卷引用:广东省江门市2024届高三上学期9月金太阳联考化学试题
名校
7 . 回答下列问题:
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:_______ 。
(2)在一定条件下, 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被_______ (填“氧化”或“还原”), 中R的化合价是
中R的化合价是_______ 价。
(3)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。
①该反应中的氧化剂是_______ (填化学式,下同)
②该反应中,发生还原反应的过程是:_______ →_______ 。
(4) ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目_______ 。
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和
 反应的化学方程式:
反应的化学方程式:(2)在一定条件下,
 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被 中R的化合价是
中R的化合价是(3)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。①该反应中的氧化剂是
②该反应中,发生还原反应的过程是:
(4)
 ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目
您最近一年使用:0次
名校
8 . I.高铁酸钠 是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为 (胶体)
(胶体)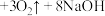 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
(1)高铁酸钠 属于
属于___________ (“酸”、“碱”、“盐”或“氧化物”,其中铁的化合价为___________ 价。
(2)将上述反应的化学方程式改写成离子方程式:___________ 。
(3)工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为: 。用
。用单线桥 标出上述方程式的电子转移方向和数目___________ 。
(4)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是___________ 。
②某同学按要求制备了 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。
现象1:先出现沉淀,原因是___________ 。
现象2:随后沉淀溶解,此反应的离子方程式是___________ 。
II、亚硝酸钠 像食盐一样有咸味,但有很强的毒性,误食
像食盐一样有咸味,但有很强的毒性,误食 会使人中每。已知亚硝酸钠能发生如下反应:
会使人中每。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。
(5) 表现的性质是___________(填字母)
表现的性质是___________(填字母)
(6)利用氧化还原反应化合价升降总数相等配平该方程式:___________ 。
 是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为
是水处理过程中的一种新型的绿色多功能净水剂。,其净水过程中所发生的化学反应主要为 (胶体)
(胶体)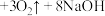 。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:
。相比传统的用氯气进行水的消毒处理,高铁酸钠安全无异味,投加更方便。请回答下列问题:(1)高铁酸钠
 属于
属于(2)将上述反应的化学方程式改写成离子方程式:
(3)工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:
 。用
。用(4)①实验室制得的氢氧化铁胶体中,氢氧化铁胶体粒子直径大小的范围是
②某同学按要求制备了
 胶体,但是他又向
胶体,但是他又向 胶体中逐滴加入了稀
胶体中逐滴加入了稀 溶液,结果出现了一系列变化。
溶液,结果出现了一系列变化。现象1:先出现沉淀,原因是
现象2:随后沉淀溶解,此反应的离子方程式是
II、亚硝酸钠
 像食盐一样有咸味,但有很强的毒性,误食
像食盐一样有咸味,但有很强的毒性,误食 会使人中每。已知亚硝酸钠能发生如下反应:
会使人中每。已知亚硝酸钠能发生如下反应: (未配平)。
(未配平)。(5)
 表现的性质是___________(填字母)
表现的性质是___________(填字母)| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
您最近一年使用:0次
名校
解题方法
9 . 过氧化钠常作漂白剂、消毒剂。过氧化钠经常因为保存不当容易吸收空气中 而变质。某课外小组欲用以下装置探究过氧化钠与
而变质。某课外小组欲用以下装置探究过氧化钠与 反应后的产物。试回答下列问题:
反应后的产物。试回答下列问题:

(1)写出A中反应的化学方程式___________ 。
(2)B装置的作用是___________ 。
(3)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转变为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式,并用双线桥标出电子转移的方向和数目:___________
(4)该课外小组欲探究某过组化钠样品是否已经变质,取少量样品,溶解,加入___________ 溶液,充分振荡后有白色沉淀,证明 已经变质。
已经变质。
(5)超氧化钾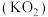 与过氧化钠一样能吸收
与过氧化钠一样能吸收 生成碳酸盐及
生成碳酸盐及 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
 而变质。某课外小组欲用以下装置探究过氧化钠与
而变质。某课外小组欲用以下装置探究过氧化钠与 反应后的产物。试回答下列问题:
反应后的产物。试回答下列问题:
(1)写出A中反应的化学方程式
(2)B装置的作用是
(3)观察到的实验现象:双球干燥管内淡黄色粉末逐渐转变为白色,点燃的蚊香燃烧更加剧烈。请根据实验现象写出C装置的化学方程式,并用双线桥标出电子转移的方向和数目:
(4)该课外小组欲探究某过组化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(5)超氧化钾
 与过氧化钠一样能吸收
与过氧化钠一样能吸收 生成碳酸盐及
生成碳酸盐及 ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近一年使用:0次
名校
10 . Ⅰ.氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)“服用维生素C,可以使食物中的 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有___________ (填“氧化”或“还原”)性。
(2)二氧化氯是一种高效消毒剂。工业制备 的反应为:
的反应为: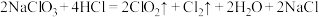 。
。
①氧化性:
___________ (填“>”或“<”) 。
。
② 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中可将
除去,下列试剂中可将 转化为
转化为 的是
的是___________ (填字母)。
a. b.
b. c.KI d.
c.KI d.
③先将下述反应配平,再用单线桥标出该反应中电子转移的方向和数目_______________ 。

Ⅱ.实验室可用 和浓盐酸反应制取氯气,反应原理如下:
和浓盐酸反应制取氯气,反应原理如下:
(3)用双线桥标出电子得失情况_______________ 。
(4)若参加反应的HCl是73g,则被氧化的HCl有___________ g(保留一位小数点)。
(5)某同学设计如下实验研究 的性质:
的性质:
能证明 具有还原性的实验是
具有还原性的实验是___________ (填序号)。可作为证据的实验现象是___________ (填字母序号)。
(1)“服用维生素C,可以使食物中的
 转化为
转化为 ”,说明维生素C具有
”,说明维生素C具有(2)二氧化氯是一种高效消毒剂。工业制备
 的反应为:
的反应为: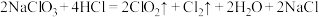 。
。①氧化性:

 。
。②
 在杀菌消毒过程中会产生副产物亚氯酸盐(
在杀菌消毒过程中会产生副产物亚氯酸盐( ),需将其转化为
),需将其转化为 除去,下列试剂中可将
除去,下列试剂中可将 转化为
转化为 的是
的是a.
 b.
b. c.KI d.
c.KI d.
③先将下述反应配平,再用单线桥标出该反应中电子转移的方向和数目

Ⅱ.实验室可用
 和浓盐酸反应制取氯气,反应原理如下:
和浓盐酸反应制取氯气,反应原理如下:
(3)用双线桥标出电子得失情况
(4)若参加反应的HCl是73g,则被氧化的HCl有
(5)某同学设计如下实验研究
 的性质:
的性质:| 序号 | 实验 | 实验现象 |
| ⅰ | 向5% 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| ⅱ | 向5% 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 具有还原性的实验是
具有还原性的实验是
您最近一年使用:0次



