解题方法
1 . 金属铼广泛用于航空航天等领域。工业上用富铼渣(铼元素主要以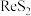 形式存在,砷主要以
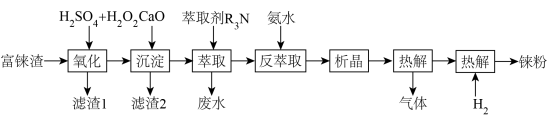
形式存在,砷主要以 形式存在)制取铼粉。工艺流程如下:
形式存在)制取铼粉。工艺流程如下:
已知:常温下 ;
; 为第四周期第VA族元素;高铼酸铵微溶于冷水,易溶于热水。
为第四周期第VA族元素;高铼酸铵微溶于冷水,易溶于热水。
回答下列问题:
(1) 的简化电子排布式为
的简化电子排布式为___________ 。
(2)“氧化”时铼转化为强酸高铼酸 。“滤渣1”的主要成分是硫单质。写出“氧化”时
。“滤渣1”的主要成分是硫单质。写出“氧化”时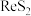 发生反应的离子方程式:
发生反应的离子方程式:___________ 。
(3)综合考虑,富铼渣“氧化”中浸出温度选择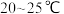 为宜,原因是
为宜,原因是___________ 。
(4)常温下,“反萃取”得到高铼酸铵溶液的 ,则溶液中
,则溶液中
___________ 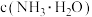 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
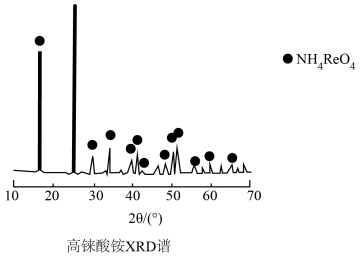
(5)“析晶”得到的主要产品是 。提纯粗高铼酸铵固体的方法是
。提纯粗高铼酸铵固体的方法是___________ 。下图是 的X射线衍射图谱,则
的X射线衍射图谱,则 属于
属于___________ (填“晶体”或“非晶体”)。
(6)“热解”产生可再生循环利用的物质是___________ 。
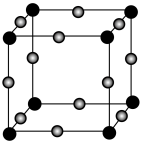
(7)已知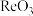 的立方晶胞如图,则
的立方晶胞如图,则 在晶胞中的位置为
在晶胞中的位置为___________ ;晶体中一个 周围与其最近的O的个数为
周围与其最近的O的个数为___________ 。
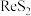 形式存在,砷主要以
形式存在,砷主要以 形式存在)制取铼粉。工艺流程如下:
形式存在)制取铼粉。工艺流程如下:
已知:常温下
 ;
; 为第四周期第VA族元素;高铼酸铵微溶于冷水,易溶于热水。
为第四周期第VA族元素;高铼酸铵微溶于冷水,易溶于热水。回答下列问题:
(1)
 的简化电子排布式为
的简化电子排布式为(2)“氧化”时铼转化为强酸高铼酸
 。“滤渣1”的主要成分是硫单质。写出“氧化”时
。“滤渣1”的主要成分是硫单质。写出“氧化”时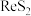 发生反应的离子方程式:
发生反应的离子方程式:(3)综合考虑,富铼渣“氧化”中浸出温度选择
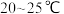 为宜,原因是
为宜,原因是(4)常温下,“反萃取”得到高铼酸铵溶液的
 ,则溶液中
,则溶液中
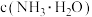 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(5)“析晶”得到的主要产品是
 。提纯粗高铼酸铵固体的方法是
。提纯粗高铼酸铵固体的方法是 的X射线衍射图谱,则
的X射线衍射图谱,则 属于
属于
(6)“热解”产生可再生循环利用的物质是
(7)已知
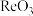 的立方晶胞如图,则
的立方晶胞如图,则 在晶胞中的位置为
在晶胞中的位置为 周围与其最近的O的个数为
周围与其最近的O的个数为
您最近一年使用:0次
2 . 为减少对环境的污染,工业上常用电解法对煤进行脱硫处理。原理:利用电极反应先将 变为
变为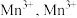 再与煤中的含硫物质(主要为
再与煤中的含硫物质(主要为 ,结构如图)发生反应:
,结构如图)发生反应: (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
 变为
变为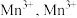 再与煤中的含硫物质(主要为
再与煤中的含硫物质(主要为 ,结构如图)发生反应:
,结构如图)发生反应: (未配平)。下列说法不正确的是
(未配平)。下列说法不正确的是
A. 中存在非极性键 中存在非极性键 |
B.氧化性: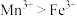 |
C.还原剂与氧化剂的物质的量之比为 |
D.生成 ,转移电子的物质的量为 ,转移电子的物质的量为 |
您最近一年使用:0次
名校
解题方法
3 . 某实验小组在实验室用Cl2氧化Bi(OH)3制备NaBiO3, 并探究其氧化性。
I. 查阅资料:
①NaBiO3固体不溶于冷水,加沸水分解,遇酸则迅速分解,在酸性条件下能将 Mn2+氧化为MnO 。
。
②Bi(OH)3为白色难溶于水的固体。
Ⅱ.制备NaBiO3(夹持及加热等装置略)

(1)写出装置A中反应的离子方程式___________ 。
(2)若没有装置B,可能产生的影响是___________ 。
(3)装置C中Cl2发生的主要反应化学方程式为___________ ,另外还有Cl2+2NaOH=NaCl+NaClO+H₂O。
(4)反应结束后, 装置C中的浊液经过滤、___________ 、 干燥得 NaBiO3粗产品。
Ⅲ.测定 NaBiO3产品纯度:
取上述NaBiO3粗产品 wg,加入足量稀硫酸和 MnSO4稀溶液使其完全反应,再用cmol/L的 H2C2O4标准溶液滴定生成的 MnO ,消耗 vmL 标准溶液。
,消耗 vmL 标准溶液。
(5)不能用cmol/L 的 H2C2O4标准溶液直接滴定NaBiO3的原因是___________ 。
(6)该产品的纯度为___________ (用含 w、c、v的代数式表示)。
IV.探究 NaBiO3的氧化性:
(7)取少量装置C中反应后的悬浊液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该实验___________ (填“能”或“不能” )证明一定是 NaBiO3氧化了Cl2,理由是___________ 。
I. 查阅资料:
①NaBiO3固体不溶于冷水,加沸水分解,遇酸则迅速分解,在酸性条件下能将 Mn2+氧化为MnO
 。
。②Bi(OH)3为白色难溶于水的固体。
Ⅱ.制备NaBiO3(夹持及加热等装置略)

(1)写出装置A中反应的离子方程式
(2)若没有装置B,可能产生的影响是
(3)装置C中Cl2发生的主要反应化学方程式为
(4)反应结束后, 装置C中的浊液经过滤、
Ⅲ.测定 NaBiO3产品纯度:
取上述NaBiO3粗产品 wg,加入足量稀硫酸和 MnSO4稀溶液使其完全反应,再用cmol/L的 H2C2O4标准溶液滴定生成的 MnO
 ,消耗 vmL 标准溶液。
,消耗 vmL 标准溶液。(5)不能用cmol/L 的 H2C2O4标准溶液直接滴定NaBiO3的原因是
(6)该产品的纯度为
IV.探究 NaBiO3的氧化性:
(7)取少量装置C中反应后的悬浊液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该实验
您最近一年使用:0次
2023-11-03更新
|
384次组卷
|
2卷引用:广东实验中学2023-2024学年高三上学期10月月考化学试题
4 . 某工厂以辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)和软锰矿(主要成分为
杂质)和软锰矿(主要成分为 )为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
)为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
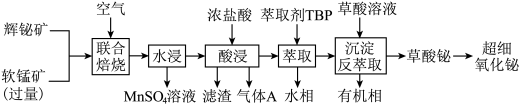
已知:①联合焙烧时 、
、 转变为
转变为 、
、 ;
;
② 易与
易与 形成
形成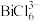 ,
,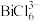 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: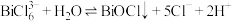
(1)Bi位于元素周期表第六周期第ⅤA族,其价层电子排布式为___________ 。
(2)写出“联合焙烧”时 和
和 反应的化学方程式
反应的化学方程式___________ 。
(3)若焙烧时 过量可分解为
过量可分解为 ,则“酸浸”时
,则“酸浸”时 会转化为
会转化为 ,此时生成的气体A为
,此时生成的气体A为___________ 。(填化学式)
(4)“酸浸”时需及时补充浓盐酸调节酸浸液的pH小于1.4,其目的是___________ 。
(5)铋离子能被有机萃取剂TBP萃取,其萃取原理可表示为: ,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是
,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是___________ 。

(6)沉淀反萃取所得草酸铋[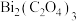 ]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了
]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了 的明锐衍射峰。
的明锐衍射峰。
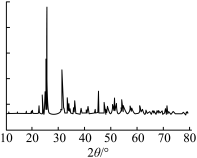
① 属于
属于___________ (填“晶体”或“非晶体”)
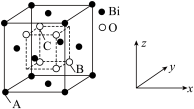
② 的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (
的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (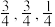 ),则C点坐标为
),则C点坐标为___________ ,若晶胞中两个Bi原子的最近距离为anm,晶体密度
___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含有
,含有 、
、 杂质)和软锰矿(主要成分为
杂质)和软锰矿(主要成分为 )为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
)为原料,采用联合焙烧法制备超细氧化铋。工艺流程如下:
已知:①联合焙烧时
 、
、 转变为
转变为 、
、 ;
;②
 易与
易与 形成
形成 ,
,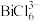 易发生水解,其反应的离子方程式为:
易发生水解,其反应的离子方程式为: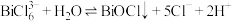
(1)Bi位于元素周期表第六周期第ⅤA族,其价层电子排布式为
(2)写出“联合焙烧”时
 和
和 反应的化学方程式
反应的化学方程式(3)若焙烧时
 过量可分解为
过量可分解为 ,则“酸浸”时
,则“酸浸”时 会转化为
会转化为 ,此时生成的气体A为
,此时生成的气体A为(4)“酸浸”时需及时补充浓盐酸调节酸浸液的pH小于1.4,其目的是
(5)铋离子能被有机萃取剂TBP萃取,其萃取原理可表示为:
 ,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是
,萃取温度对铋、铁萃取率的影响如图所示,Bi的萃取率随萃取温度的升高而降低的原因可能是
(6)沉淀反萃取所得草酸铋[
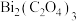 ]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了
]用酒精洗去有机残余物,干燥后,在600℃、空气气氛下保温2h进行热分解,热分解产物的X射线衍射图谱如图所示,出现了 的明锐衍射峰。
的明锐衍射峰。
①
 属于
属于②
 的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (
的立方晶胞结构如图所示,以A点为原点建立分数坐标,已知A点坐标为(0,0,0),B点坐标为 (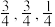 ),则C点坐标为
),则C点坐标为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
解题方法
5 . 工厂烟气(主要污染物 SO2、NO)直接排放会造成空气污染,需处理后才能排放。
(1)O3 氧化:O3 氧化过程中部分反应的能量变化如图所示, Ea1 是反应的活化能,一定条件下,活化能越大反应速 率越慢,反应越困难。

①写出 NO 与 O3 反应的热化学方程式:___________ 。
②在相同条件下,O3 与 SO2 反应的速率___________ O3 与 NO 的反应速率。(填“>”“<”或“=”)
③其他条件不变时,工厂烟气处理主要发生 NO 与 O3 反应,即使增加 n(O3),O3 氧化 SO2 的反应几乎不受影响, 可能原因是___________ 。
(2)NaClO2 氧化:40 ℃时向一定量 NaClO2 溶液中按一定流速持续通入工厂烟气,溶液的 pH 与 ORP 值(氧化还原 电位)随时间变化如图所示。

①写出溶液中 NO 与 反应生成
反应生成 和 Cl-的离子方程式:
和 Cl-的离子方程式:___________ 。
②烟气中含有少量 SO2,NO 的脱除率比不含 SO2 的烟气高,可能原因是___________ 。
(1)O3 氧化:O3 氧化过程中部分反应的能量变化如图所示, Ea1 是反应的活化能,一定条件下,活化能越大反应速 率越慢,反应越困难。

①写出 NO 与 O3 反应的热化学方程式:
②在相同条件下,O3 与 SO2 反应的速率
③其他条件不变时,工厂烟气处理主要发生 NO 与 O3 反应,即使增加 n(O3),O3 氧化 SO2 的反应几乎不受影响, 可能原因是
(2)NaClO2 氧化:40 ℃时向一定量 NaClO2 溶液中按一定流速持续通入工厂烟气,溶液的 pH 与 ORP 值(氧化还原 电位)随时间变化如图所示。

①写出溶液中 NO 与
 反应生成
反应生成 和 Cl-的离子方程式:
和 Cl-的离子方程式:②烟气中含有少量 SO2,NO 的脱除率比不含 SO2 的烟气高,可能原因是
您最近一年使用:0次
解题方法
6 . 下列反应的离子方程式正确的是
A.向NaHSO4中滴加少量Ba(HCO3)2溶液: |
B.向有AgCl沉淀的溶液中滴加氨水,沉淀消失: |
C.向FeI2溶液中通入一定量氯气,测得有50%的Fe2+被氧化: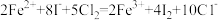 |
D.NaHCO3的水解: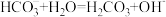 |
您最近一年使用:0次
2023-11-01更新
|
1180次组卷
|
3卷引用:2024届广东省湛江市普通高中毕业班调研测试化学试题
名校
解题方法
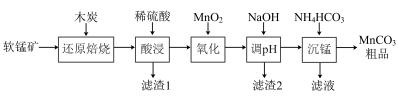
7 . 锰在冶金工业、电子工业等方面有广泛应用。某软锰矿的主要成分为MnO2、SiO2、CaO和少量的MgO、CuO,一种利用废铁屑还原浸出该软锰矿并制取金属锰的工艺流程如下:
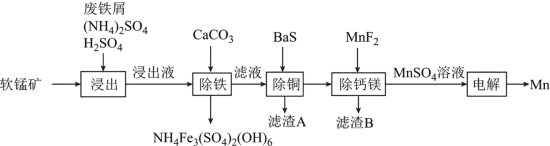
(1)废铁屑表面含有油脂,除去表面油脂的方法是___________ 。
(2)写出“浸出”时Fe与MnO2反应的离子方程式:___________ 。
(3)“除铁”时加入CaCO3的主要作用是___________ ;滤渣A的主要成分为___________ 、___________ (填化学式)。
(4)除铁后的滤液若酸性过强,加入BaS溶液后可能造成污染,原因是___________ 。(用离子反应方程式表示)
(5)电解硫酸锰溶液的装置示意图如下:
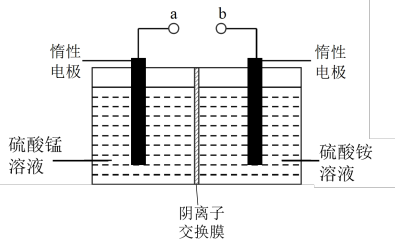
电解时Mn在___________ (填“阴”或“阳”)极析出,阳极产生O2的电极反应式为___________ ,阳极室的溶液可返回上述“___________ ”工序循环使用。

(1)废铁屑表面含有油脂,除去表面油脂的方法是
(2)写出“浸出”时Fe与MnO2反应的离子方程式:
(3)“除铁”时加入CaCO3的主要作用是
(4)除铁后的滤液若酸性过强,加入BaS溶液后可能造成污染,原因是
(5)电解硫酸锰溶液的装置示意图如下:

电解时Mn在
您最近一年使用:0次
8 . 某兴趣小组设计相关实验方案对Cu2+、Ag+氧化性的强弱进行探究。
已知:①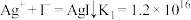 ;
;
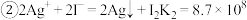
I.溶液准备
(1)配制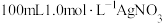 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、___________ 、___________ ,测得该溶液的pH≈4。
II.通过置换反应比较
(2)向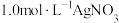 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性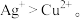 写出该反应的化学方程式是
写出该反应的化学方程式是___________ 。
Ⅲ.通过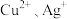 分别与同一物质反应进行比较
分别与同一物质反应进行比较
(3)①经检验,实验i中反应后溶液不含I2,则该反应产生的黄色沉淀是___________ 。
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有___________ (填离子符号)。
b.白色沉淀A与AgNO3溶液反应的离子方程式是___________ ,说明氧化性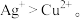
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因___________ ,Ag+更易与I-发生复分解反应,生成AgI,故Ag+未能氧化I-;
②结合实验ii的反应方程式及其特点分析:___________ ,促进反应向正反应方向进行,故Cu2+能更易氧化I⁻。
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为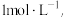 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
(5)①实验v的现象说明Ag+能氧化Γ,a中溶液呈棕黄色的原因是___________ (用电极反应式表示)。
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是___________ ,现象是c中溶液较慢变浅黄色;电流计指针偏转。
小组同学根据实验v和实验vi,可推断氧化性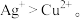
已知:①
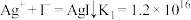 ;
;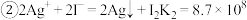
I.溶液准备
(1)配制
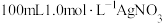 溶液,需使用的玻璃仪器有烧杯、胶头滴管、
溶液,需使用的玻璃仪器有烧杯、胶头滴管、II.通过置换反应比较
(2)向
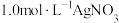 溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性
溶液插入铜丝,析出黑色固体,溶液变蓝,说明氧化性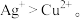 写出该反应的化学方程式是
写出该反应的化学方程式是Ⅲ.通过
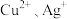 分别与同一物质反应进行比较
分别与同一物质反应进行比较| 编号 | 实验操作 | 现象 |
| 实验i | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL1.0mol·L-1AgNO3溶液 | 产生黄色沉淀,溶液无色 |
| 实验ii | 向1.0mL1.0mol·L-1KI溶液中滴加1.0mL0.5mol·L-1Cu(NO3)2溶液 | 产生白色沉淀A,溶液变黄色 |
②经检验,实验ii中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认白色沉淀A的实验iii如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有
b.白色沉淀A与AgNO3溶液反应的离子方程式是
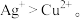
(4)分析“实验i”中Ag+未能氧化I-,而“实验ii”中Cu2+能氧化I-的原因。
①结合K值分析:因
②结合实验ii的反应方程式及其特点分析:
IV.通过设计原电池装置进行比较
电极均为石墨,KI和AgNO3溶液浓度均为
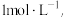 d中是
d中是 Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:
Cu(NO3)2溶液,且b,d中溶液pH≈4;在相同时间内,观察到三组实验的部分现象如下:| 编号 | 实验iv | 实验v | 实验vi |
| 装置 | 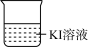 | 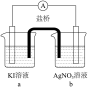 | 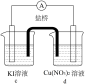 |
| 现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极上析出银;电流计指针偏转 | c中溶液较慢变浅黄色;电流计指针偏转 |
②实验vi的实验现象不足以说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,小组同学设计实验并证实该依据,他们的实验方案是
小组同学根据实验v和实验vi,可推断氧化性
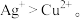
您最近一年使用:0次
2023-10-29更新
|
413次组卷
|
2卷引用:广东省深圳市宝安区2023-2024学年高三上学期第一次调研测试化学试题
9 . 碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作含锰的催化剂,瓷釉、涂料和清漆的颜料等。利用软锰矿(主要成分是MnO2还含有Fe2O3、CaCO3、CuO等杂质)制备碳酸锰的流程如下图所示:
②部分阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
(1)“还原焙烧”中,MnO2转化为MnO,如果是在实验室中进行该项操作,装软锰矿的仪器名称是___________ 。
(2)滤渣1的主要成分有木炭、___________ 、___________ 。
(3)“调pH”时, pH控制的范围为______ ≤pH<______ 。
(4)“沉锰”时发生反应的离子方程式为___________ ; 此步骤需加热, 温度不能太高也不能太低, 原因是___________ 。
(5) 中存在过氧键(-O-O-),
中存在过氧键(-O-O-),  中S的化合价为
中S的化合价为___________ ;实验室可以用  溶液来检验 Mn2+是否完全发生反应,写出对应的离子方程式
溶液来检验 Mn2+是否完全发生反应,写出对应的离子方程式___________ 。
(6)在600~700℃下,将一定量的 MnCO3置于空气中加热至恒重,此时测得固体的质量残留率为68.70%,则该反应中固体产物的化学式为___________ 。

②部分阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀时的 pH | 7.5 | 2.7 | 4.2 | 8.3 |
| 完全沉淀时的pH | 9.7 | 3.7 | 7.4 | 9.8 |
(1)“还原焙烧”中,MnO2转化为MnO,如果是在实验室中进行该项操作,装软锰矿的仪器名称是
(2)滤渣1的主要成分有木炭、
(3)“调pH”时, pH控制的范围为
(4)“沉锰”时发生反应的离子方程式为
(5)
 中存在过氧键(-O-O-),
中存在过氧键(-O-O-),  中S的化合价为
中S的化合价为 溶液来检验 Mn2+是否完全发生反应,写出对应的离子方程式
溶液来检验 Mn2+是否完全发生反应,写出对应的离子方程式(6)在600~700℃下,将一定量的 MnCO3置于空气中加热至恒重,此时测得固体的质量残留率为68.70%,则该反应中固体产物的化学式为
您最近一年使用:0次
2023-10-29更新
|
513次组卷
|
2卷引用:广东省深圳市宝安区2023-2024学年高三上学期第一次调研测试化学试题
名校
解题方法
10 . 实验室以天青石精矿(主要含 ,还含有少量
,还含有少量 、
、 、
、 )为原料制取
)为原料制取 ,其实验流程如下:
,其实验流程如下:

(1)室温下,反应 达到平衡,则该反应的平衡常数表达式为
达到平衡,则该反应的平衡常数表达式为___________ 。
(2)浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是___________ 。为了提高“浸取Ⅰ”的速率的方法有___________ (写出其中的一条)。
(3)①“焙烧”所得 粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:
粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:___________ 。
②“培烧”过程中使用的主要仪器是___________ 。
A. 蒸发皿 B. 坩埚 C. 试管 D. 烧杯
(4)“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为___________ 。
(5)将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(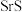 )。写出生成
)。写出生成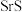 的化学反应方程式:
的化学反应方程式:___________ 。
 ,还含有少量
,还含有少量 、
、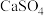 、
、 )为原料制取
)为原料制取 ,其实验流程如下:
,其实验流程如下:
(1)室温下,反应
 达到平衡,则该反应的平衡常数表达式为
达到平衡,则该反应的平衡常数表达式为(2)浸取天青石精矿时,向NH4HCO3溶液中加入适量浓氨水的目的是
(3)①“焙烧”所得
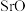 粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:
粗品用蒸馏水多次浸取得Sr(OH)2溶液。判断SrO粗品已经浸取完全的方法:②“培烧”过程中使用的主要仪器是
A. 蒸发皿 B. 坩埚 C. 试管 D. 烧杯
(4)“沉淀”过程中除得到SrSO4外,还得到一种可循环利用的物质,该物质为
(5)将SrSO4与煤粉按照一定比例混合后煅烧得到一种黑灰(
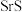 )。写出生成
)。写出生成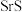 的化学反应方程式:
的化学反应方程式:
您最近一年使用:0次



