解题方法
1 . 钉(Ru)为重要的稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为Ru、Pb、 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: 、
、 。
。
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为________ ;最佳反应温度为________ 。 。则“还原”过程中每生成
。则“还原”过程中每生成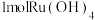 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为________ 。
(3)“蒸馏”过程的化学反应方程式为________ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为________ 、________ 。
(5)可用氢还原重量法测定产品的纯度,其原理为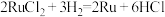 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为________ 。
 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: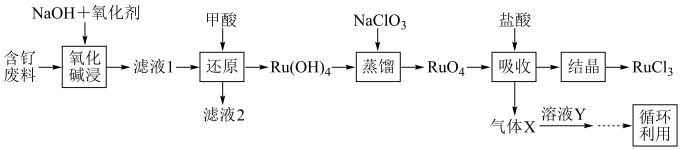
 、
、 。
。(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为
 。则“还原”过程中每生成
。则“还原”过程中每生成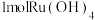 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为(3)“蒸馏”过程的化学反应方程式为
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢还原重量法测定产品的纯度,其原理为
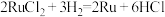 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.000 | 2.0210 |
② | 5.000 | 2.0190 |
③ | 5.000 | 2.0200 |
您最近一年使用:0次
解题方法
2 . 在生活中亚硝酸钠 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
②酸性高锰酸钾溶液可将 氧化成
氧化成 。
。
回答下列问题:
Ⅰ. 的制备:
的制备:
(1)装置A中的仪器名称分别是______ ,仪器按气流方向连接顺序为b→______ 。
(2)反应开始前打开止水夹a,通入过量氮气的目的是______ ;反应结束后打开止水夹a,再通入过量氮气的目的是______ 。
(3)装置D的作用是______ 。
(4)判断 已被NO反应完全的现象是
已被NO反应完全的现象是______ 。
Ⅱ.
(5)写出实验室制氨气的化学方程式______ 。
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为______ %。
 应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知
应用十分广泛,它是一种白色固体,外观与NaCl极其相似;少量可做食品的护色剂,可防止肉毒杆菌在肉类食品中生长。某化学兴趣小组查阅资料得知 ,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。
,该学习小组利用下列装置制备干燥的亚硝酸钠(夹持及加热装置略去,部分仪器可重复使用)。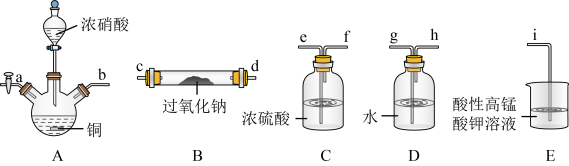
②酸性高锰酸钾溶液可将
 氧化成
氧化成 。
。回答下列问题:
Ⅰ.
 的制备:
的制备:(1)装置A中的仪器名称分别是
(2)反应开始前打开止水夹a,通入过量氮气的目的是
(3)装置D的作用是
(4)判断
 已被NO反应完全的现象是
已被NO反应完全的现象是Ⅱ.
(5)写出实验室制氨气的化学方程式
Ⅲ.测定的纯度(假设杂质不与反应):
(6)准确称取反应后的固体3.000g于烧杯中,加入蒸馏水溶解,配成250mL的溶液;取出25.00mL的溶液于锥形瓶中,滴入
 的酸性
的酸性 溶液至恰好完全反应,用去16mL的酸性
溶液至恰好完全反应,用去16mL的酸性 溶液。固体中
溶液。固体中 的纯度为
的纯度为
您最近一年使用:0次
3 . 草酸与草酸钠在生产、科研中应用广泛。
(1)草酸(H2C2O4)又名乙二酸,为无色透明晶体,是二元有机酸,是化学分析中常用的还原剂,也是一种重要的有机化工原料。
某小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸氧化乙炔制取H2C2O4,实验装置如下图所示:
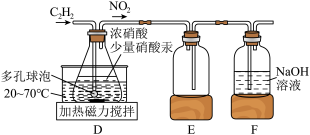
①装置D不能用明火加热的原因是___________ 。
②写出装置D中制备H2C2O4的化学方程式___________ 。
③下列实验设计不能证明草酸是弱酸的是________________ 。
A.室温下,用pH计测定0.1mol•L-1H2C2O4水溶液pH,pH=1.3
B.室温下,取pH广泛试纸测定Na2C2O4溶液pH,pH>7
C.室温下,取pH=1的H2C2O4溶液稀释100倍后,测其pH<3
D.标准状况下,取0.10mol∙L-1的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL
(2)草酸钠(Na2C2O4)为白色结晶性粉末,是一种还原剂,也常作为双齿配体,可以被酸性高锰酸钾溶液氧化。某小组利用配制的草酸钠溶液测定高锰酸钾(M=158g/mol)产品纯度,步骤如下:
I.称取4.0g高锰酸钾产品,配成100mL溶液。
Ⅱ.准确量取0.10mol/LNa2C2O4溶液100mL,置于锥形瓶中
Ⅲ .将瓶中溶液加热到75~80℃,再加入少量硫酸酸化,趁热用I中配制的高锰酸钾溶液滴定,滴定终点消耗高锰酸钾溶液20.00mL。
①步骤I中用到的玻璃仪器除了小烧杯、玻璃棒、胶头滴管外,还有___________ 。
②滴定过程中反应的离子方程式为___________ 。
③在室温下,该反应的速率缓慢,因此常将溶液加热至343~358K进行滴定。但温度不宜过高,加热温度高于363K,会使部分H2C2O4发生分解,会导致测得的高锰酸钾产品纯度___________ 。(填“偏高”、“偏低”或“无影响”)
④实验测得高锰酸钾的纯度为___________ 。
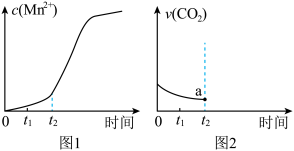
⑤若该实验中测得反应液中Mn2+的浓度随反应时间t的变化如图1所示,结合图1信息,请在图2画出t2后生成CO2的速率图像___________ (从a点开始作图)。
(1)草酸(H2C2O4)又名乙二酸,为无色透明晶体,是二元有机酸,是化学分析中常用的还原剂,也是一种重要的有机化工原料。
某小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸氧化乙炔制取H2C2O4,实验装置如下图所示:

①装置D不能用明火加热的原因是
②写出装置D中制备H2C2O4的化学方程式
③下列实验设计不能证明草酸是弱酸的是
A.室温下,用pH计测定0.1mol•L-1H2C2O4水溶液pH,pH=1.3
B.室温下,取pH广泛试纸测定Na2C2O4溶液pH,pH>7
C.室温下,取pH=1的H2C2O4溶液稀释100倍后,测其pH<3
D.标准状况下,取0.10mol∙L-1的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL
(2)草酸钠(Na2C2O4)为白色结晶性粉末,是一种还原剂,也常作为双齿配体,可以被酸性高锰酸钾溶液氧化。某小组利用配制的草酸钠溶液测定高锰酸钾(M=158g/mol)产品纯度,步骤如下:
I.称取4.0g高锰酸钾产品,配成100mL溶液。
Ⅱ.准确量取0.10mol/LNa2C2O4溶液100mL,置于锥形瓶中
Ⅲ .将瓶中溶液加热到75~80℃,再加入少量硫酸酸化,趁热用I中配制的高锰酸钾溶液滴定,滴定终点消耗高锰酸钾溶液20.00mL。
①步骤I中用到的玻璃仪器除了小烧杯、玻璃棒、胶头滴管外,还有
②滴定过程中反应的离子方程式为
③在室温下,该反应的速率缓慢,因此常将溶液加热至343~358K进行滴定。但温度不宜过高,加热温度高于363K,会使部分H2C2O4发生分解,会导致测得的高锰酸钾产品纯度
④实验测得高锰酸钾的纯度为
⑤若该实验中测得反应液中Mn2+的浓度随反应时间t的变化如图1所示,结合图1信息,请在图2画出t2后生成CO2的速率图像

您最近一年使用:0次
名校
4 . 回答下列问题:
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:_______ 。
(2)在一定条件下, 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被_______ (填“氧化”或“还原”), 中R的化合价是
中R的化合价是_______ 价。
(3)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。
①该反应中的氧化剂是_______ (填化学式,下同)
②该反应中,发生还原反应的过程是:_______ →_______ 。
(4) ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目_______ 。
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和
 反应的化学方程式:
反应的化学方程式:(2)在一定条件下,
 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被 中R的化合价是
中R的化合价是(3)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。①该反应中的氧化剂是
②该反应中,发生还原反应的过程是:
(4)
 ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目
您最近一年使用:0次
名校
解题方法
5 .  是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为
是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为 的无害化处理流程图,回答下列问题:
的无害化处理流程图,回答下列问题:
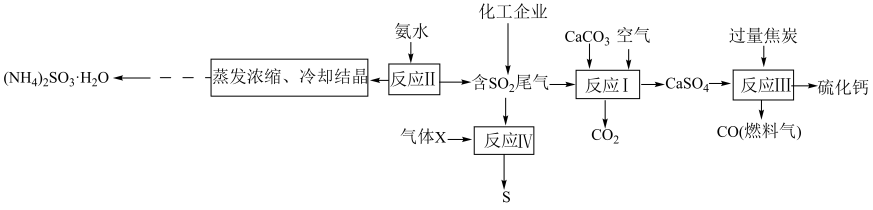
(1)“反应I”在高温条件下进行,写出该反应的化学方程式:_______ 。
(2)X可能为_______ (填化学式),电子式为_______ ,该反应说明 具有
具有_______ (填“氧化性”或“还原性”)。
(3)“反应Ⅲ”中参加反应的氧化剂与还原剂的物质的量之比为_______ 。
(4)“蒸发浓缩、冷却结晶”后获得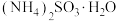 固体的操作是
固体的操作是_______ ,实验室进行此操作需要用到的玻璃仪器有漏斗、_______ 。不直接采用蒸发结晶的原因是_______ 。
(5)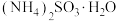 暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:
暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:_______ 。
A.稀硝酸, B.稀盐酸,
B.稀盐酸, C.稀盐酸,硝酸钡
C.稀盐酸,硝酸钡
 是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为
是有毒气体,任意排放会造成环境污染。若加以利用,可以变废为宝。下图为 的无害化处理流程图,回答下列问题:
的无害化处理流程图,回答下列问题:
(1)“反应I”在高温条件下进行,写出该反应的化学方程式:
(2)X可能为
 具有
具有(3)“反应Ⅲ”中参加反应的氧化剂与还原剂的物质的量之比为
(4)“蒸发浓缩、冷却结晶”后获得
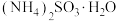 固体的操作是
固体的操作是(5)
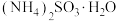 暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:
暴露在空气中易被氧化而变质,可以选用哪组试剂进行验证:A.稀硝酸,
 B.稀盐酸,
B.稀盐酸, C.稀盐酸,硝酸钡
C.稀盐酸,硝酸钡
您最近一年使用:0次
名校
6 . 下列离子方程式书写正确的是
A.明矾溶液与过量氨水混合: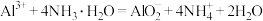 |
B.过量铁粉与稀硝酸反应,产生无色气体: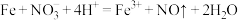 |
C. 稀溶液与 稀溶液与 溶液混合: 溶液混合: |
D.向 溶液中滴加稀盐酸: 溶液中滴加稀盐酸: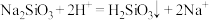 |
您最近一年使用:0次
解题方法
7 . A、B、C、D、E、F为短周期元素,其中C的原子序数最小,它们的最高正价与原子半径关系如图所示。

回答下列问题:
(1)F离子结构示意图为______ ;化合物EF2的电子式为______ 。
(2)从原子结构角度解释A金属性强于B的原因:______ 。
(3)CE2属于易燃易爆液体,严禁旅客携带,则CE2的结构式为______ ,写出CE2在足量O2中燃烧的化学方程式______ 。
(4)化合物AD3常用于安全气囊,该化合物含有的化学键类型有______ (填“离子键”、“极性键”或“非极性键”)。
(5)在硝酸工业中,D的氢化物能发生催化氧化反应,写出该反应的化学方程式为______ 。
(6)化合物A2CE3在工业上可用于处理废水中的重金属离子。向溶液中滴加酸性KMnO4溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式:______ 。

回答下列问题:
(1)F离子结构示意图为
(2)从原子结构角度解释A金属性强于B的原因:
(3)CE2属于易燃易爆液体,严禁旅客携带,则CE2的结构式为
(4)化合物AD3常用于安全气囊,该化合物含有的化学键类型有
(5)在硝酸工业中,D的氢化物能发生催化氧化反应,写出该反应的化学方程式为
(6)化合物A2CE3在工业上可用于处理废水中的重金属离子。向溶液中滴加酸性KMnO4溶液,观察到溶液紫色褪去,并有无色无味气体产生,写出该反应的离子方程式:
您最近一年使用:0次
名校
8 . I.某同学设计了如下装置用于制取 和验证
和验证 的漂白性、酸性、还原性。
的漂白性、酸性、还原性。
回答下列问题:
(1)装置 中发生反应的化学方程式为
中发生反应的化学方程式为___________ 。
(2)在框图内选择合适装置依次验证 的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
___________ (填装置字母,还原性设计两个装置)。
(3)装置 中发生反应的离子方程式为
中发生反应的离子方程式为___________ 。
(4)实验前必须鼓入N2,目的是___________ 。
(5)装置 中产生了白色沉淀,其成分是
中产生了白色沉淀,其成分是___________ (化学式),分析 中产生白色沉淀原因
中产生白色沉淀原因___________ 。
(6)实验中发现装置A中Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100mL溶液,移取25.00mL溶液,用0.2000mol/L酸性KMnO4溶液进行反应,消耗KMnO4溶液20.00mL,其中KMnO4→Mn2+。产品中Na2SO3的质量分数为___________ (保留三位有效数字)。
(7)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示。
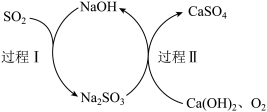
①写出过程I的离子反应方程式___________ 。
②过程II反应中氧化剂与还原剂的物质的量之比为___________ 。
 和验证
和验证 的漂白性、酸性、还原性。
的漂白性、酸性、还原性。

回答下列问题:
(1)装置
 中发生反应的化学方程式为
中发生反应的化学方程式为(2)在框图内选择合适装置依次验证
 的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
的漂白性、酸性、还原性,上述各装置按气流从左到右方向连接顺序为
(3)装置
 中发生反应的离子方程式为
中发生反应的离子方程式为(4)实验前必须鼓入N2,目的是
(5)装置
 中产生了白色沉淀,其成分是
中产生了白色沉淀,其成分是 中产生白色沉淀原因
中产生白色沉淀原因(6)实验中发现装置A中Na2SO3可能部分被氧化,现需测定Na2SO3的纯度:称取10.00g产品,配成100mL溶液,移取25.00mL溶液,用0.2000mol/L酸性KMnO4溶液进行反应,消耗KMnO4溶液20.00mL,其中KMnO4→Mn2+。产品中Na2SO3的质量分数为
(7)查阅资料知:“尾气”可用双碱脱硫法处理,其过程如图所示。

①写出过程I的离子反应方程式
②过程II反应中氧化剂与还原剂的物质的量之比为
您最近一年使用:0次
9 . 亚硝酸钠(NaNO2)是一种常见的食品添加剂,在使用过程中必须严格控制用量,否则会导致中毒。为此某兴趣小组制备 并对其性质进行探究。
并对其性质进行探究。
已知: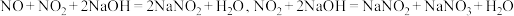
回答下列问题:
Ⅰ.制备
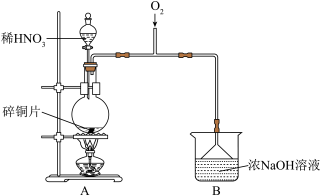
(1)为检验B中制得 ,甲进行以下实验,请将实验补充完整。
,甲进行以下实验,请将实验补充完整。
(2)乙认为上述3组实验无法证明B中一定含 ,还需补充实验,理由是
,还需补充实验,理由是________
Ⅱ.探究 的性质
的性质
资料:ⅰ. 在溶液中呈棕色。
在溶液中呈棕色。
ⅱ. 在溶液中不稳定,易分解产生
在溶液中不稳定,易分解产生 和
和 气体。
气体。
(3)溶液迅速变为棕色的原因是_______ 。
(4)已知棕色溶液变浅是由于生成了 ,反应的离子方程式是
,反应的离子方程式是_______ 。
(5)最终棕褐色溶液的成分是 ,乙认为其中铁元素可能为
,乙认为其中铁元素可能为 ,也可能为
,也可能为 ,或既有
,或既有 也有
也有 ,因此设计以下实验探究,请补齐实验方案。
,因此设计以下实验探究,请补齐实验方案。
 并对其性质进行探究。
并对其性质进行探究。已知:
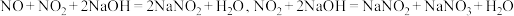
回答下列问题:
Ⅰ.制备


(1)为检验B中制得
 ,甲进行以下实验,请将实验补充完整。
,甲进行以下实验,请将实验补充完整。| 序号 | 试管 | 操作 | 现象 |
| ① |  中溶液 中溶液 | 加 溶液,滴加几滴淀粉溶液 溶液,滴加几滴淀粉溶液 | 不变蓝 |
| ② | 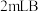 中溶液 中溶液 | 滴加几滴 至 至 ,加 ,加 溶液,滴加几滴淀粉溶液 溶液,滴加几滴淀粉溶液 | 变蓝 |
| ③ | 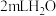 | 滴加几滴 至 至 ,加 ,加 | 不变蓝 |
 ,还需补充实验,理由是
,还需补充实验,理由是Ⅱ.探究
 的性质
的性质| 装置 | 操作 | 现象 |
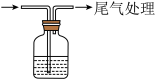 | 取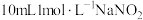 溶液于试剂瓶中,加入几滴 溶液于试剂瓶中,加入几滴 酸化,再加入 酸化,再加入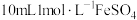 溶液,迅速塞上橡胶塞,缓缓通入足量 溶液,迅速塞上橡胶塞,缓缓通入足量 | ⅰ.溶液迅速变为棕色; ⅱ.溶液逐渐变浅,有无色气泡产生,溶液上方为浅红棕色; iii.最终形成棕褐色溶液。 |
 在溶液中呈棕色。
在溶液中呈棕色。ⅱ.
 在溶液中不稳定,易分解产生
在溶液中不稳定,易分解产生 和
和 气体。
气体。(3)溶液迅速变为棕色的原因是
(4)已知棕色溶液变浅是由于生成了
 ,反应的离子方程式是
,反应的离子方程式是(5)最终棕褐色溶液的成分是
 ,乙认为其中铁元素可能为
,乙认为其中铁元素可能为 ,也可能为
,也可能为 ,或既有
,或既有 也有
也有 ,因此设计以下实验探究,请补齐实验方案。
,因此设计以下实验探究,请补齐实验方案。| 实验操作 | 预期现象与结论 |
步骤1:加入过量稀 于 于 ,溶液中 ,溶液中 | |
| 步骤2:① | ② |
| 步骤3:③ | 若溶液变为红色,则含有Fe3+ |
您最近一年使用:0次
10 . 钼酸钠晶体( )常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是
)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是 ,含少量
,含少量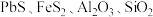 等)为原料生产钼酸钠晶体的工艺流程图:
等)为原料生产钼酸钠晶体的工艺流程图:
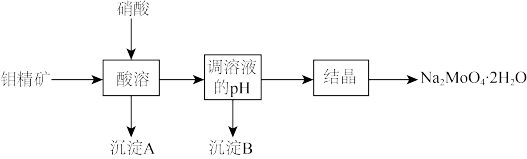
回答下列问题:
(1)将钼精矿粉碎的目的是_______ 。
(2) 中S元素为-2价,酸溶时,
中S元素为-2价,酸溶时, 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)沉淀A的化学式为_______ 。
(4)已知: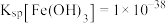 ,
, ,当
,当 完全沉淀时溶液的
完全沉淀时溶液的
_______ ,若此时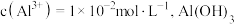 是否会析出?
是否会析出?_______ 。(请计算说明)
(5)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得 的操作为
的操作为_______ 。
(6)已知钼酸是弱酸,钼酸盐对碳钢在空气中的缓蚀原理是钼酸根离子浓度大时可在钢铁表面形成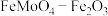 保护膜。在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是_______(填标号)。
保护膜。在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是_______(填标号)。
 )常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是
)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是 ,含少量
,含少量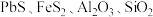 等)为原料生产钼酸钠晶体的工艺流程图:
等)为原料生产钼酸钠晶体的工艺流程图:
回答下列问题:
(1)将钼精矿粉碎的目的是
(2)
 中S元素为-2价,酸溶时,
中S元素为-2价,酸溶时, 发生反应的化学方程式为
发生反应的化学方程式为(3)沉淀A的化学式为
(4)已知:
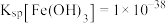 ,
, ,当
,当 完全沉淀时溶液的
完全沉淀时溶液的
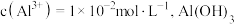 是否会析出?
是否会析出?(5)已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得
 的操作为
的操作为温度/ | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 |
| 析出物质 |  |  | ||||||
溶解度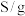 | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45 |
(6)已知钼酸是弱酸,钼酸盐对碳钢在空气中的缓蚀原理是钼酸根离子浓度大时可在钢铁表面形成
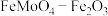 保护膜。在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是_______(填标号)。
保护膜。在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是_______(填标号)。A. | B.通入适量 | C.油脂 | D.盐酸 |
您最近一年使用:0次



