名校
1 . 完成下列各题。
(1)按如图所示操作,充分反应后:
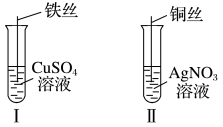
①Ⅰ中发生反应的离子方程式为_____ 。
②Ⅱ中铜丝上观察到现象是_____ 。
③结合Ⅰ、Ⅱ实验现象可知 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____ 。
(2)人体内的铁元素以 和
和 的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含
的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含 的亚铁盐,如硫酸亚铁。服用维生素
的亚铁盐,如硫酸亚铁。服用维生素 ,可使食物中的
,可使食物中的 还原成
还原成 ,有利于人体吸收。这句话说明维生素
,有利于人体吸收。这句话说明维生素 在这一反应中起的作用是
在这一反应中起的作用是_____ 。
(3)实验室可以用铜和稀硝酸反应制取 ,反应的化学方程式如下(未配平):
,反应的化学方程式如下(未配平):
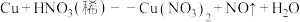
①写出配平后的上述化学方程式:_____ 。
②该反应中,被还原的硝酸与未被还原的硝酸质量比为_____ 。
(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为
②Ⅱ中铜丝上观察到现象是
③结合Ⅰ、Ⅱ实验现象可知
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)人体内的铁元素以
 和
和 的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含
的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含 的亚铁盐,如硫酸亚铁。服用维生素
的亚铁盐,如硫酸亚铁。服用维生素 ,可使食物中的
,可使食物中的 还原成
还原成 ,有利于人体吸收。这句话说明维生素
,有利于人体吸收。这句话说明维生素 在这一反应中起的作用是
在这一反应中起的作用是(3)实验室可以用铜和稀硝酸反应制取
 ,反应的化学方程式如下(未配平):
,反应的化学方程式如下(未配平):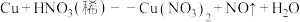
①写出配平后的上述化学方程式:
②该反应中,被还原的硝酸与未被还原的硝酸质量比为
您最近一年使用:0次
名校
解题方法
2 . 下面三个方法都可以用来制氯气:
①4HCl(浓) + MnO2 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
②KClO3 + 6HCl(浓)=3Cl2↑ + KCl + 3H2O
③KMnO4 + HCl(浓)——KCl + MnCl2 + Cl2↑ + H2O(未配平)
根据以上三个反应,回答下列有关问题:
(1)反应②中,氧化产物与还原产物的质量比为_______ 。
(2)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为_______ 。
(3)请将反应③配平:_______
_______KMnO4+_______HCl(浓)=_______KCl+_______MnCl2+_______Cl2↑+_______H2O
(4)工业废水中的Cr2O 有毒,常在酸性条件下用Fe2+做处理剂,将Cr2O
有毒,常在酸性条件下用Fe2+做处理剂,将Cr2O 转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式
转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式_______ 。
①4HCl(浓) + MnO2
 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O②KClO3 + 6HCl(浓)=3Cl2↑ + KCl + 3H2O
③KMnO4 + HCl(浓)——KCl + MnCl2 + Cl2↑ + H2O(未配平)
根据以上三个反应,回答下列有关问题:
(1)反应②中,氧化产物与还原产物的质量比为
(2)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为
(3)请将反应③配平:
_______KMnO4+_______HCl(浓)=_______KCl+_______MnCl2+_______Cl2↑+_______H2O
(4)工业废水中的Cr2O
 有毒,常在酸性条件下用Fe2+做处理剂,将Cr2O
有毒,常在酸性条件下用Fe2+做处理剂,将Cr2O 转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式
转化为Cr3+,其中Fe2+会被转化为Fe3+,反应的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 稀土元素是国家战略资源,广泛应用于显示器、航天、激光、导弹等尖端领域,目前我国稀土提炼技术处于世界领先地位。某化学课题组以废液晶显示屏为原料回收稀土元素铈,实现资源再利用,设计实验流程如下:

已知:①显示屏玻璃中含较多的SiO2、CeO2、FeO、Fe2O3及少量其他可溶于酸的物质;
②CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)将废玻璃粉碎的目的是___________ 。
(2)工序1中加入H2O2的作用是___________ 。
(3)工序3先经过系列操作所得潮湿NH4Fe(SO4)2晶体宜________ (填“常温晾干”或“加热烘干”)。
(4)工序4中加入稀硫酸和H2O2溶液的反应的离子方程式为___________ ;写出滤渣2主要成分的一种用途___________ 。
(5)硫酸铁铵可用作净水剂,但在除酸性废水中悬浮物时效果较差,原因可能是___________ 。
(6)取上述流程中得到Ce(OH)4产品0.560g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗20.00mL标准溶液。该产品中Ce元素的质量分数为___________ 。

已知:①显示屏玻璃中含较多的SiO2、CeO2、FeO、Fe2O3及少量其他可溶于酸的物质;
②CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)将废玻璃粉碎的目的是
(2)工序1中加入H2O2的作用是
(3)工序3先经过系列操作所得潮湿NH4Fe(SO4)2晶体宜
(4)工序4中加入稀硫酸和H2O2溶液的反应的离子方程式为
(5)硫酸铁铵可用作净水剂,但在除酸性废水中悬浮物时效果较差,原因可能是
(6)取上述流程中得到Ce(OH)4产品0.560g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗20.00mL标准溶液。该产品中Ce元素的质量分数为
您最近一年使用:0次
解题方法
4 . 以萃铜余液为原料制备工业活性氧化锌,其生产工艺流程如图所示:
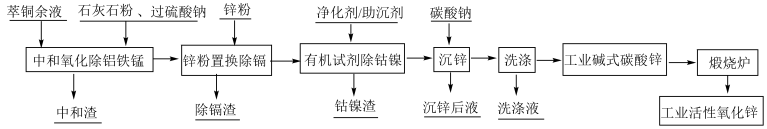
(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式_______ ;采用石灰石粉中和除去铝和铁,则中和渣中主要成分为_______ 。
(2)流程中用到最多的操作是_______ ,该操作中玻璃棒的作用是_______ 。
(3)用锌粉除镉(Cd2+ )的离子方程式为_______ ;沉锌生成碱式碳酸锌[2Zn(OH2)·ZnCO3·H2O]的化学方程式为_______ 。
(4)检验碱式碳酸锌洗涤干净的操作及现象为_______ 。
(5)煅烧炉中发生反应的化学方程式为_______ 。

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式
(2)流程中用到最多的操作是
(3)用锌粉除镉(Cd2+ )的离子方程式为
(4)检验碱式碳酸锌洗涤干净的操作及现象为
(5)煅烧炉中发生反应的化学方程式为
您最近一年使用:0次
5 . 高锰酸钾是强氧化剂,用途十分广泛。按要求回答下列问题:
Ⅰ.某化学兴趣小组以绿色的锰酸钾(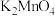 )碱性溶液为主要原料在实验室制备
)碱性溶液为主要原料在实验室制备 实验装置(固定和加热装置已省略)如下:
实验装置(固定和加热装置已省略)如下:
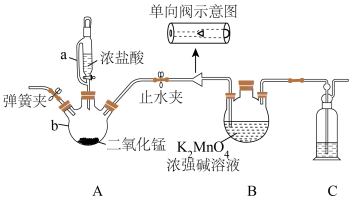
(1)仪器b的名称是___________ ,侧管a的作用是___________ 。
(2)装置C盛装溶液的成分是___________ 。
(3)单向阀(只允许气体从左流向右)可以起到的作用是___________ 。
(4)装置B中生成 的离子方程式为
的离子方程式为___________ 。
Ⅱ.某 (
(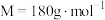 )样品中含有
)样品中含有 (
(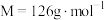 )和其它不易被氧化的杂质,采用滴定法测定该样品的组成,实验步骤如下:
)和其它不易被氧化的杂质,采用滴定法测定该样品的组成,实验步骤如下:
步骤1:取mg样品于锥形瓶中,加入稀 溶解,75℃水浴加热。用
溶解,75℃水浴加热。用 的
的 溶液趁热滴定至终点,消耗溶液
溶液趁热滴定至终点,消耗溶液 。
。
步骤2:向上述溶液中加入适量还原剂将 完全还原为
完全还原为 ,加入稀
,加入稀 酸化后,在75°C继续用
酸化后,在75°C继续用 溶液滴定至终点,又消耗溶液
溶液滴定至终点,又消耗溶液 。
。
(5)步骤1滴定操作中盛装 溶液的玻璃仪器是
溶液的玻璃仪器是___________ ;滴定终点的现象是:___________ 。
(6)样品中所含 的质量分数表达式为
的质量分数表达式为___________ 。
Ⅰ.某化学兴趣小组以绿色的锰酸钾(
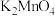 )碱性溶液为主要原料在实验室制备
)碱性溶液为主要原料在实验室制备 实验装置(固定和加热装置已省略)如下:
实验装置(固定和加热装置已省略)如下:
(1)仪器b的名称是
(2)装置C盛装溶液的成分是
(3)单向阀(只允许气体从左流向右)可以起到的作用是
(4)装置B中生成
 的离子方程式为
的离子方程式为Ⅱ.某
 (
(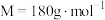 )样品中含有
)样品中含有 (
(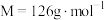 )和其它不易被氧化的杂质,采用滴定法测定该样品的组成,实验步骤如下:
)和其它不易被氧化的杂质,采用滴定法测定该样品的组成,实验步骤如下:步骤1:取mg样品于锥形瓶中,加入稀
 溶解,75℃水浴加热。用
溶解,75℃水浴加热。用 的
的 溶液趁热滴定至终点,消耗溶液
溶液趁热滴定至终点,消耗溶液 。
。步骤2:向上述溶液中加入适量还原剂将
 完全还原为
完全还原为 ,加入稀
,加入稀 酸化后,在75°C继续用
酸化后,在75°C继续用 溶液滴定至终点,又消耗溶液
溶液滴定至终点,又消耗溶液 。
。(5)步骤1滴定操作中盛装
 溶液的玻璃仪器是
溶液的玻璃仪器是(6)样品中所含
 的质量分数表达式为
的质量分数表达式为
您最近一年使用:0次
名校
6 . 按要求填空。
(1)①基态镓(Ga)原子的核外电子排布式为_______ 。
②SO3分子VSEPR_______ 。
(2)向新制Cu(OH)2的悬浊液滴加少量乙醛,并加热,写出其反应化学方程式:_______ 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:_______ 。
(4)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的离子方程式:_______ 。
(5)H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为_______ (填化学式)。
(6)联氨(N2H4)是一种常用的还原剂。其氧化产物一般为N2.联氨可用于处理高压锅炉水中溶解的氧,防止锅炉被腐蚀。理论上1.0 kg的联氨可除去水中溶解的O2_______ kg。
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_______ 。(计算结果保留两位小数)
(1)①基态镓(Ga)原子的核外电子排布式为
②SO3分子VSEPR
(2)向新制Cu(OH)2的悬浊液滴加少量乙醛,并加热,写出其反应化学方程式:
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
(4)将ClO2通入到硫化氢溶液中,然后加入少量的稀盐酸酸化的氯化钡溶液,发现有白色沉淀生成,写出二氧化氯与硫化氢溶液反应的离子方程式:
(5)H3PO2是一元中强酸,H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。利用H3PO2进行化学镀银的反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为
(6)联氨(N2H4)是一种常用的还原剂。其氧化产物一般为N2.联氨可用于处理高压锅炉水中溶解的氧,防止锅炉被腐蚀。理论上1.0 kg的联氨可除去水中溶解的O2
(7)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为
您最近一年使用:0次
名校
7 . NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也用于生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等),从矿渣[含NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为___________ [Ksp(CaF2)=4.0×10-11]。
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ___________ 。在 ___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。 。
。___________ ,离子交换膜(b)为 ___________ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为___________ 。
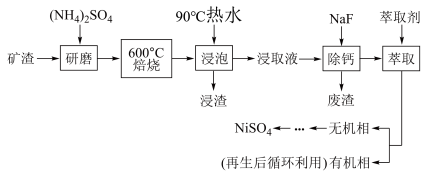
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 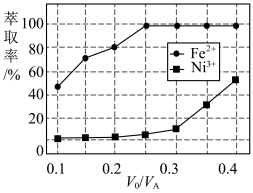
 。
。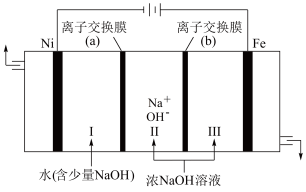
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为
您最近一年使用:0次
2023-10-03更新
|
555次组卷
|
7卷引用:2019-2020广东省广州市天河区东圃中学高三化学试卷(10月考)
8 . NaHSO3是常见的亚硫酸盐,在潮湿的空气中易被氧化,在工业生产和实验室都有着广泛的应用。为探究NaHSO3溶液的性质,甲同学配制了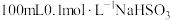 溶液。做了如下实验:
溶液。做了如下实验:
(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、_____ 、_____ 。
(2)常温下,用pH计测量新配制的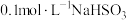 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。
①若在实验室用pH试纸测量溶液的pH,其简单操作为_____ 。
②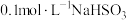 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2_____ (填“>”、“<”或“=”) 的第二步水解常数
的第二步水解常数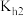 。
。
(3)将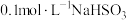 溶液与
溶液与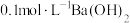 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:_____ 。
探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c._____
验证猜想:
乙同学认为猜想b不正确,原因为_____
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若_____ ,证明猜想c正确。
(4)将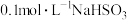 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:_____ 。该现象说明NaHSO3溶液具有_____ (填“氧化性”、“还原性”或“氧化性和还原性”)。
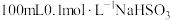 溶液。做了如下实验:
溶液。做了如下实验:(1)配制溶液需用到的玻璃仪器有玻璃棒、量筒、烧杯、
(2)常温下,用pH计测量新配制的
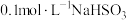 溶液的pH,测得pH约为4.1。
溶液的pH,测得pH约为4.1。①若在实验室用pH试纸测量溶液的pH,其简单操作为
②
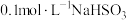 溶液呈酸性,说明H2SO3的第二步电离常数Ka2
溶液呈酸性,说明H2SO3的第二步电离常数Ka2 的第二步水解常数
的第二步水解常数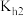 。
。(3)将
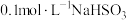 溶液与
溶液与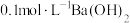 溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:
溶液等体积混合,产生白色沉淀,写出等物质的量的NaHSO3与Ba(OH)2在溶液中发生反应的离子方程式:探究白色沉淀的成分:
提出猜想:
a.只有BaSO3 b.只有BaSO4 c.
验证猜想:
乙同学认为猜想b不正确,原因为
将白色沉淀加入足量盐酸中,若有气泡生成,且沉淀全部溶解,证明猜想a正确;若
(4)将
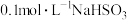 溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
溶液和Na2S溶液混合,再滴入适量稀H2SO4,有淡黄色浑浊物出现。写出该反应的离子方程式:
您最近一年使用:0次
2023-10-02更新
|
96次组卷
|
2卷引用:广东省江门市2024届高三上学期9月金太阳联考化学试题
名校
9 . 氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓 、铁酸锌
、铁酸锌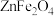 、
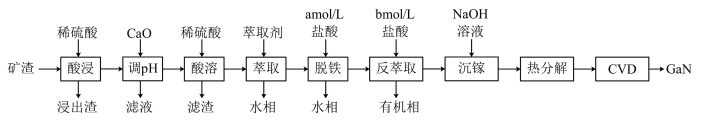
、 ]制备GaN的工艺流程如下:
]制备GaN的工艺流程如下:
已知:
①Ga与Al同主族,化学性质相似。
②常温下,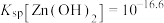 ,
,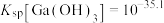 ,
, 。
。
③ 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
回答下列问题:
(1)“酸浸”时能提高反应速率的措施有___________ (答1条即可),“酸浸”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。“酸溶”所得滤渣的主要成分是(填化学式)。
(2)“酸浸”所得浸出液中 、
、 浓度分别为
浓度分别为 、
、 。常温下,为尽可能多地提取
。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,用CaO“调pH”时须不能大于
,用CaO“调pH”时须不能大于___________ (假设调pH时溶液体积不变)。
(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=___________ ,b=___________ (选填上表中盐酸的浓度)。
(4)“沉镓”时,若加入NaOH的量过多,会导致 的沉淀率降低,原因是
的沉淀率降低,原因是___________ (用离子方程式表示)。
(5)利用CVD(化学气相沉积)技术,将热分解得到的 与
与 在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为___________ 。
(6)①GaN的熔点为1700℃, 的熔点为77.9℃,推测它们的晶体类型依次为
的熔点为77.9℃,推测它们的晶体类型依次为___________ 、___________ 。
②基态Ga原子的价层电子排布图为___________ 。
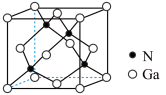
GaN晶体的一种立方晶胞如图所示。该晶胞边长为anm,GaN的式量为Mr,则该晶体密度为___________ g/cm3(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 、铁酸锌
、铁酸锌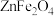 、
、 ]制备GaN的工艺流程如下:
]制备GaN的工艺流程如下:
已知:
①Ga与Al同主族,化学性质相似。
②常温下,
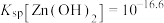 ,
,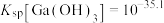 ,
, 。
。③
 、
、 在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。| 盐酸浓度/mol/L | 反萃取率/% | |
 |  | |
| 2 | 86.9 | 9.4 |
| 4 | 69.1 | 52.1 |
| 6 | 17.5 | 71.3 |
(1)“酸浸”时能提高反应速率的措施有
 发生反应的离子方程式为
发生反应的离子方程式为(2)“酸浸”所得浸出液中
 、
、 浓度分别为
浓度分别为 、
、 。常温下,为尽可能多地提取
。常温下,为尽可能多地提取 并确保不混入
并确保不混入 ,用CaO“调pH”时须不能大于
,用CaO“调pH”时须不能大于(3)“脱铁”和“反萃取”时,所用盐酸的浓度a=
(4)“沉镓”时,若加入NaOH的量过多,会导致
 的沉淀率降低,原因是
的沉淀率降低,原因是(5)利用CVD(化学气相沉积)技术,将热分解得到的
 与
与 在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为
在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为(6)①GaN的熔点为1700℃,
 的熔点为77.9℃,推测它们的晶体类型依次为
的熔点为77.9℃,推测它们的晶体类型依次为②基态Ga原子的价层电子排布图为

GaN晶体的一种立方晶胞如图所示。该晶胞边长为anm,GaN的式量为Mr,则该晶体密度为
 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-09-28更新
|
459次组卷
|
4卷引用:广东省部分学校(南粤名校联考)2023-2024学年高三上学期9月联考化学试题
广东省部分学校(南粤名校联考)2023-2024学年高三上学期9月联考化学试题广东省南粤名校2024届高三上学期9月学科综合素养评价联考化学试题(已下线)化学(九省联考考后提升卷,贵州卷)-2024年1月“九省联考”真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题
名校
解题方法
10 . 化学与生产生活联系密切。
(1)FeSO4可作补血剂,用于治疗缺铁性贫血症。用 FeSO4溶液制备 Fe(OH)2的操作是用长滴管吸取不含 O2的 NaOH 溶液,插入FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的原因是为了防止 Fe(OH)2 被氧化,写出其被氧化的化学反应方程式___________ 。
(2)下水道堵塞时,可购买固体管道疏通剂(主要成分有氢氧化钠和铝粉), 使用时,将疏通剂倒入下水道,加入一定量的热水,让它充分反应 30 分钟后,再用大量水冲,即可疏通。写出疏通原理的离子方程式___________ 。
(3)洁厕剂的主要成分是浓盐酸,实验室也经常用盐酸做实验,下图是化学实验室浓盐酸试剂标签上的部分内容。
请回答下列问题:
①该浓盐酸的物质的量浓度为___________ ;
②现要用该浓盐酸配制480 mL 0.5 molL1的盐酸,需该盐酸的体积为___________ mL(计算结果保留一位小数)。
③配制时所用的仪器除量筒、烧杯、玻璃棒外,还需要的仪器有___________ 。
④配制中下列实验操作步骤,其正确的顺序为___________ 。(填小写字母)
a. b.
b. c.
c. d.
d. 
⑤下列操作会使配制结果偏高的是___________ 。
A.容量瓶洗净后未干燥直接用来配制溶液
B.反复摇匀后发现液面低于刻度线,继续加水至刻度线
C.洗涤量筒并将洗涤液转移至容量瓶中
D.用量筒量取浓盐酸配制所需盐酸时,量筒俯视读数
E.定容时,俯视读数
(1)FeSO4可作补血剂,用于治疗缺铁性贫血症。用 FeSO4溶液制备 Fe(OH)2的操作是用长滴管吸取不含 O2的 NaOH 溶液,插入FeSO4溶液液面下,再挤出 NaOH 溶液。这样操作的原因是为了防止 Fe(OH)2 被氧化,写出其被氧化的化学反应方程式
(2)下水道堵塞时,可购买固体管道疏通剂(主要成分有氢氧化钠和铝粉), 使用时,将疏通剂倒入下水道,加入一定量的热水,让它充分反应 30 分钟后,再用大量水冲,即可疏通。写出疏通原理的离子方程式
(3)洁厕剂的主要成分是浓盐酸,实验室也经常用盐酸做实验,下图是化学实验室浓盐酸试剂标签上的部分内容。
| 盐酸 分子式:HCl 相对分子质量:36.5 密度约1.18  HCl的质量分数:36.5% |
①该浓盐酸的物质的量浓度为
②现要用该浓盐酸配制480 mL 0.5 molL1的盐酸,需该盐酸的体积为
③配制时所用的仪器除量筒、烧杯、玻璃棒外,还需要的仪器有
④配制中下列实验操作步骤,其正确的顺序为
a.
 b.
b. c.
c. d.
d. 
⑤下列操作会使配制结果偏高的是
A.容量瓶洗净后未干燥直接用来配制溶液
B.反复摇匀后发现液面低于刻度线,继续加水至刻度线
C.洗涤量筒并将洗涤液转移至容量瓶中
D.用量筒量取浓盐酸配制所需盐酸时,量筒俯视读数
E.定容时,俯视读数
您最近一年使用:0次



