名校
解题方法
1 . 氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。回答下列问题:___________ ;B中圆底烧瓶收集氨气时,请你选择氨气的进气口___________ (填“a”或“b”)。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气极易溶于水且水溶液显___________ 性。
(3)将前面收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子 、
、 夹好)。
夹好)。___________ 。
(4)NO2与水反应的化学方程式___________ ,其中氧化剂与还原剂的物质的量之比是___________ 。
(5)久置的浓HNO3呈黄色的原因是?用化学方程式解释___________ 。
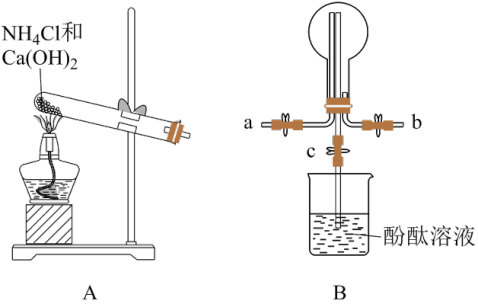
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气极易溶于水且水溶液显
(3)将前面收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子
 、
、 夹好)。
夹好)。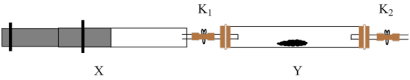
(4)NO2与水反应的化学方程式
(5)久置的浓HNO3呈黄色的原因是?用化学方程式解释
您最近一年使用:0次
名校
解题方法
2 . 用NaOH溶液清洗试管壁上的硫,发生反应S+NaOH→Na2SO3+Na2S+H2O(未配平),下列说法错误的是
| A.生成的Na2SO3和Na2S的物质的量之比为2:1 |
| B.也可以用CS2清洗试管壁上的硫 |
| C.该反应中硫单质既做氧化剂也做还原剂 |
| D.氧化产物是Na2SO3 |
您最近一年使用:0次
名校
解题方法
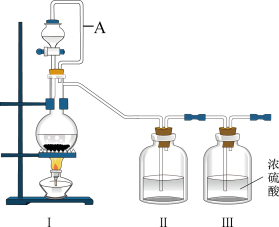
3 . 亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组同学拟用同一装置Ⅰ、Ⅱ、Ⅲ分别制备纯净干燥的NO和
_______ 。写出该装置制备氯气的离子方程式:_______ 。
(2)乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:________ 。
②装置连接顺序为a→________ (按气流自左向右方向,用小写字母表示)。
③装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为_______ 。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为______ 。
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00 mL,用c mol/L 溶液反应,消耗
溶液反应,消耗 溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为________ (用代数式表示即可)。
(1)甲组同学拟用同一装置Ⅰ、Ⅱ、Ⅲ分别制备纯净干燥的NO和

(2)乙组同学利用甲组制得的NO和
 制备NOCl,装置如图所示:
制备NOCl,装置如图所示: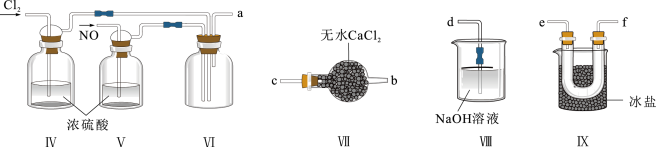
②装置连接顺序为a→
③装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为
(4)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00 mL,用c mol/L
 溶液反应,消耗
溶液反应,消耗 溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注。回答以下问题:
(1)与氮氧化物有关的全球性大气环境问题有_____。
(2)以下是氮循环的一部分: 的方法与其不同,写出实验室中固体物质加热制取氨气的化学方程式
的方法与其不同,写出实验室中固体物质加热制取氨气的化学方程式________ 。
②反应⑥的离子方程式是_______ 。
③催化剂存在下, 也可用来消除
也可用来消除 的污染,生成两种对环境无害的物质,请写出
的污染,生成两种对环境无害的物质,请写出 与
与 反应的化学方程式为
反应的化学方程式为_______ 。
Ⅱ.二氧化硫性质探究
(3)实验小组甲同学向:5 mL 1 mol⋅L
 溶液中通入足量的
溶液中通入足量的 ,检验该反应中产物含有
,检验该反应中产物含有 的方法是
的方法是_______ 。
(4)实验小组乙同学将 通入少量酸性
通入少量酸性 溶液,酸性
溶液,酸性 溶液褪色,请写出此反应的离子方程式:
溶液褪色,请写出此反应的离子方程式:_______ 。
Ⅲ.中华人民共和国国家标准规定葡萄酒中最大使用量为0.25 g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中,并对其含量进行定性测定。 全部逸出并与C中
全部逸出并与C中 完全反应,除去C中过量的
完全反应,除去C中过量的 ,然后用0.1 mol/L NaOH溶液进行反应,恰好反应时,消耗NaOH溶液25.00 mL,该葡萄酒中
,然后用0.1 mol/L NaOH溶液进行反应,恰好反应时,消耗NaOH溶液25.00 mL,该葡萄酒中 含量为
含量为_____ g/L。
(1)与氮氧化物有关的全球性大气环境问题有_____。
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
(2)以下是氮循环的一部分:
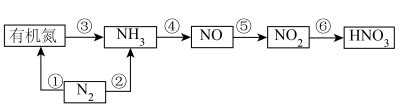
 的方法与其不同,写出实验室中固体物质加热制取氨气的化学方程式
的方法与其不同,写出实验室中固体物质加热制取氨气的化学方程式②反应⑥的离子方程式是
③催化剂存在下,
 也可用来消除
也可用来消除 的污染,生成两种对环境无害的物质,请写出
的污染,生成两种对环境无害的物质,请写出 与
与 反应的化学方程式为
反应的化学方程式为Ⅱ.二氧化硫性质探究
(3)实验小组甲同学向:5 mL 1 mol⋅L

 溶液中通入足量的
溶液中通入足量的 ,检验该反应中产物含有
,检验该反应中产物含有 的方法是
的方法是(4)实验小组乙同学将
 通入少量酸性
通入少量酸性 溶液,酸性
溶液,酸性 溶液褪色,请写出此反应的离子方程式:
溶液褪色,请写出此反应的离子方程式:Ⅲ.中华人民共和国国家标准规定葡萄酒中最大使用量为0.25 g/L。某兴趣小组用图丙装置(夹持装置略)收集某葡萄酒中,并对其含量进行定性测定。
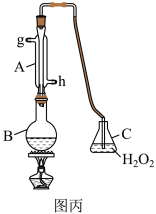
 全部逸出并与C中
全部逸出并与C中 完全反应,除去C中过量的
完全反应,除去C中过量的 ,然后用0.1 mol/L NaOH溶液进行反应,恰好反应时,消耗NaOH溶液25.00 mL,该葡萄酒中
,然后用0.1 mol/L NaOH溶液进行反应,恰好反应时,消耗NaOH溶液25.00 mL,该葡萄酒中 含量为
含量为
您最近一年使用:0次
名校
解题方法
5 . 人体必需的一些元素在周期表中的分布情况如下:___________ 。H2O2是一种绿色氧化剂,电子式为___________ 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为___________ 。
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为___________ 。
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是___________ 。

(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入NaOH溶液中,可以得到一种漂白液,上述反应的化学方程式为
(3)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为
(4)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是
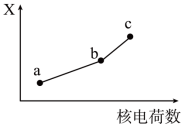
| A.若a、b、c表示氧族元素,则X表示对应氢化物的稳定性 |
| B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性 |
| C.若a、b、c表示第IA族元素,则X表示对应离子的氧化性 |
| D.若a、b、c表示第IIA族元素,则X表示最高价氧化物对应水化物的碱性 |
您最近一年使用:0次
名校
6 . 下表是某城市某日空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。

(1)A装置的作用是____________________ 。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成________ 色,说明SO2与水反应生成一种酸。
(3)D装置的作用是_____________ ,写出反应的化学方程式________________ 。
实验二:
(4)往盛有水的烧杯中通入SO2气体,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气最终氧化成(写化学式)________ 。
(5)查阅资料:SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作________________ 。
探究结论:SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(6)若将D中的溶液换成酸性Na2FeO4溶液,一会儿后发现溶液呈黄色,写出此时溶液中所发生的离子反应的方程式_____________ 。
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | Ⅱ | 良 |
实验一:用下图所示装置进行实验。

(1)A装置的作用是
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变成
(3)D装置的作用是
实验二:
(4)往盛有水的烧杯中通入SO2气体,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气最终氧化成(写化学式)
(5)查阅资料:SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作
探究结论:SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
(6)若将D中的溶液换成酸性Na2FeO4溶液,一会儿后发现溶液呈黄色,写出此时溶液中所发生的离子反应的方程式
您最近一年使用:0次
名校
解题方法
7 . 金属钛硬度大、熔点高、耐腐蚀,易被氧化,被誉为“未来金属”。以钛铁矿(主要成分 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为: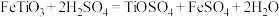 。已知
。已知 熔点为1850℃,回答下列问题:
熔点为1850℃,回答下列问题:
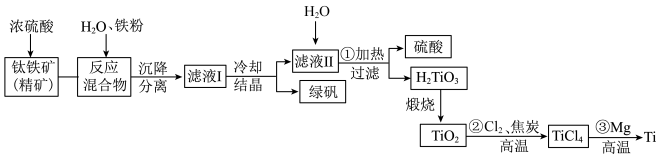
(1)生产时将钛铁矿精矿粉碎后再与浓硫酸反应,其目的是_______ ,钛酸亚铁( )中钛元素的化合价为
)中钛元素的化合价为_______ 价。
(2)滤液Ⅱ中主要物质是 ,反应①的化学方程式是
,反应①的化学方程式是_______ 。
(3)反应②生成 和一种可燃性气体,其化学反应方程式为
和一种可燃性气体,其化学反应方程式为_______ 。
(4)反应③需要在氩气氛围中进行,原因是_______ 。
(5)CO与 反应可制备
反应可制备 ,由
,由 和
和 构成的质子交换膜燃料电池总反应为
构成的质子交换膜燃料电池总反应为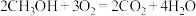 ,负极的电极反应式为
,负极的电极反应式为_______ 。若外电路中转移2mol电子,则上述燃料电池所消耗的 在标准状况下的体积为
在标准状况下的体积为_______ L
 ,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:
,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为: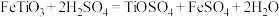 。已知
。已知 熔点为1850℃,回答下列问题:
熔点为1850℃,回答下列问题:
(1)生产时将钛铁矿精矿粉碎后再与浓硫酸反应,其目的是
 )中钛元素的化合价为
)中钛元素的化合价为(2)滤液Ⅱ中主要物质是
 ,反应①的化学方程式是
,反应①的化学方程式是(3)反应②生成
 和一种可燃性气体,其化学反应方程式为
和一种可燃性气体,其化学反应方程式为(4)反应③需要在氩气氛围中进行,原因是
(5)CO与
 反应可制备
反应可制备 ,由
,由 和
和 构成的质子交换膜燃料电池总反应为
构成的质子交换膜燃料电池总反应为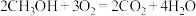 ,负极的电极反应式为
,负极的电极反应式为 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
名校
8 . 中国科学院科研团队研究表明,在常温、常压和可见光下,基于LDH(一种固体催化剂)合成 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是
 的原理示意图如图。下列说法错误的是
的原理示意图如图。下列说法错误的是
| A.氧化剂与还原剂的物质的量之比为3∶1 |
| B.该过程中涉及极性键和非极性键的断裂与生成 |
C.上述生成 的过程属于氮的固定 的过程属于氮的固定 |
| D.原料氮气可通过分离液态空气获得 |
您最近一年使用:0次
2024-04-05更新
|
198次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
9 . 钒的用途十分广泛,有金属“维生素”之称。以含钒石煤(主要成分是V2O3、V2O4,含有的杂质有SiO2、FeS2及Mg、Al、Mn等的化合物)制备单质钒的工艺流程如图所示。
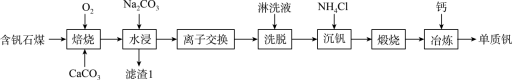
已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
②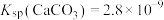 ,
,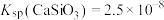 ,
,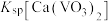 远大于
远大于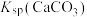 。
。
回答下列问题:
(1)基态Fe3+的价电子轨道表示式为______ 。
(2)“焙烧”时,V2O3、V2O4都转化为 ,写出
,写出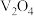 转化为
转化为 的化学方程式:
的化学方程式:____________ 。
(3)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有______ :“水浸”加入过量Na2CO3不能使CaSiO3完全转化为CaCO3,原因是______ 。(列式计算平衡常数分析该反应进行的趋势,一般认为,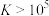 时反应进行较完全,
时反应进行较完全,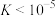 时反应难以进行)
时反应难以进行)
(4)“离子交换”与“洗脱”可表示为 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,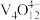 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用______ 。
(5)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是____________ 。
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是______(填字母)。

已知:①该工艺条件下,溶液中金属离子开始沉淀时和完全沉淀时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH | 1.9 | 7.0 | 3.0 | 8.1 |
完全沉淀时的pH | 3.2 | 9.0 | 4.7 | 10.1 |
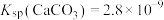 ,
,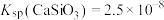 ,
,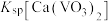 远大于
远大于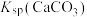 。
。回答下列问题:
(1)基态Fe3+的价电子轨道表示式为
(2)“焙烧”时,V2O3、V2O4都转化为
 ,写出
,写出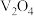 转化为
转化为 的化学方程式:
的化学方程式:(3)“水浸”加入Na2CO3调节溶液的pH为8.5,可完全除去的金属离子有
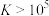 时反应进行较完全,
时反应进行较完全,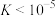 时反应难以进行)
时反应难以进行)(4)“离子交换”与“洗脱”可表示为
 (
( 为强碱性阴离子交换树脂,
为强碱性阴离子交换树脂,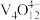 为
为 在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用
在水溶液中的实际存在形式),则“洗脱”过程中“淋洗液”最好选用(5)“沉钒”过程析出NH4VO3晶体,需要加入过量NH4Cl,目的是
(6)下列金属冶炼方法中,与本工艺流程中冶炼钒的方法相似的是______(填字母)。
| A.高炉炼铁 | B.电解熔融氯化钠制钠 |
| C.铝热反应制锰 | D.氧化汞分解制汞 |
您最近一年使用:0次
10 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和Na+内循环。工艺流程如图:
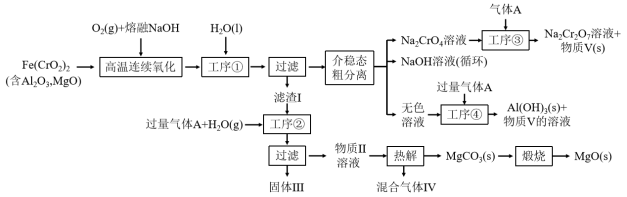
回答下列问题:
(1)高温连续氧化工序中被氧化的元素是_______ (填元素符号),Cr元素在元素周期表中的位置_______ ,
(2)滤渣I的主要成分是_______ (填化学式)。
(3)工序③中发生反应的离子方程式为_______ 。
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为_____ 。钠在火焰上灼烧产生的黄光是一种_______ (填“吸收光谱” 或“发射光谱”)。
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于10-5mol•L-1为沉淀完全;A1(OH)3+OH-⇌Al(OH) :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
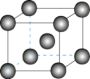
(6)基态Al原子的核外电子排布式为_______ 。Fe的晶胞结构如图所示,已知NA表示阿伏加德罗常数的值,若晶胞参数为a nm,则Fe晶胞的密度为_______ g•cm-3(用含NA和a的代数式表示)。

回答下列问题:
(1)高温连续氧化工序中被氧化的元素是
(2)滤渣I的主要成分是
(3)工序③中发生反应的离子方程式为
(4)物质V可代替高温连续氧化工序中的NaOH,此时发生的主要反应的化学方程式为
(5)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 :K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)
:K=100.63,Kw=10-14,Ksp[A1(OH)3]=10-33)(6)基态Al原子的核外电子排布式为

您最近一年使用:0次







