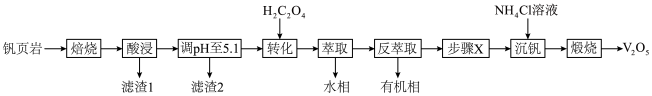
V有“工业味精”之称。工业上提取钒的工艺有多种,一种从钒页岩(一种主要含Si、Fe、Al、V元素的矿石)中提取V的工艺流程如下:
①“酸浸”时有VO 生成;
生成;
② 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为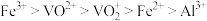 ;
;
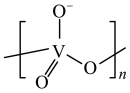
③VO 和
和 可以相互转化。
可以相互转化。
回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl- 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是____________________ 。
(2)“滤渣1”除掉的主要杂质元素是_______ (填元素符号)。
(3) 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是_____________ ,发生的离子反应方程式为_____________________ 。
(4)①“沉钒”时,生成 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入________ (填“氧化剂”或“还原剂”),写出“沉钒”时的离子反应方程式_______________________ 。
②以“沉钒率”( 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是_______________ 。 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为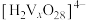 ,其中
,其中
________ 。 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是_____ 原子。
①“酸浸”时有VO
 生成;
生成;②
 在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为
在有机溶剂中的溶解度大于水,“萃取”时离子的萃取顺序为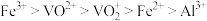 ;
;③VO
 和
和 可以相互转化。
可以相互转化。回答下列问题:
(1)“焙烧”时可添加适量“盐对”NaCl-
 与钒页岩形成混合物,这样做的目的是
与钒页岩形成混合物,这样做的目的是(2)“滤渣1”除掉的主要杂质元素是
(3)
 作用是将VO
作用是将VO 转化为
转化为 ,转化的目的是
,转化的目的是(4)①“沉钒”时,生成
 沉淀,“步骤X”应该加入
沉淀,“步骤X”应该加入②以“沉钒率”(
 沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是
沉淀中V的质量和钒页岩中钒的质量之比)表示钒的回收率如图所示,温度高于80℃时沉钒率下降的原因是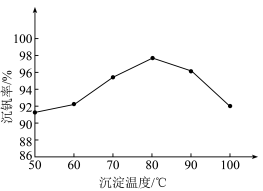
 可以溶解在NaOH溶液中,得到
可以溶解在NaOH溶液中,得到 ,
, 在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为
在不同的pH下可以得到不同聚合度的多钒酸盐,其阴离子呈如图所示的无限链状结构,其中一种酸式钒酸根离子可以表示为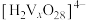 ,其中
,其中
 的立方晶胞如图所示,则在晶胞中,黑球代表的是
的立方晶胞如图所示,则在晶胞中,黑球代表的是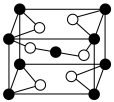
更新时间:2024-05-19 09:22:43
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】氧化铬(Cr2O3)可用作着色剂、催化剂、印刷纸币的油墨等。以含铬废料(含FeCr2O4、MgO、SiO2、Al2O3等)为原料制备氧化铬的一种流程如图所示。

已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Mg(OH)2]=2×10-11,溶液中离子浓度≤10-5mol·L-1时认为该离子沉淀完全。
回答下列问题:
(1)“研磨”的目的为___________ ;“焙烧”过程发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为___________ 。
(2)若滤液1中金属离子的浓度均为0.2mol·L-1,则“调pH”的最小值为___________ 。(保留两位有效数字)。
(3)“除镁”工序控制温度不能过高,且不能在陶瓷容器中进行的原因为___________ 。
(4)“转化”时加入适量H2SO4的作用为___________ 。
(5)部分物质的溶解度曲线如图所示。

①“系列操作”具体指___________ ,将所得滤液降温结晶、过滤、乙醚洗涤。
②降温结晶时控制的适宜温度为___________ (填选项字母)。
A.0~10℃ B.10~20℃ C.50~70℃ D.80℃以上
③用乙醚洗涤而不用乙醇洗涤的原因为___________ 。
(6)“煅烧”反应生成N2和水蒸气,该反应的化学方程式为___________ 。

已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Mg(OH)2]=2×10-11,溶液中离子浓度≤10-5mol·L-1时认为该离子沉淀完全。
回答下列问题:
(1)“研磨”的目的为
(2)若滤液1中金属离子的浓度均为0.2mol·L-1,则“调pH”的最小值为
(3)“除镁”工序控制温度不能过高,且不能在陶瓷容器中进行的原因为
(4)“转化”时加入适量H2SO4的作用为
(5)部分物质的溶解度曲线如图所示。

①“系列操作”具体指
②降温结晶时控制的适宜温度为
A.0~10℃ B.10~20℃ C.50~70℃ D.80℃以上
③用乙醚洗涤而不用乙醇洗涤的原因为
(6)“煅烧”反应生成N2和水蒸气,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
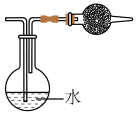
【推荐2】 为高效安全灭菌消毒剂之一,现用如下图所示装置制备
为高效安全灭菌消毒剂之一,现用如下图所示装置制备 ,并将其通入潮湿的
,并将其通入潮湿的 制备纯净的
制备纯净的 。
。
已知:① 沸点为3.8℃,受热易分解,高浓度时易爆炸。
沸点为3.8℃,受热易分解,高浓度时易爆炸。
② 为酸性氧化物,且极易溶于水。
为酸性氧化物,且极易溶于水。

请回答下列问题:
(1)装置C中试剂为_______ 。图中各装置连接顺序为:a→_______ →b→c→_______ →f。(填装置中的字母)
(2)实验中d口和空气的进气速率要适中,实验中通过观察装置C中_______ 控制气体流速;当e口出气量一定时,需控制d口进气量与空气进气量的比值为1∶3的原因是_______ 。
(3)装置B中的化学反应方程式为_______ 。
(4)若实验过程中至少需要3 L(标准状况) 与潮湿的
与潮湿的 反应,实际称取的
反应,实际称取的 固体质量必须适当多于理论量,其原因是
固体质量必须适当多于理论量,其原因是_______ 。(写出两点)
(5)将装置B生成的气体直接通入到下列装置可制得HClO溶液。取下列装置中黄绿色溶液两等份,一份是通过与足量KI溶液反应生成 ,来测定
,来测定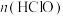 和
和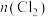 两者之和;另一份是把氯元素全部转化为AgCl,通过
两者之和;另一份是把氯元素全部转化为AgCl,通过 计算氯元素含量。实验结果表明
计算氯元素含量。实验结果表明 ,则黄绿色溶液中
,则黄绿色溶液中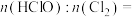
_______ 。(忽略 与水的反应)
与水的反应)
 为高效安全灭菌消毒剂之一,现用如下图所示装置制备
为高效安全灭菌消毒剂之一,现用如下图所示装置制备 ,并将其通入潮湿的
,并将其通入潮湿的 制备纯净的
制备纯净的 。
。已知:①
 沸点为3.8℃,受热易分解,高浓度时易爆炸。
沸点为3.8℃,受热易分解,高浓度时易爆炸。②
 为酸性氧化物,且极易溶于水。
为酸性氧化物,且极易溶于水。
请回答下列问题:
(1)装置C中试剂为
(2)实验中d口和空气的进气速率要适中,实验中通过观察装置C中
(3)装置B中的化学反应方程式为
(4)若实验过程中至少需要3 L(标准状况)
 与潮湿的
与潮湿的 反应,实际称取的
反应,实际称取的 固体质量必须适当多于理论量,其原因是
固体质量必须适当多于理论量,其原因是(5)将装置B生成的气体直接通入到下列装置可制得HClO溶液。取下列装置中黄绿色溶液两等份,一份是通过与足量KI溶液反应生成
 ,来测定
,来测定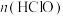 和
和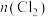 两者之和;另一份是把氯元素全部转化为AgCl,通过
两者之和;另一份是把氯元素全部转化为AgCl,通过 计算氯元素含量。实验结果表明
计算氯元素含量。实验结果表明 ,则黄绿色溶液中
,则黄绿色溶液中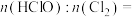
 与水的反应)
与水的反应)
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
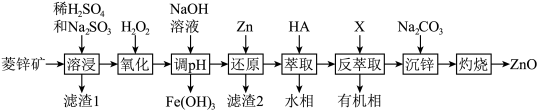
【推荐3】ZnO是一种难溶于水的白色固体,在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上由菱锌矿(主要成分为ZnCO3、ZnO,还含有少量Ni2O3、FeO、MgCO3、PbO2等杂质)制备ZnO的工艺流程如图所示:
②“溶浸”后的溶液所含金属离子主要有:Zn2+、Fe2+、Ni2+、Mg2+;
③氧化性顺序:Ni2+>Zn2+。
回答下列问题:
(1)基态Zn原子核外电子排布式为___________ 。
(2)滤渣1的化学式是___________ ,“溶浸”过程中Ni2O3发生反应的离子方程式是___________ 。
(3)已知“氧化”后溶液中c(Zn2+)=1.2mol·L-1,“调pH”的pH范围是___________ (保留两位有效数字)。(已知:溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是___________ 。
(4)有机萃取剂HA与ZnSO4反应的化学方程式为2HA+ZnSO4 ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是
ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是___________ 。
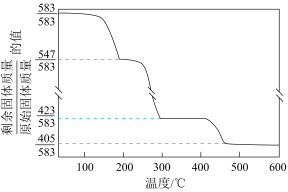
(5)在“沉锌”与“灼烧”之间进行的操作是___________ ,“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是___________ (填化学式)。
②“溶浸”后的溶液所含金属离子主要有:Zn2+、Fe2+、Ni2+、Mg2+;
③氧化性顺序:Ni2+>Zn2+。
回答下列问题:
(1)基态Zn原子核外电子排布式为
(2)滤渣1的化学式是
(3)已知“氧化”后溶液中c(Zn2+)=1.2mol·L-1,“调pH”的pH范围是
(4)有机萃取剂HA与ZnSO4反应的化学方程式为2HA+ZnSO4
 ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是
ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是(5)在“沉锌”与“灼烧”之间进行的操作是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐1】近年来我国大力加强温室气体CO2的转化研究,如催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。回答下列问题:
(1)已知:CO2(g)+H2(g)⇌H2O(g)+CO(g)ΔH1=+41.1kJ•mol﹣1
CO(g)+2H2(g)⇌CH3OH(g) ΔH2=﹣90.0kJ•mol﹣1
写出CO2催化氢化合成甲醇的热化学方程式_____ 。
(2)为提高CH3OH(g)的产率,理论上应采用的条件是_____ (填序号)。
a.高温高压
b.低温低压
c.高温低压
d.低温高压
(3)250℃时,在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[ ]时某反应物X的平衡转化率的变化曲线。反应物X是
]时某反应物X的平衡转化率的变化曲线。反应物X是 _____ (填“CO2”或“H2”)。

(4)催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
根据上表所给数据,用CO2生产甲醇的最优条件为 _____ (填实验编号)。
(5)一定条件下CO2能与N2发生反应:N2(g)+CO2(g)⇌C(s)+2NO(g)。某温度下,若向2L体积恒定的密闭容器中充入等物质的量的N2和CO2,其中N2、NO物质的量随时间变化的曲线如图所示:

①图中B点v正_____ v逆(填“>”“<”或“=”)。
②第10min时,外界改变的条件可能是_____ (填字母)。
A.加催化剂
B.增大C(s)的物质的量
C.减小CO2的物质的量
D.升温
E.降温
(1)已知:CO2(g)+H2(g)⇌H2O(g)+CO(g)ΔH1=+41.1kJ•mol﹣1
CO(g)+2H2(g)⇌CH3OH(g) ΔH2=﹣90.0kJ•mol﹣1
写出CO2催化氢化合成甲醇的热化学方程式
(2)为提高CH3OH(g)的产率,理论上应采用的条件是
a.高温高压
b.低温低压
c.高温低压
d.低温高压
(3)250℃时,在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),如图为不同投料比[
 ]时某反应物X的平衡转化率的变化曲线。反应物X是
]时某反应物X的平衡转化率的变化曲线。反应物X是 
(4)催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反应时间,得到如下四组实验数据:
实验编号 | 温度/K | 催化剂 | CO2的转化率/% | 甲醇的选择性/% |
A | 543 |
| 12.3 | 42.3 |
B | 543 |
| 11.9 | 72.7 |
C | 553 |
| 15.3 | 39.1 |
D | 553 |
| 12.0 | 70.6 |
(5)一定条件下CO2能与N2发生反应:N2(g)+CO2(g)⇌C(s)+2NO(g)。某温度下,若向2L体积恒定的密闭容器中充入等物质的量的N2和CO2,其中N2、NO物质的量随时间变化的曲线如图所示:

①图中B点v正
②第10min时,外界改变的条件可能是
A.加催化剂
B.增大C(s)的物质的量
C.减小CO2的物质的量
D.升温
E.降温
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐2】将甘油(C3H8O3)转化为高附值产品是当前热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得氢气,反应主要过程如下:
(1)下列说法正确的是______ (填字母序号)。
a.消耗等量的甘油,反应I的产氢率最高
b.消耗等量的甘油,反应II的放热最显著
c.经过计算得到反应III的∆H3=-237.5 kJ/mol,
d.理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应III设定在较高温度(600~700°C)进行,选择该温度范围的原因有:催化剂活性和选择性高、____________ 。
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:__________________ 。
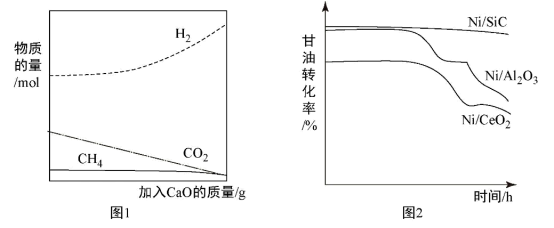
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:____________________ 。
(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是____________________ 。
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2 La2O2CO3
La2O2CO3
第二步为:______________________________ (写出化学反应方程式)。
| 甘油水蒸气重整(SPG) |  | 反应I |
| 甘油部分氧化(POG) | 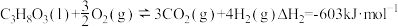 | 反应II |
| 甘油氧化水蒸气重整(OSPG) |  | 反应III |
(1)下列说法正确的是
a.消耗等量的甘油,反应I的产氢率最高
b.消耗等量的甘油,反应II的放热最显著
c.经过计算得到反应III的∆H3=-237.5 kJ/mol,
d.理论上,通过调控甘油、水蒸气、氧气的用量比例可以实现自热重整反应,即焓变约为0,这体现了科研工作者对吸热和放热反应的联合应用
(2)研究人员经过反复试验,实际生产中将反应III设定在较高温度(600~700°C)进行,选择该温度范围的原因有:催化剂活性和选择性高、
(3)研究人员发现,反应I的副产物很多,主要含有:CH4、C2H4、CO、CO2、CH3CHO、CH3COOH等,为了显著提高氢气的产率,采取以下两个措施。
①首要抑制产生甲烷的副反应。从原子利用率角度分析其原因:
②用CaO吸附增强制氢。如图1所示,请解释加入CaO的原因:

(4)制备高效的催化剂是这种制氢方法能大规模应用于工业的重要因素。通常将Ni分散在高比表面的载体(SiC、Al2O3、CeO2)上以提高催化效率。分别用三种催化剂进行实验,持续通入原料气,在一段时间内多次取样,绘制甘油转化率与时间的关系如图2所示。
①结合图2分析Ni/SiC催化剂具有的优点是
②研究发现造成催化效率随时间下降的主要原因是副反应产生的大量碳粉(积碳)包裹催化剂,通过加入微量的、可循环利用的氧化镧(La2O3)可有效减少积碳。其反应机理包括两步:
第一步为:La2O3+CO2
 La2O2CO3
La2O2CO3第二步为:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】2021年国务院政府工作报告指出,要做好碳达峰、碳中和各项工作,制定2030年前碳排放达峰行动方案。二氧化碳加氢制备甲醇既可以实现二氧化碳的资源化利用,又可以有效缓解温室效应问题。
已知:(I)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+40.9 kJ/mol
(II)CO(g)+2H2(g)=CH3OH(g) ΔH2=—90.3 kJ/mol
(Ⅲ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)ΔH3=___________ ;上述3个反应ΔS<0的有___________ (填反应序号)。
(2)提高反应(Ⅲ)平衡转化率的方法有___________ 。
(3)当反应压力2 MPa、原料气CO2和H2体积比1:3时,一定范围内温度对CO2转化率、CH3OH选择性、CH3OH产率的影响如下图所示。CH3OH产率在250℃时达到最大的主要原因是___________ 。

(4)在240℃、4MPa恒压条件下发生反应(Ⅲ),原料气体积组成为V(H2):V(CO2):V(N2)=3:1:1,平衡时CO2的转化率为50%,则CH3OH的压强为___________ ,反应(Ⅲ)的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,分压=总压x物质的量分数)。
(5)某温度下,反应(Ⅲ)在初期阶段的速率方程为r=k×p(CO2)×p3(H2)×(1—Kp)。其中:k为反应速率常数,随温度升高而增大,Kp为该反应的平衡常数。对于处于初期阶段的该反应,若增加CO2压强,则r___________ (填“增大”“不变”或“减小”,下同);若升高温度,则r___________ 。
已知:(I)CO2(g)+H2(g)=CO(g)+H2O(g) ΔH1=+40.9 kJ/mol
(II)CO(g)+2H2(g)=CH3OH(g) ΔH2=—90.3 kJ/mol
(Ⅲ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH3
(1)ΔH3=
(2)提高反应(Ⅲ)平衡转化率的方法有
(3)当反应压力2 MPa、原料气CO2和H2体积比1:3时,一定范围内温度对CO2转化率、CH3OH选择性、CH3OH产率的影响如下图所示。CH3OH产率在250℃时达到最大的主要原因是

(4)在240℃、4MPa恒压条件下发生反应(Ⅲ),原料气体积组成为V(H2):V(CO2):V(N2)=3:1:1,平衡时CO2的转化率为50%,则CH3OH的压强为
(5)某温度下,反应(Ⅲ)在初期阶段的速率方程为r=k×p(CO2)×p3(H2)×(1—Kp)。其中:k为反应速率常数,随温度升高而增大,Kp为该反应的平衡常数。对于处于初期阶段的该反应,若增加CO2压强,则r
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】锡是大名鼎鼎的“五金”——金、银、铜、铁、锡之一,早在远古时代,人们便发现并使用了锡。回答下列问题:
(1)锡是50号元素,在元素周期表中位于________ 区。
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为________ 。
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因____________________________________
(4)汽车废气中常含有有毒的一氧化碳气体,但在二氧化锡的催化下,在300 ℃时,一氧化碳可大部分转化为二氧化碳。C、O、Sn电负性由大至小的顺序是__________________________________________ 。
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为________ ,微粒之间存在的作用力是__________________________________ 。
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,___ ,___ )。锡的配位数为________ 。

②已知灰锡的晶胞参数a=0.648 9 nm,其密度为______ g·cm-3(NA为6.02×1023 mol-1,不必算出结果,写出简化后的计算式即可)。
(1)锡是50号元素,在元素周期表中位于
(2)SnO2是一种重要的半导体传感器材料,用来制备灵敏度高的气敏传感器,SnO2与熔融NaOH反应生成Na2SnO3,Na2SnO3中阴离子的空间构型为
(3)比较下列卤化锡的熔点和沸点,分析其变化规律及原因
| SnCl4 | SnBr4 | SnI4 | |
| 熔点/℃ | -33 | 31 | 144.5 |
| 沸点/℃ | 114.1 | 202 | 364 |
(5)灰锡具有金刚石型结构,其中Sn原子的杂化方式为
(6)①原子坐标参数,表示晶胞内部各原子的相对位置,如图为灰锡的晶胞,其中原子坐标参数A为(0,0,0),B为(1/2,0/1/2),则D为(1/4,

②已知灰锡的晶胞参数a=0.648 9 nm,其密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】【化学一选修3:物质结构与性质】由N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Ni原子的最外层电子排布式为_____________________ 。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。与上述化学方程式有关的叙述不正确的是_________。(填标号)
(3)1个(HB=NH)3分子中有__________ 个 键。
键。
(4)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。右图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置,__________ 。

(5)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________ ,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________ 。


(6)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为_________ g(用a、NA表示)
(1)基态Ni原子的最外层电子排布式为
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。与上述化学方程式有关的叙述不正确的是_________。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
 键。
键。(4)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是

(5)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为


(6)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】钙和铜合金可用作电解制钙的阴极电极材料,请回答下列问题:
(1)基态Cu的价电子排布式为________ 。
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成CaC2,CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。
①CaCO3中阴离子的空间构型为________ 。
②该气体分子M中σ键与π键的数目之比为________ 。
(3)工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因______ 。
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。

缩二脲分子中碳原子与氮原子的杂化类型分别为________ 、__________ 。
(5)一种钙铜合金的结构可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。




①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为_________ 。
②设阿伏加 德罗常数为NA,则该钙铜合金的密度是____ g/cm3(列出计算表达式)。
(1)基态Cu的价电子排布式为
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成CaC2,CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。
①CaCO3中阴离子的空间构型为
②该气体分子M中σ键与π键的数目之比为
(3)工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。

缩二脲分子中碳原子与氮原子的杂化类型分别为
(5)一种钙铜合金的结构可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。




①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为
②设阿伏加 德罗常数为NA,则该钙铜合金的密度是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐1】以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:

已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,且Al2O3+Na2CO3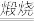 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为___________ 。
(2)滤渣2的成分为_____________ 。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是________________ 。
(4)根据有关国家标准,含CrO 的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO
的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO 的废水处理通常用以下方法:还原法:
的废水处理通常用以下方法:还原法: 。写出酸性条件下CrO
。写出酸性条件下CrO 与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:
与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:____________________________ 。

已知:铬铁矿在空气中与纯碱煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,且Al2O3+Na2CO3
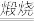 2NaAlO2+CO2↑。请回答:
2NaAlO2+CO2↑。请回答:(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为
(2)滤渣2的成分为
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是
(4)根据有关国家标准,含CrO
 的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO
的废水要经化学处理,使其浓度降至5.0×10-7 mol/L以下才能排放。含CrO 的废水处理通常用以下方法:还原法:
的废水处理通常用以下方法:还原法: 。写出酸性条件下CrO
。写出酸性条件下CrO 与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:
与绿矾(FeSO4.7H2O)在溶液中反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】钯是航天、航空等高科技领域以及汽车制造业不可缺少的关键材料。以硫化铜镍矿(主要含 、
、 ,还有少量的
,还有少量的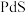 、
、 )制取钯、镍的工艺流程如下:
)制取钯、镍的工艺流程如下:

已知:“抽提”是用适当的溶剂和方法从原料中把有效成分分离出来的过程。
回答下列问题:
(1)“焙烧”需要鼓入空气使矿粉呈“沸腾”状,其目的是___________ 。
(2)“萃取铜”后的无机相中主要含有___________ (填化学式)、 。
。
(3)在实验室经过“结晶”过程获得硫酸铜晶体体的操作是___________ 、___________ 、___________ 、自然干燥。
(4)在“底渣”中加入王水(浓盐酸和浓硝酸的混合溶液)使金属 溶解生成
溶解生成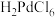 ,假设反应只产生一种污染空气的无色气体,该反应的化学方程式是
,假设反应只产生一种污染空气的无色气体,该反应的化学方程式是___________ 。该过程采用“抽提”的目的是___________ 。
(5)“抽提”后的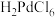 进行沉淀生成
进行沉淀生成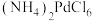 ,先加入氨后加入盐酸,先加入氨的原因是
,先加入氨后加入盐酸,先加入氨的原因是___________ 。
(6)“还原”反应中的氧化剂与还原剂的物质的量之比是___________ 。
 、
、 ,还有少量的
,还有少量的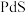 、
、 )制取钯、镍的工艺流程如下:
)制取钯、镍的工艺流程如下:
已知:“抽提”是用适当的溶剂和方法从原料中把有效成分分离出来的过程。
回答下列问题:
(1)“焙烧”需要鼓入空气使矿粉呈“沸腾”状,其目的是
(2)“萃取铜”后的无机相中主要含有
 。
。(3)在实验室经过“结晶”过程获得硫酸铜晶体体的操作是
(4)在“底渣”中加入王水(浓盐酸和浓硝酸的混合溶液)使金属
 溶解生成
溶解生成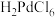 ,假设反应只产生一种污染空气的无色气体,该反应的化学方程式是
,假设反应只产生一种污染空气的无色气体,该反应的化学方程式是(5)“抽提”后的
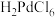 进行沉淀生成
进行沉淀生成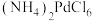 ,先加入氨后加入盐酸,先加入氨的原因是
,先加入氨后加入盐酸,先加入氨的原因是(6)“还原”反应中的氧化剂与还原剂的物质的量之比是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】七水合硫酸亚铁 在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为
在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为 、含少量
、含少量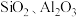 等杂质)制备
等杂质)制备 的一种流程如下:
的一种流程如下:

已知:
(1)“滤渣Ⅰ”的主要成分是___________ (填名称);“酸浸”前粉碎硫铁矿烧渣的目的是___________ 。
(2)“滤液Ⅰ”加入过量的 溶液,发生反应的离子方程式有
溶液,发生反应的离子方程式有___________ 、___________ 和___________ ,检验 离子沉淀完全的实验操作是
离子沉淀完全的实验操作是___________ 。
(3)“滤液Ⅱ”中主要的阴离子有___________ (填离子符号)。
(4)为得到纯净的产物,加入“试剂Ⅰ”是___________ (填序号,下同),“试剂Ⅱ”是___________ 。
① ②
② ③
③ ④
④
⑤ ⑥
⑥
(5)“滤液Ⅲ”经___________ 、___________ 、过滤、洗涤,得到 晶体。
晶体。
(6)某同学用酸性 测定某补血剂
测定某补血剂 中铁的含量:取
中铁的含量:取 补血药片,加硫酸酸化后,滴加
补血药片,加硫酸酸化后,滴加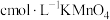 溶液
溶液 恰好完全反应(假定药片中其他成分与
恰好完全反应(假定药片中其他成分与 不反应),则该补血剂中铁元素的质量分数为
不反应),则该补血剂中铁元素的质量分数为___________  。
。
 在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为
在医学上常用作补血剂。工业上用硫铁矿烧渣(主要成分为 、含少量
、含少量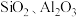 等杂质)制备
等杂质)制备 的一种流程如下:
的一种流程如下:
已知:

(1)“滤渣Ⅰ”的主要成分是
(2)“滤液Ⅰ”加入过量的
 溶液,发生反应的离子方程式有
溶液,发生反应的离子方程式有 离子沉淀完全的实验操作是
离子沉淀完全的实验操作是(3)“滤液Ⅱ”中主要的阴离子有
(4)为得到纯净的产物,加入“试剂Ⅰ”是
①
 ②
② ③
③ ④
④
⑤
 ⑥
⑥
(5)“滤液Ⅲ”经
 晶体。
晶体。(6)某同学用酸性
 测定某补血剂
测定某补血剂 中铁的含量:取
中铁的含量:取 补血药片,加硫酸酸化后,滴加
补血药片,加硫酸酸化后,滴加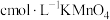 溶液
溶液 恰好完全反应(假定药片中其他成分与
恰好完全反应(假定药片中其他成分与 不反应),则该补血剂中铁元素的质量分数为
不反应),则该补血剂中铁元素的质量分数为 。
。
您最近一年使用:0次

 纳米棒
纳米棒

