【化学一选修3:物质结构与性质】由N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Ni原子的最外层电子排布式为_____________________ 。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。与上述化学方程式有关的叙述不正确的是_________。(填标号)
(3)1个(HB=NH)3分子中有__________ 个 键。
键。
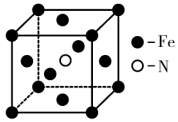
(4)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________ 。右图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置,__________ 。

(5)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________ ,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________ 。


(6)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为_________ g(用a、NA表示)
(1)基态Ni原子的最外层电子排布式为
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。与上述化学方程式有关的叙述不正确的是_________。(填标号)
| A.反应前后碳原子的轨道杂化类型不变 |
| B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形 |
| C.第一电离能:N>O>C>B |
| D.化合物A中存在配位键 |
 键。
键。(4)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是

(5)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为


(6)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为
更新时间:2016-12-09 14:34:49
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
【推荐1】铁、钴及其化合物在生活、生产中用途广泛。请回答下列问题:
(1)基态 的核外电子排布式为
的核外电子排布式为_______ ;第四周期元素中,基态原子未成对电子数与Co相等的有_______ (填元素符号)。
(2) 在氨水中能形成多种配合物。八面体配合物
在氨水中能形成多种配合物。八面体配合物 的结构有
的结构有_______ 种,其中极性分子有_______ 种;取 ,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为
,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为_______ 。
(3)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示,该反应的化学方程式为_______ 。
(4)钴蓝晶体的立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其结构如下图,晶体中 占据
占据 形成的
形成的_______ (填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为_______ g/cm3(列计算式)。

(1)基态
 的核外电子排布式为
的核外电子排布式为(2)
 在氨水中能形成多种配合物。八面体配合物
在氨水中能形成多种配合物。八面体配合物 的结构有
的结构有 ,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为
,加入足量硝酸银溶液,得到1mol白色沉淀。该物质在溶液中形成的配合离子化学式为(3)铁和氨在640℃时可发生置换反应,一种产物的晶胞结构如图所示,该反应的化学方程式为

(4)钴蓝晶体的立方晶胞由4个Ⅰ型和4个Ⅱ型小立方体构成,其结构如下图,晶体中
 占据
占据 形成的
形成的
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】(12分)锌是人体必需的微量元素之一,起着极其重要的作用,回答下列问题:
(1)请写出Zn2+的核外电子排布式_____________________ 。
(2)ZnCl2熔点为275 ℃,而CaCl2的熔点为782 ℃,请分析熔点不同的原因:_________ 。
(3)Zn2+能与多种微粒形成配合物,如Zn2+与CNO−可形成[Zn(CNO)4]2−,[Zn(CNO)4]2−中配位原子为__________ ,[Zn(CNO)4]2−的组成中非金属元素的电负性大小顺序为____________ ;Zn2+与CN−可形成[Zn(CN)4]2−,[Zn(CN)4]2−中σ键、π键和配位键的个数比为________ ;配合物Zn(NH3)4CO3中阴离子的空间构型为____________ ,N原子的杂化方式为____________ 。
(4)Zn与S所形成化合物的晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图:
①晶胞中S原子的配位数为_________ 。
②晶胞中最近的两个S原子之间的距离为_______ pm。
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是__________ g·cm−3(列出计算表达式)。
(1)请写出Zn2+的核外电子排布式
(2)ZnCl2熔点为275 ℃,而CaCl2的熔点为782 ℃,请分析熔点不同的原因:
(3)Zn2+能与多种微粒形成配合物,如Zn2+与CNO−可形成[Zn(CNO)4]2−,[Zn(CNO)4]2−中配位原子为
(4)Zn与S所形成化合物的晶胞如图1所示,图2为晶胞沿y轴的投影1∶1平面图:
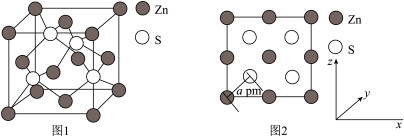
①晶胞中S原子的配位数为
②晶胞中最近的两个S原子之间的距离为
③设阿伏加 德罗常数的值为NA,则该晶胞的密度是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】科学家对多种过渡金属元素进行深入的研究,在新能源、新材料研发,医疗等领域应用广泛。回答下列问题:
(1)铜元素位于周期表中____ 区,画出Fe3+离子能量最高的能级的电子排布图____ 。
(2)CO可以形成Ni(CO)4、Fe(CO)5等多种配合物,在提纯金属方面应用广泛。与CO互为等电子体的一种阴离子和一种单质分子的化学式分别为____ 、____ ;CO分子中σ键和π键的个数比为____ ,试比较C、O与N的第一电离能的大小____ 。
(3)PtCl2(NH3)2有如图两种平行四边形结构:

研究表明,图a分子用于抗癌药物,在图a中用箭头标出配位键____ 。解释分子b不溶于水的原因:____ 。其中配体NH3中心原子的杂化方式为____ 。
(4)铜和氧形成的一种离子化合物(氧的化合价为-2)是良好的半导体材料。晶胞结构如图所示:

铜离子的电荷数为____ ,其配位数为____ ,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中a原子和b原子坐标分别为(0,0,0)、( ,
, ,
, ),则c原子分数坐标为
),则c原子分数坐标为____ ,若晶体密度为dg/cm3,设NA为阿伏加德罗常数的值,则晶胞中阴阳离子最短距离为____ nm(列出计算式即可)。
(1)铜元素位于周期表中
(2)CO可以形成Ni(CO)4、Fe(CO)5等多种配合物,在提纯金属方面应用广泛。与CO互为等电子体的一种阴离子和一种单质分子的化学式分别为
(3)PtCl2(NH3)2有如图两种平行四边形结构:

研究表明,图a分子用于抗癌药物,在图a中用箭头标出配位键
(4)铜和氧形成的一种离子化合物(氧的化合价为-2)是良好的半导体材料。晶胞结构如图所示:

铜离子的电荷数为
 ,
, ,
, ),则c原子分数坐标为
),则c原子分数坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】回答下列问题
(1)硼的研究在无机化学发展中占有独特的位置。硼元素有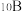 和
和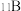 两种天然稳定的同位素,在基态
两种天然稳定的同位素,在基态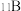 原子中,核外存在
原子中,核外存在___________ 对自旋相反的电子,有___________ 种不同空间运动状态的电子,根据对角线规则硼元素许多性质与___________ 元素相似。
(2) 能与硼元素的某种氢化物作用得到化合物
能与硼元素的某种氢化物作用得到化合物 ,
, 是一种新的储氢材料,加热
是一种新的储氢材料,加热 会缓慢释放出
会缓慢释放出 ,并转化为化合物
,并转化为化合物 ,
, 、
、 分别与乙烷、乙烯的结构相似
分别与乙烷、乙烯的结构相似 的结构式为
的结构式为___________ , 分子中的
分子中的 键和
键和 键数目之比为
键数目之比为___________ 。
(3) 和
和 两种元素是自然界最常见的两种元素。均能与
两种元素是自然界最常见的两种元素。均能与 形成
形成 和
和 ,结构如图甲所示。请说明
,结构如图甲所示。请说明 略大于
略大于 的原因:
的原因:___________ 。
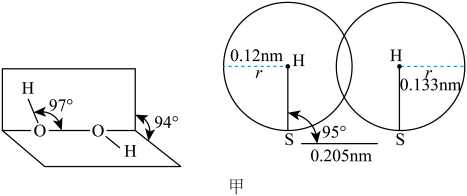
(4)图乙为DNA结构局部图。双链通过氢键使它们的碱基(A…T和C…G)相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式:___________ ;___________ 。
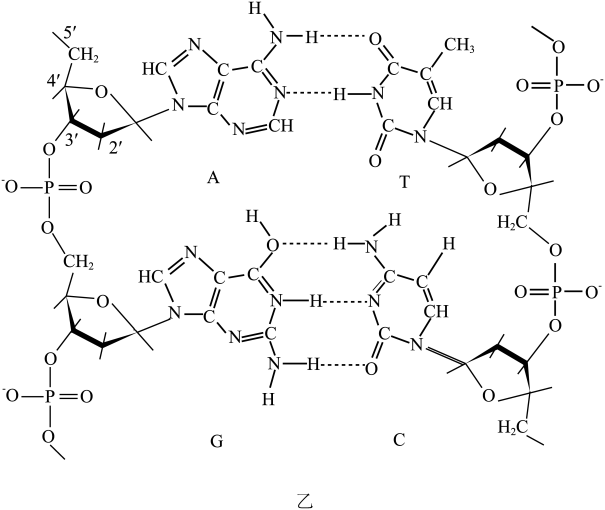
(5)如图表示碳、硅和磷元素的四级电离能变化趋势,其中表示碳的曲线是___________ (填标号)。
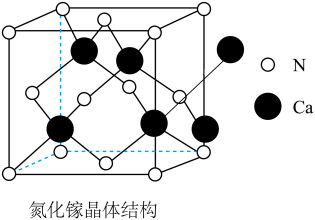
(6)氮化嫁(GaN)的晶体结构如图所示。晶体中N、Ga原子的轨道杂化类型分别为___________ 、___________ ,判断该晶体结构中存在配位键的依据是___________ 。
(1)硼的研究在无机化学发展中占有独特的位置。硼元素有
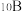 和
和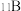 两种天然稳定的同位素,在基态
两种天然稳定的同位素,在基态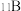 原子中,核外存在
原子中,核外存在(2)
 能与硼元素的某种氢化物作用得到化合物
能与硼元素的某种氢化物作用得到化合物 ,
, 是一种新的储氢材料,加热
是一种新的储氢材料,加热 会缓慢释放出
会缓慢释放出 ,并转化为化合物
,并转化为化合物 ,
, 、
、 分别与乙烷、乙烯的结构相似
分别与乙烷、乙烯的结构相似 的结构式为
的结构式为 分子中的
分子中的 键和
键和 键数目之比为
键数目之比为(3)
 和
和 两种元素是自然界最常见的两种元素。均能与
两种元素是自然界最常见的两种元素。均能与 形成
形成 和
和 ,结构如图甲所示。请说明
,结构如图甲所示。请说明 略大于
略大于 的原因:
的原因:
(4)图乙为DNA结构局部图。双链通过氢键使它们的碱基(A…T和C…G)相互配对形成双螺旋结构,请写出图中存在的两种氢键的表示式:

(5)如图表示碳、硅和磷元素的四级电离能变化趋势,其中表示碳的曲线是

(6)氮化嫁(GaN)的晶体结构如图所示。晶体中N、Ga原子的轨道杂化类型分别为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】卤族元素的单质及化合物性质丰富,在科研和生产中有许多重要用途。请回答:
(1)卤族元素位于元素周期表的___________ 区,其中电负性最大的是___________ (填元素符号),溴原子的M能层电子排布式为___________ 。
(2)基态氯原子核外有___________ 种运动状态不同的电子,其中单电子占据的轨道形状为___________ 。
(3)下列物质性质递变规律正确的是___________。
(4)碘在水中的溶解度小,在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2
 。
。 离子的空间构型为
离子的空间构型为___________ 。
(5)SiCl4发生水解的机理如图:
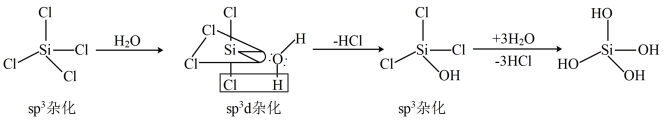
CCl4不能按照上述机理发生水解反应,原因是___________ 。
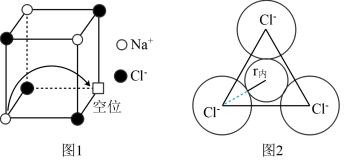
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确____________ 。(已知: ≈1.414,
≈1.414, ≈1.732)
≈1.732)
(1)卤族元素位于元素周期表的
(2)基态氯原子核外有
(3)下列物质性质递变规律正确的是___________。
| A.原子半径: F<C1<Br<I |
| B.第一电离能: F<Cl<Br<I |
| C.沸点:HCl<HBr<HI<HF |
| D.熔点: CaF2<CaCl2<CaBr2<CaI2 |

 。
。 离子的空间构型为
离子的空间构型为(5)SiCl4发生水解的机理如图:

CCl4不能按照上述机理发生水解反应,原因是
(6)有“点缺陷”的NaCl 晶体可导电,其结构如图1所示。有人认为:高温下有“点缺陷”的NaCl晶体能导电,是因为Na+经过一个由3个Cl-组成的最小三角形窗孔(如图2所示),迁移到另一空位而造成的。已知晶胞参数a=564pm,粒子半径r(Na+ )=115pm,r(Cl-)=l67pm,计算内切圆半径r内的值并判断该观点是否正确
 ≈1.414,
≈1.414, ≈1.732)
≈1.732)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】Ⅰ.立方氮化硼(BN)、立方金刚石、碳化硅(SiC)等都是莫氏硬度高的超硬材料,在工业上有广泛应用。
(1)C、N、O三种元素中第一电离能最大的是_____ ,电负性最大的是_____ 。
A.碳元素 B.氮元素 C.氧元素
(2)下列有关Si说法正确的有___________。
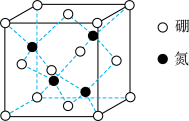
Ⅱ.立方氮化硼(BN)可由硼酸(H3BO3)和尿素[CO(NH2)2]反应制得,下图是立方氮化硼(BN)的晶胞示意图,立方金刚石、碳化硅(SiC)结构均与其相似,三者晶体中键长数据如下表。
(3)已知尿素[CO(NH2)2]结构中,碳、氮、氧原子均在同一平面,判断碳原子的杂化方式___________
(4)依据相关数据,比较上述三种晶体的莫氏硬度,并说明原因___________ 。
(5)立方氮化硼 (BN)晶胞中含有___________ 个硼原子,距离硼原子最近的氮原子有___________ 个。已知立方氮化硼晶体的密度为3.20g·cm−3,NA为阿伏加德罗常数,则该晶体晶胞边长的表达式为___________ cm。(用含NA的式子表达)已知:M(B) =10.8 g·mol−1,M(N) =14.0 g·mol−1
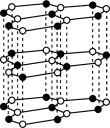
(6)六方氮化硼(BN)的结构与石墨相似,俗称“白石墨”,其结构如下图所示,若要区分某BN样品是六方氮化硼(BN)还是立方氮化硼(BN)下列方法可行的是___________。
(1)C、N、O三种元素中第一电离能最大的是
A.碳元素 B.氮元素 C.氧元素
(2)下列有关Si说法正确的有___________。
| A.基态Si原子核外有3种能量的电子 |
| B.Si原子由基态变为激发态时会释放能量 |
| C.基态Si原子的价层电子排布式为3p2 |
| D.Si在元素周期表中属于p区元素 |
Ⅱ.立方氮化硼(BN)可由硼酸(H3BO3)和尿素[CO(NH2)2]反应制得,下图是立方氮化硼(BN)的晶胞示意图,立方金刚石、碳化硅(SiC)结构均与其相似,三者晶体中键长数据如下表。

| 晶体 | 键长(pm) |
| 立方氮化硼(BN) | 157 |
| 立方金刚石 | 154 |
| 碳化硅(SiC) | 184 |
(3)已知尿素[CO(NH2)2]结构中,碳、氮、氧原子均在同一平面,判断碳原子的杂化方式
(4)依据相关数据,比较上述三种晶体的莫氏硬度,并说明原因
(5)立方氮化硼 (BN)晶胞中含有
(6)六方氮化硼(BN)的结构与石墨相似,俗称“白石墨”,其结构如下图所示,若要区分某BN样品是六方氮化硼(BN)还是立方氮化硼(BN)下列方法可行的是___________。

| A.晶体X射线衍射 | B.原子发射光谱 |
| C.质谱 | D.测定晶体的莫氏硬度 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】某课外活动小组以CuSO4·5H2O和氨水为原料制备[Cu(NH3)4]SO4·H2O并进行探究。
已知:CuSO4+4NH3·H2O= [Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]SO4=[Cu(NH3)4]2+ +SO
[Cu(NH3)4]2+ +4H+ =Cu2+ +4NH
(1)配制溶液:称取一定质量的CuSO4·5H2O晶体,放入锥形瓶中,溶解后滴加氨水。装置如图A所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色的[Cu(NH3)4]SO4溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:_______
(2)制备晶体:将A中溶液转移至B中,析出[Cu(NH3)4]SO4·H2O晶体;将B中混合物转移至C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是_______
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,应该在打开活塞的状态下,向漏斗中加入乙醇至浸没沉淀,原因是_______ 。
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和氨水的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是_______ (填序号)
A.盐酸 B.硝酸 C.硫酸 D.氢氧化钠溶液。
已知硫酸铵溶液高温易分解,回收乙醇的实验方法为_______
A.蒸馏 B.减压蒸馏 C.萃取 D.分液
(4)用沉淀法测定晶体中SO 的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。
的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。
(5)新制的氨水中含氮元素的微粒有3种:NH3、NH3·H2O和NH ,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH
,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH 对NH3·H2O电离平衡的影响结果:
对NH3·H2O电离平衡的影响结果:
①限制试剂与仪器:0.1mol/L氨水、NH4Cl、CH3COONH4、NH4HCO3、(NH4)2CO3、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案。表格中“_______”处需测定的物理量为_______
③表中物理量“m(铵盐)/g”的铵盐应是_______
④按实验序号2所拟数据进行实验,忽略水电离的OH-,则一水合氮的电离度(平衡转化率)为_______ 。
已知:CuSO4+4NH3·H2O= [Cu(NH3)4]SO4+4H2O
[Cu(NH3)4]SO4=[Cu(NH3)4]2+ +SO

[Cu(NH3)4]2+ +4H+ =Cu2+ +4NH

(1)配制溶液:称取一定质量的CuSO4·5H2O晶体,放入锥形瓶中,溶解后滴加氨水。装置如图A所示(胶头滴管中吸有氨水)。

滴加氨水时,有浅蓝色沉淀Cu2(OH)2SO4生成;继续滴加氨水,沉淀消失,得到深蓝色的[Cu(NH3)4]SO4溶液。用离子方程式表示由浅蓝色沉淀得到深蓝色溶液的原理:
(2)制备晶体:将A中溶液转移至B中,析出[Cu(NH3)4]SO4·H2O晶体;将B中混合物转移至C的漏斗中,减压过滤,用乙醇洗涤晶体2~3次;取出晶体,冷风吹干。
①晶体不采用加热烘干的原因是
②减压过滤时,抽气泵处于工作状态,活塞需关闭,使装置内产生负压。洗涤晶体时,应该在打开活塞的状态下,向漏斗中加入乙醇至浸没沉淀,原因是
(3)废液回收:从含有[Cu(NH3)4]SO4、乙醇和氨水的废液中回收乙醇并获得CuSO4和(NH4)2SO4的混合溶液,应加入的试剂是
A.盐酸 B.硝酸 C.硫酸 D.氢氧化钠溶液。
已知硫酸铵溶液高温易分解,回收乙醇的实验方法为
A.蒸馏 B.减压蒸馏 C.萃取 D.分液
(4)用沉淀法测定晶体中SO
 的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。
的含量。称取一定质量的[Cu(NH3)4]SO4·H2O晶体,加适量蒸馏水溶解,向其中滴加足量BaCl2溶液,搅拌,加热一段时间,过滤,洗涤,烘干,灼烧,称量沉淀的质量。下列有关说法正确的有_______。| A.滴加足量BaCl2溶液能降低实验数值偏低的可能性 |
| B.检验沉淀已经洗净的方法为取少量最后一次洗涤液于试管中,向其中加入BaCl2溶液,无白色沉淀生成,证明沉淀已洗净 |
| C.洗涤后滤纸和固体一起灼烧,以免固体附着在滤纸上,造成损失。 |
| D.已知[Cu(NH3)4]2+ 为平面四边形结构,中心Cu2+不可能是sp3杂化 |
 ,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH
,其中NH3·H2O电离平衡受多种因素的影响。设计实验,控制变量,仅探究NH 对NH3·H2O电离平衡的影响结果:
对NH3·H2O电离平衡的影响结果:①限制试剂与仪器:0.1mol/L氨水、NH4Cl、CH3COONH4、NH4HCO3、(NH4)2CO3、量筒、烧杯、玻璃棒、药匙、天平、pH计、恒温水浴槽(可控制温度)。
②设计实验方案,拟定实验表格,完整体现实验方案。表格中“_______”处需测定的物理量为
| 物理量 实验序号 | V(0.1mol/L氨水)/mL | m(铵盐)/g | t/℃ | _______ |
| 1 | 100 | 0 | 25 | b |
| 2 | 100 | a | 25 | c |
④按实验序号2所拟数据进行实验,忽略水电离的OH-,则一水合氮的电离度(平衡转化率)为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】以银精矿(主要成分为Ag2S)为原料采用“预氧化湿法提银”工艺流程如下:
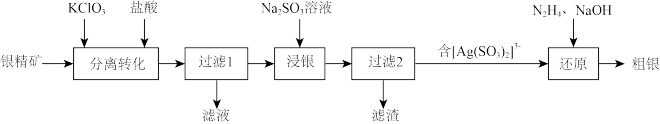
(1) N2H4中氮原子的杂化方式为___ ,N原子核外有____ 种不同的运动状态的电子。
(2)“分离转化”时,加入KClO3的目的是___ ;若不加KClO3,直接加氯化物,依据反应Ag2S+2Cl-⇌2AgCl+S2-,____ (填“能、不能”)实现其较完全转化,并说明理由:___ (已知:Ksp(Ag2S)=1.6×10-49,Ksp(AgCl)=2.0×10-10)。为提高Ag2S的转化率可采取的措施是_____ (列举2条)。
(3)“浸银”时,发生反应的离子方程式为____ 。
(4)“还原”时,2[Ag(SO3)2]3-+N2H4+2OH-=2Ag↓+4SO +N2↑+H2↑+2H2O,该反应中每有1mol N-H断裂时,该反应转移电子的物质的量为
+N2↑+H2↑+2H2O,该反应中每有1mol N-H断裂时,该反应转移电子的物质的量为____ mol。

(1) N2H4中氮原子的杂化方式为
(2)“分离转化”时,加入KClO3的目的是
(3)“浸银”时,发生反应的离子方程式为
(4)“还原”时,2[Ag(SO3)2]3-+N2H4+2OH-=2Ag↓+4SO
 +N2↑+H2↑+2H2O,该反应中每有1mol N-H断裂时,该反应转移电子的物质的量为
+N2↑+H2↑+2H2O,该反应中每有1mol N-H断裂时,该反应转移电子的物质的量为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】铜的配合物在自然界中广泛存在,请回答下列问题:
(1)基态29Cu的核外电子排布式为_______ 。
(2)硫酸铜溶液中存在多种微粒:
①硫酸铜溶液呈蓝色的原因是其中存在配离子_______ (填化学式),配体中提供孤电子对的原子是_______ (填元素符号)。
②用价电子对互斥理论对以下微粒的空间构型进行分析,完成下表:
③H2O、 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为_______ 、_______ 。
(3)同学甲设计如下制备铜的配合物的实验:

已知:铜离子的配位数通常为4。
①结合化学平衡原理原理解释试管c中浑浊液转变为深蓝色溶液的原因_______ 。
②由上述实验可得出以下结论:
结论1:配合物的形成与_______ 、_______ 有关;
结论2:结合上述实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:_______ >_______ (填化学式)。
(1)基态29Cu的核外电子排布式为
(2)硫酸铜溶液中存在多种微粒:
①硫酸铜溶液呈蓝色的原因是其中存在配离子
②用价电子对互斥理论对以下微粒的空间构型进行分析,完成下表:
| 微粒 | 中心原子上的孤电子对数 | 中心原子上的价电子对总数 | 价电子对互斥理论(VSEPR)模型名称 | 分子或离子空间结构名称 |
| H2O | ||||
 |
 中心原子的杂化轨道类型分别为
中心原子的杂化轨道类型分别为(3)同学甲设计如下制备铜的配合物的实验:

已知:铜离子的配位数通常为4。
①结合化学平衡原理原理解释试管c中浑浊液转变为深蓝色溶液的原因
②由上述实验可得出以下结论:
结论1:配合物的形成与
结论2:结合上述实验,试管b、c中深蓝色配离子的稳定性强弱顺序为:
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】世界上最早发现并使用锌的是中国,明朝末年《天工开物》一书中有关于炼锌技术的记载。回答下列问题:
(1)Zn在元素周期表中位于______ 区。
(2)硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。
① 中,中心原子轨道的杂化类型为
中,中心原子轨道的杂化类型为______ 。
②NH3极易溶于水,除了因为它们都是极性分子外,还因为______ 。
(3)Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为______ 。
(4)氧化锌的结构有多种其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加 德罗常数的值,则立方闪锌矿晶体的密度为______ (列出计算式即可)g•cm-3。

(1)Zn在元素周期表中位于
(2)硫酸锌溶于过量的氨水可形成配合物[Zn(NH3)4]SO4。
①
 中,中心原子轨道的杂化类型为
中,中心原子轨道的杂化类型为②NH3极易溶于水,除了因为它们都是极性分子外,还因为
(3)Zn2+的4s和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2-的空间构型为
(4)氧化锌的结构有多种其中一种立方闪锌矿的结构如图所示,若该晶胞的边长为anm,NA为阿伏加 德罗常数的值,则立方闪锌矿晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
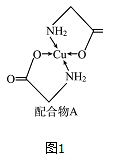
【推荐2】已知铜的配合物A结构如图图1。请回答下列问题:
(1)写出基态Cu的外围电子排布式________
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和x键数目之比是___ ;N2O与CO2互为等电子体,则N2O的电子式为_______ 。
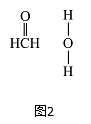
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醇分子中HCO的键角____ (选填“大于”、“等于”或“小于”) l20°;甲醛能与水形成氢键,请在如图2中表示出来____ 。
(4)立方氮化硼如图3、图4与金刚石结构相似,是超硬材料。立方氮化硼晶体内B一N键数与硼原子数之比为__________ ;
(5)Cu晶体的堆积方式如图5所示,设Cu原子半径为a,晶体中Cu原子的配位数为_____ ,晶体的空间利用率为_________ 。(已知: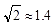 ,列式并计算出结果)
,列式并计算出结果)
(1)写出基态Cu的外围电子排布式
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和x键数目之比是
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醇分子中HCO的键角
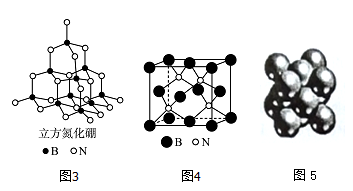
(4)立方氮化硼如图3、图4与金刚石结构相似,是超硬材料。立方氮化硼晶体内B一N键数与硼原子数之比为
(5)Cu晶体的堆积方式如图5所示,设Cu原子半径为a,晶体中Cu原子的配位数为
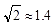 ,列式并计算出结果)
,列式并计算出结果)
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】回答下列问题:
(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆( )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。
)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。
①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用 。表示与之相反的用
。表示与之相反的用 表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为_______ 。
②Cd与Zn同族,价电子数相同,若配离子 的中心离子价电子数与配体提供的电子数之和为18,则x=
的中心离子价电子数与配体提供的电子数之和为18,则x=_______ 。
③碲和硫同主族,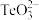 的空间构型为
的空间构型为_______ 。
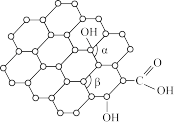
(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角
_______ (填“>”、“<”或=”)键角 ,原因是:
,原因是:_______ 。
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的_______ (填“四面体”、“八面体”或“立方体)空隙中。若晶胞边长为apmB原子半径为bpm,N原子半径为cpm,则该晶胞的空间利用率为:_______ (列出计算式)。

(1)据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(
 )和砷化镉(
)和砷化镉( )为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。
)为材料验证了三维量子霍尔效应,并发现了金属—绝缘体的转换。①原子中运动的电子有两种相反的自旋状态,若一种自旋状态用
 。表示与之相反的用
。表示与之相反的用 表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数。对于基态的砷原子,其价电子自旋磁量子数的代数和为②Cd与Zn同族,价电子数相同,若配离子
 的中心离子价电子数与配体提供的电子数之和为18,则x=
的中心离子价电子数与配体提供的电子数之和为18,则x=③碲和硫同主族,
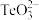 的空间构型为
的空间构型为(2)石墨烯是一种二维碳纳米材料,具有优异的光学、力学、电学特性,在材料学、微纳加工、能源、生物医学和药物传递方面具有重要应用前景。石墨烯中部分碳原子被氧化后,其平面结构将发生改变,转化为氧化石墨烯(如图),氧化石墨烯中键角

 ,原因是:
,原因是:
(3)立方氮化硼晶体的结构和硬度都与金刚石相似,晶胞结构如图所示,B原子填在由N原子构成的

您最近一年使用:0次



