钙和铜合金可用作电解制钙的阴极电极材料,请回答下列问题:
(1)基态Cu的价电子排布式为________ 。
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成CaC2,CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。
①CaCO3中阴离子的空间构型为________ 。
②该气体分子M中σ键与π键的数目之比为________ 。
(3)工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因______ 。
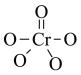
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。

缩二脲分子中碳原子与氮原子的杂化类型分别为________ 、__________ 。
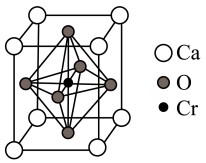
(5)一种钙铜合金的结构可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。




①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为_________ 。
②设阿伏加 德罗常数为NA,则该钙铜合金的密度是____ g/cm3(列出计算表达式)。
(1)基态Cu的价电子排布式为
(2)CaCO3高温分解可制得CaO。CaO与C在一定条件下可生成CaC2,CaC2与水反应生成Ca(OH)2和一种四原子气体分子M。
①CaCO3中阴离子的空间构型为
②该气体分子M中σ键与π键的数目之比为
(3)工业上电解CaCl2制Ca而不用CaO,请从结构角度解释原因
(4)在碱性溶液中,缩二脲HN(CONH2)2与CuSO4反应得到一种特征紫色物质,其结构如图所示,该反应原理可用于检验蛋白质或其他含肽键的化合物。

缩二脲分子中碳原子与氮原子的杂化类型分别为
(5)一种钙铜合金的结构可看作图a、b两种原子层交替堆积排列而成c,其晶胞如图d。a图中Ca-Ca间距离为x pm,c图中Ca-Ca间距离距离为ypm。




①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为
②设阿伏加 德罗常数为NA,则该钙铜合金的密度是
更新时间:2020-08-11 11:20:28
|
相似题推荐
【推荐1】如图所示为PTC元件(热敏电阻)的主要成分——钡钛矿晶体结构,该结构是具有代表性的最小重复单位。该晶体经X射线分析鉴定,重复单位为正方体,边长a=403.1pm,顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占。

(1)写出晶体的化学式_______________ ,
(2)若将Ti4+置于晶胞的体心,Ba2+置于晶胞的顶点,则O2-处于立方体的什么位置?_____________ ,
(3)在该物质的晶体中,每个Ti4+周围与它最邻近的且距离相等的Ti4+在空间呈什么形状分布?____________________
(4)已知O2-半径为140pm,计算Ba2+半径______________ 。

(1)写出晶体的化学式
(2)若将Ti4+置于晶胞的体心,Ba2+置于晶胞的顶点,则O2-处于立方体的什么位置?
(3)在该物质的晶体中,每个Ti4+周围与它最邻近的且距离相等的Ti4+在空间呈什么形状分布?
(4)已知O2-半径为140pm,计算Ba2+半径
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】K2Cr2O7是一种常见的强氧化剂,酸性条件下会被还原剂还原成Cr3+。
(1)Cr3+能与OH-、CN-形成配合物[Cr(OH)4]-、[Cr(CN)6]3-。
①Cr3+的电子排布式可表示为________ 。
②不考虑空间构型,[Cr(OH)4]-的结构可用示意图表示为________ 。(若有配位键,用箭号表示)
③CN-与N2互为等电子体,写出CN-的电子式:________ 。
(2)K2Cr2O7能将乙醇氧化为乙醛,直至乙酸。
①乙醛中碳原子的杂化方式有________ 、________ 。
②乙酸的沸点是117.9 ℃,甲酸甲酯的沸点是31.5 ℃,乙酸的沸点高于甲酸甲酯的沸点的主要原因是____ 。
(3)一种新型阳极材料LaCrO3的晶胞如图所示,已知距离每个Cr原子最近的原子有6个,则图中________ 原子代表的是Cr原子。

(1)Cr3+能与OH-、CN-形成配合物[Cr(OH)4]-、[Cr(CN)6]3-。
①Cr3+的电子排布式可表示为
②不考虑空间构型,[Cr(OH)4]-的结构可用示意图表示为
③CN-与N2互为等电子体,写出CN-的电子式:
(2)K2Cr2O7能将乙醇氧化为乙醛,直至乙酸。
①乙醛中碳原子的杂化方式有
②乙酸的沸点是117.9 ℃,甲酸甲酯的沸点是31.5 ℃,乙酸的沸点高于甲酸甲酯的沸点的主要原因是
(3)一种新型阳极材料LaCrO3的晶胞如图所示,已知距离每个Cr原子最近的原子有6个,则图中

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】我国科学家研究发现AgCrS2(AMX2家族成员之一,A为一价金属,M为三价金属,X为氧族元素)在室温下具有超离子行为。回答下列问题:
(1)基态铬原子M层的电子排布式为_______ ;基态硫原子核外电子中含有_______ 个未成对电子。
(2)同周期元素Si、P、S的电负性由大到小的顺序为_______ (用元素符号表示),O、S为同主族元素,H2O的键角比H2S大的原因是_______ 。
(3)硫元素能形成多种微粒如H2S、SO2、SO3、SO 、SO
、SO 等。SO2的立体构型为
等。SO2的立体构型为_______ ,SO3的中心原子的价层电子对数为_______ 。
(4)CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为_______ (填标号)。
(5)某含铬化合物立方晶胞如图所示。该晶体的化学式为_______ ;与Cr最近的氧原子的个数为_______ ;Ca和Cr的最近距离为anm,设NA为阿伏加德罗常数的值,则该晶体密度为_______ (填含a、NA的表达式)g•cm-3。
(1)基态铬原子M层的电子排布式为
(2)同周期元素Si、P、S的电负性由大到小的顺序为
(3)硫元素能形成多种微粒如H2S、SO2、SO3、SO
 、SO
、SO 等。SO2的立体构型为
等。SO2的立体构型为(4)CrO5中Cr元素化合价为+6价,常温下呈蓝色,则其结构式可能为
 |  |  |
| A | B | C |

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
真题
解题方法
【推荐1】含Cu、Zn、Sn及S的四元半导体化合物(简写为CZTS),是一种低价、无污染的绿色环保型光伏材料,可应用于薄膜太阳能电池领域。回答下列问题:
(1)基态S原子的价电子中,两种自旋状态的电子数之比为_____ 。
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是____ ,原因是_____ 。
(3)SnCl 的几何构型为
的几何构型为____ ,其中心离子杂化方式为____ 。
(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是____ (填标号)。
(5)如图是硫的四种含氧酸根的结构:
A. B.
B. 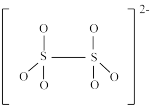 C.
C.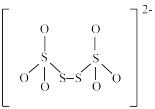 D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO 的是
的是____ (填标号),理由是____ 。
(6)如图是CZTS四元半导体化合物的四方晶胞。
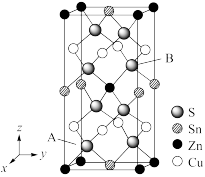
①该物质的化学式为_____ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为( ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为_____ 。
(1)基态S原子的价电子中,两种自旋状态的电子数之比为
(2)Cu与Zn相比,第二电离能与第一电离能差值更大的是
(3)SnCl
 的几何构型为
的几何构型为(4)将含有未成对电子的物质置于外磁场中,会使磁场强度增大,称其为顺磁性物质。下列物质中,属于顺磁性物质的是
| A.[Cu(NH3)2]Cl | B.[Cu(NH3)4]SO4 | C.[Zn(NH3)4]SO4 | D.Na2[Zn(OH)4] |
A.
 B.
B.  C.
C. D.
D.
根据组成和结构推断,能在酸性溶液中将Mn2+转化为MnO
 的是
的是(6)如图是CZTS四元半导体化合物的四方晶胞。

①该物质的化学式为
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中A原子的坐标为(
 ,
, ,
, ),则B原子的坐标为
),则B原子的坐标为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。回答以下问题:
(1)基态N其核外有____ 种不同运动状态的电子。
(2)在高压下氮气会发生聚合得到高聚氮。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。高聚氮的晶体类型是____ 。
(3)类似于碳元素,氮元素也可以和氢元素形成一系列氢化物,N2H4、N2H2等,其中N2H4中心原子杂化方式为____ ,是____ 分子(填“极性”或“非极性”)
(4)氨气分子中有一对孤电子对,能够结合氢离子表现碱性,则NF3碱性____ NH3碱性(填“大于”、“等于”或“小于”),其原因是____ 。
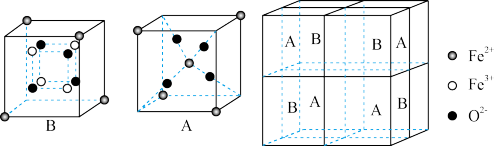
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比是_____ (填最简整数比);已知该晶体的晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体的密度是____ g cm-3(用含a和NA的代数式表示)。
cm-3(用含a和NA的代数式表示)。
(1)基态N其核外有
(2)在高压下氮气会发生聚合得到高聚氮。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。高聚氮的晶体类型是
(3)类似于碳元素,氮元素也可以和氢元素形成一系列氢化物,N2H4、N2H2等,其中N2H4中心原子杂化方式为
(4)氨气分子中有一对孤电子对,能够结合氢离子表现碱性,则NF3碱性
(5)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比是
 cm-3(用含a和NA的代数式表示)。
cm-3(用含a和NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】钙钛矿是指通式为 的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
Ⅰ.最早发现的钙钛矿石中含 的立方晶胞如图1所示。
的立方晶胞如图1所示。
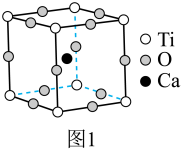
(1)基态 原子的价层电子排布式为
原子的价层电子排布式为___________ , 中组成元素的电负性大小顺序是
中组成元素的电负性大小顺序是___________ 。
(2)金属离子与氧离子之间的化学键为___________ 。
(3)晶胞中与 距离最近且相等的
距离最近且相等的 数目为
数目为___________ 。
Ⅱ.一种立方钙钛矿结构的金属卤化物光电材料的组成为 、
、 和有机碱离子
和有机碱离子 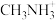 ,其晶胞如图2所示。
,其晶胞如图2所示。
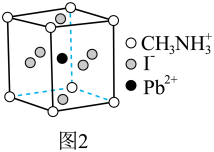
(4)图1中与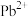 具有相同的空间位置的微粒是
具有相同的空间位置的微粒是
(5)有机碱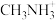 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是___________ 。
(6)若晶胞参数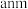 ,则晶体密度为
,则晶体密度为___________ 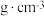 (用
(用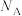 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。
用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕 盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
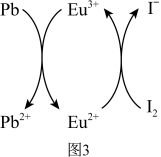
(7)用离子方程式表示该原理___________ 、___________ 。
 的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。
的一类化合物,钙钛矿型化合物可用于生产太阳能电池、传感器、固体电阻器等功能材料。Ⅰ.最早发现的钙钛矿石中含
 的立方晶胞如图1所示。
的立方晶胞如图1所示。
(1)基态
 原子的价层电子排布式为
原子的价层电子排布式为 中组成元素的电负性大小顺序是
中组成元素的电负性大小顺序是(2)金属离子与氧离子之间的化学键为
(3)晶胞中与
 距离最近且相等的
距离最近且相等的 数目为
数目为Ⅱ.一种立方钙钛矿结构的金属卤化物光电材料的组成为
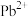 、
、 和有机碱离子
和有机碱离子 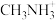 ,其晶胞如图2所示。
,其晶胞如图2所示。
(4)图1中与
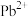 具有相同的空间位置的微粒是
具有相同的空间位置的微粒是A. | B.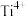 | C. | D.无 |
(5)有机碱
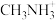 中,
中, 原子的杂化轨道类型是
原子的杂化轨道类型是(6)若晶胞参数
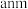 ,则晶体密度为
,则晶体密度为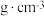 (用
(用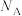 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕
 盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
盐,提升了太阳能电池的效率和使用寿命,其作用原理如图所示。
(7)用离子方程式表示该原理
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】碳元素在无机物和有机物中均充当了重要的角色,请回答下列问题:
(1)基态碳原子的价层电子排布图(轨道表达式)为__ ,其电子占据的能量最高的原子轨道的形状为__ ;C、N、O三种元素第一电离能最大的是__ 。
(2)有机物 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为__ ,分子中两种碳碳单键长的大小关系为①__ ②(填“>”、“<”或“=”)。
(3) 和
和 均可以形成氢键,则沸点较高的是
均可以形成氢键,则沸点较高的是__ ,原因是__ 。
(4)石墨的结构及晶胞如图一所示,则石墨的密度为__ g·cm-3(用含a、d、NA的表达式表示)。A的原子坐标为( 、
、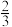 、0),则B的原子坐标为
、0),则B的原子坐标为__ 。

(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,如图二所示,则x=__ 。
(1)基态碳原子的价层电子排布图(轨道表达式)为
(2)有机物
 中碳原子的轨道杂化类型为
中碳原子的轨道杂化类型为(3)
 和
和 均可以形成氢键,则沸点较高的是
均可以形成氢键,则沸点较高的是(4)石墨的结构及晶胞如图一所示,则石墨的密度为
 、
、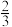 、0),则B的原子坐标为
、0),则B的原子坐标为
(5)石墨能与熔融的金属K作用,形成一种青铜色的化合物CxK,如图二所示,则x=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】工业废水中的亚硝酸盐常常需要处理。回答下列问题:
(1)尿素( )可将
)可将 还原为
还原为 。在尿素分子所含的原子中,第一电离能最大的是
。在尿素分子所含的原子中,第一电离能最大的是_____________ ,其中原子半径最大者的电子排布式为_____________ 。
(2) 离子的空间构型为
离子的空间构型为_______________ ,写出一个 离子的等电子体
离子的等电子体_____________ 。从分子结构角度, 酸性弱于
酸性弱于 的原因是
的原因是____________ 。
(3)尿素中所有原子共平面,据此推断其中 原子的杂化轨道类型为
原子的杂化轨道类型为_____________ 。尿素晶体的熔点为 ,比相同摩尔质量的乙酸熔点(
,比相同摩尔质量的乙酸熔点(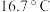 )高
)高 ,这主要是因为尿素分子之间存在更多的
,这主要是因为尿素分子之间存在更多的____________ 。
(4)氨基磺酸( )也可将
)也可将 还原为
还原为 。氨基磺酸结构中接受孤对电子的是
。氨基磺酸结构中接受孤对电子的是_____________ (填“ ”或“
”或“ ”)。
”)。
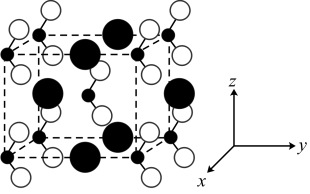
(5)亚硝酸钠晶胞结构如图所示,假设 为阿伏加德罗常数的值,已知晶胞参数
为阿伏加德罗常数的值,已知晶胞参数 (单位为
(单位为 ),则晶体密度d为
),则晶体密度d为_____________  。图示晶胞中
。图示晶胞中 呈体心正交堆积,
呈体心正交堆积, 的原子坐标除
的原子坐标除 外还有
外还有_____________ 。
(1)尿素(
 )可将
)可将 还原为
还原为 。在尿素分子所含的原子中,第一电离能最大的是
。在尿素分子所含的原子中,第一电离能最大的是(2)
 离子的空间构型为
离子的空间构型为 离子的等电子体
离子的等电子体 酸性弱于
酸性弱于 的原因是
的原因是(3)尿素中所有原子共平面,据此推断其中
 原子的杂化轨道类型为
原子的杂化轨道类型为 ,比相同摩尔质量的乙酸熔点(
,比相同摩尔质量的乙酸熔点(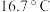 )高
)高 ,这主要是因为尿素分子之间存在更多的
,这主要是因为尿素分子之间存在更多的(4)氨基磺酸(
 )也可将
)也可将 还原为
还原为 。氨基磺酸结构中接受孤对电子的是
。氨基磺酸结构中接受孤对电子的是 ”或“
”或“ ”)。
”)。(5)亚硝酸钠晶胞结构如图所示,假设
 为阿伏加德罗常数的值,已知晶胞参数
为阿伏加德罗常数的值,已知晶胞参数 (单位为
(单位为 ),则晶体密度d为
),则晶体密度d为 。图示晶胞中
。图示晶胞中 呈体心正交堆积,
呈体心正交堆积, 的原子坐标除
的原子坐标除 外还有
外还有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐3】东晋《华阳国志·南中志》卷四中关于白铜的记载—云南镍白铜(铜镍合金),曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)基态Ni原子的价电子排布图为_______ ;3d能级上的未成对电子数为_______ 。
(2)单质铜及镍都是由_______ 键形成的晶体;元素铜与镍的第二电离能分别为: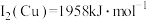 、
、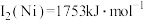 ,
,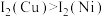 的原因是
的原因是_______ 。
(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。

①1 mol丁二酮肟分子中含有σ键的数目为_______ mol。
②2丁二酮肟镍分子中碳原子的杂化轨道类型为_______ 。
(4)Ni的晶胞结构如图所示,晶体中镍原子的配位数是_______ ;若Ni的原子半径为d pm,Ni的密度计算表达式是_______ g/cm3;Ni原子空间利用率的计算表达式是_______ 。(Ni的相对原子量用Mr表示)
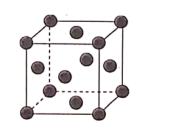
(1)基态Ni原子的价电子排布图为
(2)单质铜及镍都是由
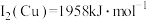 、
、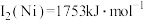 ,
,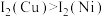 的原因是
的原因是(3)Ni2+与丁二酮肟生成鲜红色丁二酮肟镍沉淀,该反应可用于检验Ni2+。

①1 mol丁二酮肟分子中含有σ键的数目为
②2丁二酮肟镍分子中碳原子的杂化轨道类型为
(4)Ni的晶胞结构如图所示,晶体中镍原子的配位数是

您最近一年使用:0次



