1 . 氮及其化合物在化学实验中有广泛应用:
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式:__________________ ;
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论:____ ;
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式:__________________ ;
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。

限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是___________________ ;
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂)_____________ ;
③写出该法验证NH3和O2存在的实验原理的化学方程式:___________________________ 。
(1)请写出实验室用Cu和稀硝酸反应制备NO的离子方程式:
(2)请设计实验,检验某可溶性固体物质中含有NH4+的操作、现象、结论:
(3)实验室可用(NH4)2Cr2O7受热分解产生N2、Cr2O3和H2O来制备N2,请写出该分解反应的化学方程式:
(4)有人发现重铬酸铵分解产物不仅含N2、Cr2O3和H2O,还含有NH3和O2,并指出伴随有显著的副反应发生:2(NH4)2Cr2O7
 2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
2Cr2O3+4NH3↑+2H2O+3O2↑;设计如下图所示实验装置,并通过实验方法验证了NH3和O2的存在(忽略空气中O2的干扰)。
限选试剂:Na2S溶液、Na2SO3溶液、FeSO4溶液;
限选仪器:试管、玻璃导管、漏斗、烧杯、胶头滴管
①图中试管口玻璃纤维的作用是
②根据实验目的,选择一种试剂和最佳的仪器补全该实验装置(在方框中画图并标注所选试剂)
③写出该法验证NH3和O2存在的实验原理的化学方程式:
您最近一年使用:0次
名校
解题方法
2 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4
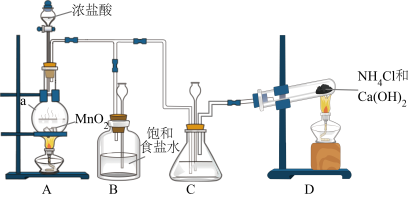
(1)装置D中反应的化学方程式是___________ 。
(2)装置C中盛放的试剂是___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O +2I2 = N2↑+ 4HI + H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
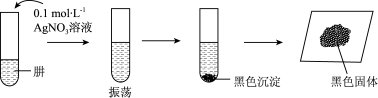
【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________
Ⅰ.实验室制备N2H4

(1)装置D中反应的化学方程式是
(2)装置C中盛放的试剂是
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O +2I2 = N2↑+ 4HI + H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【查阅资料】AgOH在溶液中不稳定,易分解生成黑色的Ag2O,Ag2O可溶于氨水。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
解题方法
3 . 某小组在做铜与浓硫酸(装置如下图)的反应实验时,发现有如下的反应现象:
 呈黄色,
呈黄色, 呈蓝色,两者混合则成绿色,铜的化合物中
呈蓝色,两者混合则成绿色,铜的化合物中 、
、 、
、 都为黑色,其中
都为黑色,其中 溶于盐酸;
溶于盐酸; 、
、 不溶于稀盐酸,但溶于浓盐酸。
不溶于稀盐酸,但溶于浓盐酸。
(1)铜丝与浓硫酸反应的化学方程式为___________ 。
(2)试管中品红溶液褪色,体现 的
的___________ 性,浸 溶液的棉团作用是
溶液的棉团作用是___________ 。
(3)甲组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
请解释形成墨绿色的原因:___________ 。
(4)乙组同学对白雾的成分经检验为 ,请设计实验证明该白雾为硫酸:
,请设计实验证明该白雾为硫酸:___________ 。
(5)丙组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有___________ 。滴加适量浓盐酸,振荡,加热,观察到黑色沉淀几乎完全溶解,生成呈略黄色的 。写出
。写出 与浓盐酸反应的离子方程式:
与浓盐酸反应的离子方程式:___________ 。
(6)某工厂将热空气通入稀硫酸中来溶解废铜屑制备 ,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为
,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为___________ (结果保留两位小数)。
| 序号 | 操作 | 现象 |
| ① | 加热 | 铜丝表面变黑 |
| ② | 继续加热 | 有大量气泡产生,溶液变为墨绿色浊液,试管底部开始有灰白色沉淀生成。品红溶液褪色。 |
| ③ | 再加热 | 试管中出现“白雾”,浊液逐渐变为澄清,溶液颜色慢慢变为浅蓝色,试管底部灰白色沉淀增多 |
| ④ | 冷却,将灰白色固体倒入水中 | 形成蓝色溶液 |
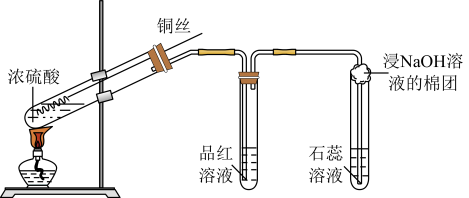
 呈黄色,
呈黄色, 呈蓝色,两者混合则成绿色,铜的化合物中
呈蓝色,两者混合则成绿色,铜的化合物中 、
、 、
、 都为黑色,其中
都为黑色,其中 溶于盐酸;
溶于盐酸; 、
、 不溶于稀盐酸,但溶于浓盐酸。
不溶于稀盐酸,但溶于浓盐酸。(1)铜丝与浓硫酸反应的化学方程式为
(2)试管中品红溶液褪色,体现
 的
的 溶液的棉团作用是
溶液的棉团作用是(3)甲组同学对实验中形成的墨绿色溶液进行探究,特进行下列实验:
| 操作 | 现象 | |
| Ⅰ组 | 直接取其铜丝(表面有聚氯乙烯薄膜)做实验 | 溶液变成墨绿色 |
| Ⅱ组 | 实验前,先将铜丝进行灼烧处理 | 溶液变蓝 |
(4)乙组同学对白雾的成分经检验为
 ,请设计实验证明该白雾为硫酸:
,请设计实验证明该白雾为硫酸:(5)丙组同学进一步对灰白色沉淀通过加水溶解、过滤,最后沉淀为黑色,取其黑色沉淀,进行成分探究:滴加适量稀盐酸,则发现黑色沉淀几乎不溶解,溶液也不变蓝,则说明黑色沉淀中不含有
 。写出
。写出 与浓盐酸反应的离子方程式:
与浓盐酸反应的离子方程式:(6)某工厂将热空气通入稀硫酸中来溶解废铜屑制备
 ,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为
,消耗含铜元素80%的废铜屑240kg固体时,得到500kg产品,产率为
您最近一年使用:0次
名校
4 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4___________ 。
(2)装置长颈漏斗的作用___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________ 。
Ⅰ.实验室制备N2H4

(2)装置长颈漏斗的作用
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
名校
解题方法
5 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次
解题方法
6 . 某小组设计实验制备溴单质,装置如图所示。回答下列问题:___________ (填名称),装置B的作用是___________ 。
(2)补充装置C,画出装置图并注明试剂名称___________ 。
(3)装置A中生成溴单质的化学方程式为___________ 。(副产物有 、
、 ,经检验产物中没有
,经检验产物中没有 生成)
生成)
(4)实验完毕后,利用如图装置提取溴单质。已知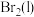 、
、 的沸点依次为
的沸点依次为 、
、 。先收集的物质是
。先收集的物质是___________ (填化学式)。 被称为拟卤素单质,具有卤素相似的性质。为了探究
被称为拟卤素单质,具有卤素相似的性质。为了探究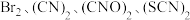 的氧化性强弱,进行实验,实验操作及现象如下:
的氧化性强弱,进行实验,实验操作及现象如下:
已知:拟卤素单质及钾盐水溶液均为无色。
①如果氧化产物为 ,写出操作乙中反应的离子方程式:
,写出操作乙中反应的离子方程式:___________ 。
②某同学得出结论,氧化性: 。该结论
。该结论___________ (填“科学”或“不科学”),理由是___________ (如果填科学,此问不填)。

(2)补充装置C,画出装置图并注明试剂名称
(3)装置A中生成溴单质的化学方程式为
 、
、 ,经检验产物中没有
,经检验产物中没有 生成)
生成)(4)实验完毕后,利用如图装置提取溴单质。已知
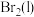 、
、 的沸点依次为
的沸点依次为 、
、 。先收集的物质是
。先收集的物质是
 被称为拟卤素单质,具有卤素相似的性质。为了探究
被称为拟卤素单质,具有卤素相似的性质。为了探究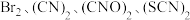 的氧化性强弱,进行实验,实验操作及现象如下:
的氧化性强弱,进行实验,实验操作及现象如下:| 实验操作 | 现象 | |
| 甲 | 向 溶液中滴加几滴溴水,振荡 溶液中滴加几滴溴水,振荡 | 溶液不褪色 |
| 乙 | 向 溶液中滴加溴水,振荡 溶液中滴加溴水,振荡 | 溶液变为无色 |
| 丙 | 向 溶液中滴加溴水,振荡 溶液中滴加溴水,振荡 | 溶液褪色 |
①如果氧化产物为
 ,写出操作乙中反应的离子方程式:
,写出操作乙中反应的离子方程式:②某同学得出结论,氧化性:
 。该结论
。该结论
您最近一年使用:0次
2024-02-04更新
|
198次组卷
|
2卷引用:广东省揭阳市2024届高三下学期二模考试化学试题
名校
解题方法
7 . 亚硝酸钠( )是一种常见的食品添加剂。某实验小组制备
)是一种常见的食品添加剂。某实验小组制备 并对其性质进行探究。已知:
并对其性质进行探究。已知: 与
与 反应,可生成
反应,可生成 白色沉淀或无色配离子。
白色沉淀或无色配离子。
回答下列问题:
I. 的制取(夹持装置略)
的制取(夹持装置略)

向装置A中通入一段时间 ,再通入NO和
,再通入NO和 混合气体,待
混合气体,待 反应完全后,将所得溶液经系列操作,得到
反应完全后,将所得溶液经系列操作,得到 白色固体。
白色固体。
(1)图中作反应器盛放碳酸钠溶液的仪器名称是_______ 。
(2)通入NO和 混合气体之前先通入一段时间
混合气体之前先通入一段时间 的目的是
的目的是_______ 。
(3)制取 的化学方程式是
的化学方程式是_______ ,常温下 溶液呈碱性的原因是
溶液呈碱性的原因是_______ (用离子方程式表示)。
II. 性质探究
性质探究
将实验i制取的 固体配制成约
固体配制成约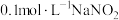 溶液,进行实验ii和iii。
溶液,进行实验ii和iii。

(4)由实验ii的现象得出结论:白色沉淀的生成与_______ 有关。

(5)①酸性条件下, 氧化
氧化 的离子方程式是
的离子方程式是_______ 。
②甲同学认为,依据实验iii的现象可以得出结论:该条件下, 能氧化
能氧化 。乙同学则认为试验i中制得的
。乙同学则认为试验i中制得的 溶液中可能含有副产物
溶液中可能含有副产物_______ , 在酸性条件下也能氧化
在酸性条件下也能氧化 ,仅凭实验iii不能得出上述结论。
,仅凭实验iii不能得出上述结论。
 )是一种常见的食品添加剂。某实验小组制备
)是一种常见的食品添加剂。某实验小组制备 并对其性质进行探究。已知:
并对其性质进行探究。已知: 与
与 反应,可生成
反应,可生成 白色沉淀或无色配离子。
白色沉淀或无色配离子。回答下列问题:
I.
 的制取(夹持装置略)
的制取(夹持装置略)
向装置A中通入一段时间
 ,再通入NO和
,再通入NO和 混合气体,待
混合气体,待 反应完全后,将所得溶液经系列操作,得到
反应完全后,将所得溶液经系列操作,得到 白色固体。
白色固体。(1)图中作反应器盛放碳酸钠溶液的仪器名称是
(2)通入NO和
 混合气体之前先通入一段时间
混合气体之前先通入一段时间 的目的是
的目的是(3)制取
 的化学方程式是
的化学方程式是 溶液呈碱性的原因是
溶液呈碱性的原因是II.
 性质探究
性质探究将实验i制取的
 固体配制成约
固体配制成约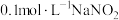 溶液,进行实验ii和iii。
溶液,进行实验ii和iii。
(4)由实验ii的现象得出结论:白色沉淀的生成与

(5)①酸性条件下,
 氧化
氧化 的离子方程式是
的离子方程式是②甲同学认为,依据实验iii的现象可以得出结论:该条件下,
 能氧化
能氧化 。乙同学则认为试验i中制得的
。乙同学则认为试验i中制得的 溶液中可能含有副产物
溶液中可能含有副产物 在酸性条件下也能氧化
在酸性条件下也能氧化 ,仅凭实验iii不能得出上述结论。
,仅凭实验iii不能得出上述结论。
您最近一年使用:0次
8 . 焦亚硫酸钠(Na2S2O5)是一种可溶于水的白色或淡黄色小晶体,食品级焦亚硫酸钠可作为贮存水果的保鲜剂等。某化学研究兴趣小组欲自制焦亚硫酸钠并探究其部分化学性质等。
(1)制备Na2S2O5,如图(夹持及加热装置略)

可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(1)。
①F中盛装的试剂是_____ 。E装置的作用是____ 。
②通入N2的作用是_____ 。
③Na2S2O5晶体在装置_____ 中得到,再经离心分离,干燥后可得纯净的样品。
(2)设计实验探究Na2S2O5的性质,完成表中填空:
①补充步骤①的操作与现象:_____ (提供:pH试纸、蒸馏水及实验必需的玻璃仪器)
②探究二中反应的离子方程式为____ 。
(3)试设计检验Na2S2O5晶体在空气中已被氧化的实验方案____ 。
(1)制备Na2S2O5,如图(夹持及加热装置略)

可用试剂:饱和Na2SO3溶液、浓NaOH溶液、浓H2SO4、苯、Na2SO3固体焦亚硫酸钠的析出原理:NaHSO3(饱和溶液)→Na2S2O5(晶体)+H2O(1)。
①F中盛装的试剂是
②通入N2的作用是
③Na2S2O5晶体在装置
(2)设计实验探究Na2S2O5的性质,完成表中填空:
| 预测Na2S2O5的性质 | 探究Na2S2O5性质的操作及现象 | |
| 探究一 | Na2S2O5的溶液呈酸性 | 用适量蒸馏水溶解少量Na2S2O5固体于试管中,① |
| 探究二 | Na2S2O5晶体具有还原性 | 取少量Na2S2O5晶体于试管中,滴加1mL2mol•L-1酸性KMnO4溶液,剧烈反应,溶液紫红色很快褪去 |
②探究二中反应的离子方程式为
(3)试设计检验Na2S2O5晶体在空气中已被氧化的实验方案
您最近一年使用:0次
名校
解题方法
9 . FeCl3(易升华)是常见的化学试剂。某学习小组开展了与FeCl3相关的系列实验,回答下列问题:
I.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a盛装的物质是为_______ (填试剂的名称);装置中F的作用:_______ 。
(2)硬质玻璃管直接接入收集器的优点是_______ 。
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是_______ 。
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:_______ 。
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1mol/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为_______ (填化学式)。
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
由此现象可知,反应速率较快的为_______ (填“反应i”或“反应ii”)。小组成员得出结论,反应ii不是CuSCN产生的主要原因。
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:_______ 。
I.铁粉制备FeCl3(实验装置如图所示)

(1)仪器a盛装的物质是为
(2)硬质玻璃管直接接入收集器的优点是
II.探究FeCl3溶液与Cu的反应
(3)配制FeCl3溶液时加入少量盐酸的原因是
(4)向FeCl3溶液中滴加几滴KSCN溶液,溶液颜色变红,再加入过量Cu粉,发现溶液的红色褪去。用离子方程式解释红色褪去的原因:
(5)已知(4)中除了红色褪去,还产生了白色沉淀。小组成员查阅得知CuCl和CuSCN均为白色沉淀。为探究白色沉淀的主要成分,小组成员完成了以下实验:向4mL0.1mol/LFeCl3溶液中加入过量Cu粉,静置,取上层清液于试管中,滴加3滴KSCN溶液,有白色沉淀生成。由此现象可知此白色沉淀为
小组成员进一步查阅资料发现,Cu2+与SCN-可发生如下两种反应。
反应i:Cu2++4SCN-=[Cu(SCN)4]2-(淡黄色)
反应ii:2Cu2++4SCN-=2CuSCN↓+(SCN)2
设计实验如下:
| 操作 | 现象 |
| 在盛有2mL0.1mol·L-1CuSO4溶液的试管中滴加KSCN溶液 | 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后,溶液绿色变浅,试管底部有白色沉淀 |
(6)根据上述分析可知,Cu2+、Fe2+和SCN-可直接发生反应,生成CuSCN和Fe3+,写出反应的离子方程式:
您最近一年使用:0次
2022-10-21更新
|
286次组卷
|
3卷引用:广东省深圳市福田区红岭中学2022-2023学年高三下学期第五次模拟化学试题
10 . 某小组利用含铜刻蚀废液制备无水 ,并电解饱和
,并电解饱和 溶液探究其阴极产物以便回收铜。
溶液探究其阴极产物以便回收铜。
I.制备无水 。制备流程如下:
。制备流程如下:
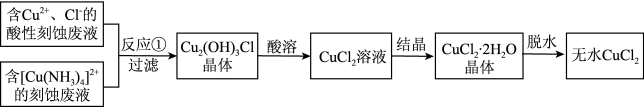
(1)实验室中,“结晶”时使用的陶瓷仪器是_______ ,“脱水”最适宜的方法为_______ 。
(2)已知“过滤”后的滤液中主要溶质为 ,则“反应①”的离子方程式为
,则“反应①”的离子方程式为_______ 。
II.探究电解饱和 溶液的阴极产物。用下图所示装置电解饱和
溶液的阴极产物。用下图所示装置电解饱和 溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
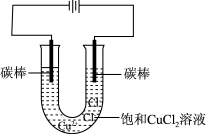
(3)查阅文献发现白色固体是CuCl。则生成CuCl的阴极电极反应为_______ 。
(4)为抑制阴极副反应的发生,该小组继续探究影响CuCl固体析出量的因素,实验如下:
实验结果表明,为减少电解过程中CuCl的析出,可采取的措施有_______ 、_______ 。
(5)为探究溶液呈“黑色”的原因,该小组查阅含铜物质的颜色后有如下猜想:
猜想1:“黑色”物质是细小的CuO粉末;
猜想2:“黑色”物质是纳米铜粉;
猜想3:“黑色”物质是 与
与 、
、 形成的络合离子。
形成的络合离子。
为验证猜想,该小组进行以下实验,得出初步结论:
有同学认为,实验2的现象不能证明猜想2一定成立,理由是③_______ ,因此,关于“黑色”物质的成分还需进一步研究。
 ,并电解饱和
,并电解饱和 溶液探究其阴极产物以便回收铜。
溶液探究其阴极产物以便回收铜。I.制备无水
 。制备流程如下:
。制备流程如下:
(1)实验室中,“结晶”时使用的陶瓷仪器是
(2)已知“过滤”后的滤液中主要溶质为
 ,则“反应①”的离子方程式为
,则“反应①”的离子方程式为II.探究电解饱和
 溶液的阴极产物。用下图所示装置电解饱和
溶液的阴极产物。用下图所示装置电解饱和 溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
溶液,一段时间后,观察到阴极电极表面附着白色固体,电极底部有少量红色固体生成,电极附近的溶液呈“黑色”。
(3)查阅文献发现白色固体是CuCl。则生成CuCl的阴极电极反应为
(4)为抑制阴极副反应的发生,该小组继续探究影响CuCl固体析出量的因素,实验如下:
| 编号 | 电解液 | 阴极电极析出固体量 | |
| 白色固体 | 红色固体 | ||
| 1 | 5% 溶液 溶液 | 无 | 较多 |
| 2 | 15% 溶液 溶液 | 少量 | 较多 |
| 3 | 饱和 溶液 溶液 | 较多 | 少 |
| 4 | 饱和 溶液,适量盐酸 溶液,适量盐酸 | 无 | 较多 |
(5)为探究溶液呈“黑色”的原因,该小组查阅含铜物质的颜色后有如下猜想:
猜想1:“黑色”物质是细小的CuO粉末;
猜想2:“黑色”物质是纳米铜粉;
猜想3:“黑色”物质是
 与
与 、
、 形成的络合离子。
形成的络合离子。为验证猜想,该小组进行以下实验,得出初步结论:
| 编号 | 操作 | 现象 | 初步结论 |
| 1 | 取2mL“黑色”溶液于试管中,加入适量① | 无明显现象 | 猜想1不成立 |
| 2 | 取2mL“黑色”溶液于试管中,加入适量稀硝酸,振荡 | ② | 猜想2成立 |
您最近一年使用:0次
2022-03-31更新
|
1192次组卷
|
3卷引用:广东省2021-2022学年高三下学期一模化学试题




