1 . 工业上用红土镍矿(主要成分为NiO,含CoO、FeO、 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备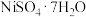 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题: 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为______ (填化学式)。
(2)由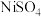 溶液获取
溶液获取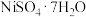 的操作是
的操作是______ 、______ 、过滤、洗涤。
(3)沉镁沉钙加入NaF溶液,生成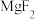 和
和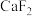 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为______ (忽略沉淀前后溶液体积变化)。(已知: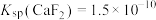 、
、 )
)
(4)“萃取”可将金属离子进行富集与分离,原理如下:
 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:______ 左右。
②反萃取的试剂为______ 。
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:______ 。
(6) 中阴离子的空间构型为
中阴离子的空间构型为______ 。
 、
、 、MgO、CaO和
、MgO、CaO和 )制备
)制备 。工艺流程如图所示,回答下列问题:
。工艺流程如图所示,回答下列问题:
 在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为
在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为(2)由
 溶液获取
溶液获取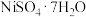 的操作是
的操作是(3)沉镁沉钙加入NaF溶液,生成
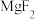 和
和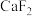 若沉淀前溶液中
若沉淀前溶液中 ,当沉淀完全后滤液中
,当沉淀完全后滤液中 时,除钙率为
时,除钙率为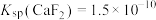 、
、 )
)(4)“萃取”可将金属离子进行富集与分离,原理如下:

 。工业上用
。工业上用 磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示:
磺化煤油做萃取剂,萃取时,Co、Ni的浸出率和Co/Ni分离因素随pH的关系如图所示: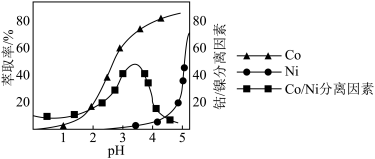
②反萃取的试剂为
(5)氧化、沉铁沉铝时,需加入NaClO溶液起氧化作用。写出
 与NaClO在碱性条件下发生反应的离子方程式:
与NaClO在碱性条件下发生反应的离子方程式:(6)
 中阴离子的空间构型为
中阴离子的空间构型为
您最近一年使用:0次
名校
解题方法
2 . 化学从微观层次认识物质,以符号形式描述物质。下列实验对应的离子方程式书写正确的是
A.向饱和氯化钠溶液中依次通入足量 和 和 : :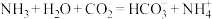 |
B.向碳酸氢钠溶液中滴加少量石灰水: |
C.同物质的量浓度同体积的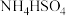 溶液与 溶液与 溶液混合: 溶液混合: |
D.用亚硫酸钠溶液吸收少量氯气: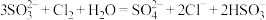 |
您最近一年使用:0次
2022-05-24更新
|
477次组卷
|
5卷引用:广东省汕头市2022届高三下学期第三次模拟考试化学试题
广东省汕头市2022届高三下学期第三次模拟考试化学试题(已下线)专题03 离子反应-2022年高考真题模拟题分项汇编(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)河南省济源市高级中学2023-2024学年高三上学期9月高考模拟检测理科综合试题-高中化学
解题方法
3 . 砷的化合物可用于半导体领域,如我国“天宫”空间站的核心舱“天和号”就是采用砷化镓薄膜电池来供电。一种从酸性高浓度含砷废水[砷主要以亚砷酸( )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
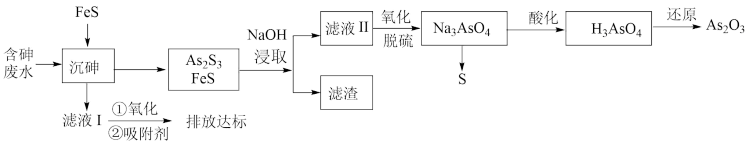
已知:
Ⅰ.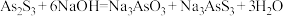
Ⅱ.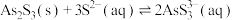
Ⅲ.砷酸( )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原
(1) 中砷元素的化合价为
中砷元素的化合价为___________ 价。
(2)“沉砷”过程中FeS是否可以用过量的 替换
替换___________ (填“是”或“否”);请从平衡移动的角度解释原因:___________ 。
(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式___________ 。
(4)用 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有___________ 。
(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。
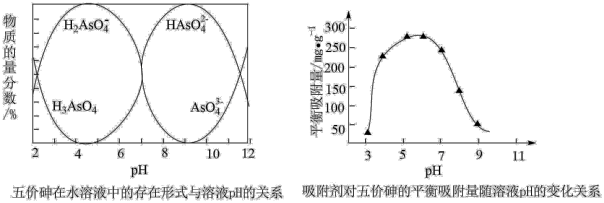
当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因_____ 。
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为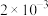 mol/L,则溶液中
mol/L,则溶液中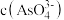 的浓度为
的浓度为_____ mol/L。该处理后的溶液是否符合国家排放标准___________ (填“是”或“否”)。(已知: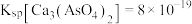 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
 )形式存在]中回收砷的工艺流程如下:
)形式存在]中回收砷的工艺流程如下:
已知:
Ⅰ.
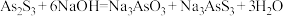
Ⅱ.
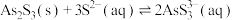
Ⅲ.砷酸(
 )在酸性条件下有强氧化性,能被
)在酸性条件下有强氧化性,能被 、氢碘酸等还原
、氢碘酸等还原(1)
 中砷元素的化合价为
中砷元素的化合价为(2)“沉砷”过程中FeS是否可以用过量的
 替换
替换(3)向滤液Ⅱ中通入氧气进行“氧化脱硫”,请写出脱硫的离子反应方程式
(4)用
 “还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有
“还原”过程中,若需检验还原后溶液中是否仍存在砷酸。则还需要的实验试剂有(5)已知:常温下,pH>7.1时,吸附剂表面带负电,pH越大,吸附剂表面带的负电荷越多;pH<7.1时,吸附剂表面带正电,pH越小,吸附剂表面带的正电荷越多。

当溶液pH介于7~9,吸附剂对五价砷的平衡吸附量随pH的升高而下降,试分析其原因
(6)含砷废水也可采用另一种化学沉降法处理:向废水中先加入适量氧化剂,再加入生石灰调节pH,将砷元素转化为
 沉淀。若沉降后上层清液中
沉淀。若沉降后上层清液中 为
为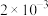 mol/L,则溶液中
mol/L,则溶液中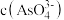 的浓度为
的浓度为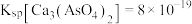 ,国家规定工业废水排放中砷元素含量<0.5mg/L)
,国家规定工业废水排放中砷元素含量<0.5mg/L)
您最近一年使用:0次
名校
解题方法
4 . 从砷化镓废料(主要成分为GaAs,含Fe2O3、SiO2和CaCO3等杂质)中回收镓和砷的工艺流程如下:
已知:镓(Ga)既能溶于酸也能溶于碱,与NaOH溶液反应生成NaGaO2和H2。
回答下列问题:
(1)“浆化”是将砷化镓废料转变成悬浊液的过程,其目的是____ 。

(2)砷化镓(GaAs)在“碱浸”时,砷转化为Na3AsO4进入溶液,该反应的化学方程式为____ 。
(3)“碱浸”的温度控制在70℃左右,温度不能过高的原因是___ ;“滤渣II”的成分为___ (填化学式)。
(4)向浸出液中加H2SO4进行“中和”,调节pH使镓和硅共沉淀,不同pH时沉淀率如下表所示。根据表中数据可知,“中和”的pH应调节至____ 范围内,沉淀的效果最好。
(5)“旋流电解”时用惰性电极,则所得“尾液”的溶质主要是____ (填化学式),可进行循环利用,提高经济效益。
(6)若用240kg含镓3%的砷化镓废料回收镓,得到纯度为98%的镓7.20kg,则镓的回收率为___ %(结果保留三位有效数字)。
已知:镓(Ga)既能溶于酸也能溶于碱,与NaOH溶液反应生成NaGaO2和H2。
回答下列问题:
(1)“浆化”是将砷化镓废料转变成悬浊液的过程,其目的是

(2)砷化镓(GaAs)在“碱浸”时,砷转化为Na3AsO4进入溶液,该反应的化学方程式为
(3)“碱浸”的温度控制在70℃左右,温度不能过高的原因是
(4)向浸出液中加H2SO4进行“中和”,调节pH使镓和硅共沉淀,不同pH时沉淀率如下表所示。根据表中数据可知,“中和”的pH应调节至
| pH | 镓沉淀率/% | 硅沉淀率/% | 砷沉淀率/% |
| 4.0 | 75.0 | 89.2 | 0.02 |
| 5.0 | 98.5 | 98.6 | 0.01 |
| 6.0 | 98.9 | 99.2 | 0.02 |
| 7.0 | 95.3 | 99.5 | 0.06 |
| 8.0 | 86.1 | 86.3 | 0.11 |
| 9.0 | 57.4 | 65.1 | 0.13 |
(5)“旋流电解”时用惰性电极,则所得“尾液”的溶质主要是
(6)若用240kg含镓3%的砷化镓废料回收镓,得到纯度为98%的镓7.20kg,则镓的回收率为
您最近一年使用:0次
名校
5 . 某离子反应涉及H+、Bi3+、 、
、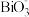 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断错误的是
)随反应进行逐渐增大。下列判断错误的是
 、
、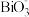 、Mn2+、H2O六种微粒。其中c(
、Mn2+、H2O六种微粒。其中c( )随反应进行逐渐增大。下列判断错误的是
)随反应进行逐渐增大。下列判断错误的是| A.氧化剂与还原剂的物质的量之比为2:5 |
B.氧化性: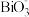 大于 大于 |
| C.反应后溶液的pH值增大 |
| D.若有1mol还原剂参加反应,转移电子的物质的量为5mol |
您最近一年使用:0次
解题方法
6 . 某种含二价铜微粒[CuII(OH)(NH3)]+的催化剂可用于汽车尾气脱硝。催化机理如图1,反应过程中不同态物质能量变化如图2.下列说法不正确的是


| A.由图2可知,该总反应为放热反应 |
| B.状态③到状态④的变化过程中有O-H键的形成 |
| C.状态④到状态⑤中,NO发生氧化反应 |
| D.该脱硝过程的总反应方程式为4NH3+2NO+2O2=N2+6H2O |
您最近一年使用:0次
解题方法
7 . 芯片被誉为“现代工业粮食”,是新一代信息产业的基石。制备芯片材料高纯硅的装置如下图所示(加热及夹持装置省略),利用SiHCl3与过量H2在1100~1200℃反应(SiHCl3沸点为31.8℃,遇水会强烈水解),下列说法不正确 的是


| A.装置B中的试剂是浓硫酸 |
| B.实验开始时先打开装置A中的K1 |
| C.装置C采用常温冷却水,目的是使SiHCl3与H2充分混合 |
D.石英管中发生反应SiHCl3+H2 Si+3HCl Si+3HCl |
您最近一年使用:0次
名校
8 . 陶瓷工业中钴系色釉具有呈色稳定、呈色强度高等优点,利用含钴废料(主要成分为Co3O4,还含有少量的铝箔、LiCoO2等杂质)制备碳酸钴的工艺流程如下:

(1)“滤液①”主要成分是:___________ ;“操作①”、“操作②”的分离方法是否相同___________ (填“是”或“否”)。
(2)“酸溶”中 H2O2的作用是:___________ (选填“氧化剂”或“还原剂”或“既是氧化剂又是还原剂”);若用 Na2S2O3代替 H2O2则有两种硫酸盐生成,写出 Na2S2O3在“酸溶”时发生的化学方程式:___________ 。
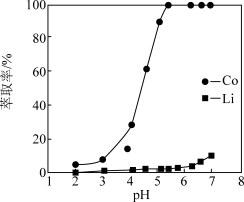
(3)已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为___________ 。
(4)Co2+萃取的反应原理如下:Co2+ + 2HR(有机层) CoR2 + 2H+,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂
CoR2 + 2H+,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 ___________ (填选项)。
A.H2SO4 B.NaOH C.Co(OH)2 D.HR
(5)“沉钴”时 Na2CO3的滴速过快或浓度太大,都会导致产品不纯,请分析原因:___________ 。
(6)在空气中煅烧 CoCO3生成钴的氧化物和 CO2,测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为___________ 。

(1)“滤液①”主要成分是:
(2)“酸溶”中 H2O2的作用是:
(3)已知钴、锂在有机磷萃取剂中的萃取率与 pH 的关系如下图所示,则有机磷萃取时最佳 pH 为

(4)Co2+萃取的反应原理如下:Co2+ + 2HR(有机层)
 CoR2 + 2H+,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂
CoR2 + 2H+,则从有机相中分离出 CoSO4需向有机溶剂中加入以下哪种试剂 A.H2SO4 B.NaOH C.Co(OH)2 D.HR
(5)“沉钴”时 Na2CO3的滴速过快或浓度太大,都会导致产品不纯,请分析原因:
(6)在空气中煅烧 CoCO3生成钴的氧化物和 CO2,测得充分煅烧后固体质量为 24.1g,CO2的体积为 6.72L(标准状况),则该钴氧化物的化学式为
您最近一年使用:0次
2021-03-09更新
|
735次组卷
|
4卷引用:广东省汕头市2021届高三下学期3月第一次模拟考化学试题
广东省汕头市2021届高三下学期3月第一次模拟考化学试题(已下线)重点8 工艺流程综合题-2021年高考化学【热点·重点·难点】专练(山东专用)(已下线)微专题18 金属及其化合物制备流程(Co)-备战2022年高考化学考点微专题辽宁省沈阳市第一二〇中学2021-2022学年高三上学期第三次质量检测化学试题
名校
解题方法
9 . 钼酸钠(Na2MoO4)是一种冷却水系统的金属缓蚀剂,工业上利用钼精矿(主要成分为MoS2)制备金属钼和钼酸钠晶体的流程如下图所示。

回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为____ ;焙烧产生的尾气对环境的主要危害是___ 。
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是_ ,过滤、洗涤、干燥。
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g(假设各步的转化率均为100%),钼精矿中MoS2的质量分数为_________ 。(已知MoS2的相对分子质量为160,Na2MoO4·2H2O的相对分子质量为242)。
(4)操作3硫元素被氧化为最高价,发生反应的离子方程式为_______ 。
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极上的电极反应式为____________ 。

(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为____ 。


回答下列问题:
(1)如果在空气中焙烧1mol MoS2时,S转移12mol电子,则MoS2中钼元素的化合价为
(2)若在实验室中进行操作2,则从钼酸钠溶液中得到钼酸钠晶体的操作步骤是
(3)钼精矿中MoS2含量的测定:取钼精矿16g,经在空气中焙烧、操作1、操作2得到钼酸钠晶体(Na2MoO4·2H2O)12.1g(假设各步的转化率均为100%),钼精矿中MoS2的质量分数为
(4)操作3硫元素被氧化为最高价,发生反应的离子方程式为
(5)用镍、钼作电极电解浓NaOH溶液制备钼酸钠(Na2MoO4)的装置如图所示。b电极上的电极反应式为

(6)某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图所示,该温度下BaMoO4的Ksp的值为

您最近一年使用:0次
2020-07-15更新
|
269次组卷
|
3卷引用:广东省汕头市2023届高三一轮复习模拟测试化学试题
广东省汕头市2023届高三一轮复习模拟测试化学试题广东省汕头市金山中学2020届高三下学期第三次模拟考试(6月) 理科综合化学试题(已下线)2021年高考化学押题预测卷(湖北卷)02(含考试版、答题卡、参考答案、全解全析)
解题方法
10 .
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:

操作Ⅱ发生反应的离子方程式为____________________ ;
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为_________________ 。
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
回答下列问题:
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是________ (填编号)。
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据________ (填“C1”或“C2”)所显示的温度,其温度应为__________________ 。
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有___________ (填化学式)。
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案________ (填“合理”或“不合理”),理由是___________________________ 。
(1)海水是巨大的资源宝库,工业上从海水中提取食盐和溴的过程如下:

操作Ⅱ发生反应的离子方程式为
可以用碳酸钠溶液代替操作Ⅱ中的二氧化硫水溶液,生成物中溴的化合价分别为+5和-1价,操作Ⅲ中如果用稀硫酸代替氯气,则操作Ⅲ中发生反应的离子方程式为
(2)溴苯是一种化工原料,可以用溴和苯反应合成。实验室合成溴苯的装置示意图如下:

下表为苯、溴和溴苯的相关数据:
| 苯 | 溴 | 溴苯 | |
| 密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
在A中加入30.0 mL无水苯和少量铁屑。在B中小心加入8.0 mL液态溴。向A中滴加液溴,反应一段时间后,点燃酒精灯加热蒸馏。
①A的容积最适合的是
a.25 mL b.50 mL c.100 mL d.250 mL
②收集溴苯时,应根据
③在反应开始后到收集溴苯之前,应先将F装置连接在D装置后,用它可承接的物质有
④某化学小组设计如下实验方案,证明苯和溴发生的是取代反应而不是加成反应。
第一步:取少量反应后F装置中的溶液于试管中;第二步:向其中加入过量的稀硝酸;第三步:继续滴加少量的硝酸银溶液。如果有浅黄色沉淀生成则证明苯和溴发生的是取代反应。
该实验方案
您最近一年使用:0次



