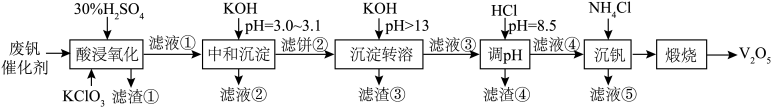
为回收利用废钒催化剂(含有V2O5、VOSO4、SiO2、Fe3O4以及钾和铝的硅酸盐),科研人员研制了一种回收V2O5的新工艺,主要流程如下图。
ii.VOSO4可溶、(VO2)2SO4易溶、V2O5和NH4VO3难溶; +2OH-=
+2OH-= +H2O
+H2O
(1)“酸浸氧化”时,VO2+转化成 反应的离子方程式为
反应的离子方程式为______ ,同时V2O5转化为 。滤渣①主要成分是
。滤渣①主要成分是______ 。
(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有______ 。
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式______ 。
(4)“调pH”中滤渣④的主要成分是______ 。
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。______ 。
②放电过程中,右槽溶液颜色变化的情况是______ 。
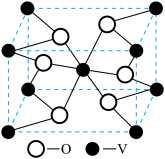
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为______ 。若该晶胞的密度为ρg/cm3,且用NA表示阿伏加德罗常数,则该晶胞的边长为______ nm。
| 金属离子 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀pH | 1.9 | 7.0 | 3.0 |
| 完全沉淀pH | 3.2 | 9.0 | 4.7 |
 +2OH-=
+2OH-= +H2O
+H2O(1)“酸浸氧化”时,VO2+转化成
 反应的离子方程式为
反应的离子方程式为 。滤渣①主要成分是
。滤渣①主要成分是(2)“中和沉淀”中,钒水解并沉淀为V2O5·2H2O,随滤液②可除去金属离子K+以及部分的金属离子有
(3)“沉淀转溶”中,V2O5·2H2O转化为KVO3溶解,写出V2O5·2H2O与KOH反应的化学方程式
(4)“调pH”中滤渣④的主要成分是
(5)全钒液流储能电池可实现化学能和电能的相互转化,其原理如图所示。
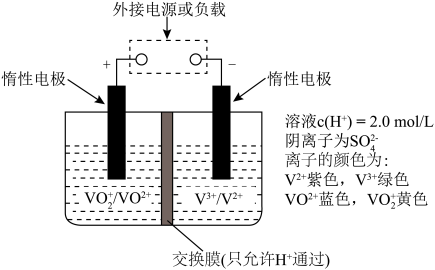
②放电过程中,右槽溶液颜色变化的情况是
(6)钒的某种氧化物的立方晶胞结构如图所示,钒原子的配位数为
更新时间:2024-04-21 09:44:01
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体( ):
):
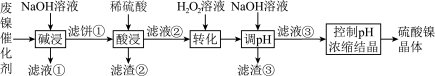
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“碱浸”中 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是___________ (写一个化学方程式就可以)。为回收金属,通常用稀硫酸将“滤液①”调为中性,生成沉淀,该沉淀的化学式为___________ 。
(2)“滤液②”中含有的金属离子除了“ ”,还有
”,还有___________ 。
(3)“转化”中加入 的主要作用是
的主要作用是___________ (用离子方程式表示)。
(4)利用上述表格数据,计算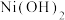 的
的
___________ (列出计算式即可,不用化简)。如果“转化”后的溶液中 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:___________ (填数值)。
 ):
):
某温度下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 |  |  |  |  |
开始沉淀时( )的pH )的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时( )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“碱浸”中
 的作用除了去除催化剂表面的油脂外,还具有作用是
的作用除了去除催化剂表面的油脂外,还具有作用是(2)“滤液②”中含有的金属离子除了“
 ”,还有
”,还有(3)“转化”中加入
 的主要作用是
的主要作用是(4)利用上述表格数据,计算
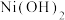 的
的
 浓度为
浓度为 ,则“调pH”应控制pH范围:
,则“调pH”应控制pH范围:
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】肼,又名联氨,化学式为N2H4,是一种无色油状液体,沸点113.5℃,具有强还原性。已知:
①N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ•mol-1。
②N2H4(l)+3O2(g)=2NO2(g)+2H2O(l) ΔH=-622kJ•mol-1
③H2O(g)=H2O(l) ΔH=-44kJ•mol-1
(1)火箭发射时可用肼作燃料,NO2作氧化剂,生成N2(g)和H2O(g)。写出该反应的热化学方程式:___ 。
(2)肼具有弱碱性和强还原性,工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等产物。上述生成水合肼的反应中尿素是__ (填“氧化剂”或“还原剂”),反应的化学方程式为__ 。
(3)肼与盐酸反应可生成N2H6Cl2,N2H6Cl2的水溶液显__ (填“酸”、“碱”或“中”)性。
(4)肼已应用于燃料电池。以N2H4(l)为燃料和O2(g)为氧化剂,Pt为电极催化剂,阳离子交换膜(只允许H+透过)为电解质。电池反应产物只有N2(g)和H2O(l)。通入肼的一极是电池的__ 极,该极上的电极反应式为:__ 。
①N2(g)+2O2(g)=2NO2(g) ΔH=+68kJ•mol-1。
②N2H4(l)+3O2(g)=2NO2(g)+2H2O(l) ΔH=-622kJ•mol-1
③H2O(g)=H2O(l) ΔH=-44kJ•mol-1
(1)火箭发射时可用肼作燃料,NO2作氧化剂,生成N2(g)和H2O(g)。写出该反应的热化学方程式:
(2)肼具有弱碱性和强还原性,工业上利用尿素[CO(NH2)2]、NaClO在NaOH溶液中发生反应生成水合肼(N2H4·H2O)、Na2CO3等产物。上述生成水合肼的反应中尿素是
(3)肼与盐酸反应可生成N2H6Cl2,N2H6Cl2的水溶液显
(4)肼已应用于燃料电池。以N2H4(l)为燃料和O2(g)为氧化剂,Pt为电极催化剂,阳离子交换膜(只允许H+透过)为电解质。电池反应产物只有N2(g)和H2O(l)。通入肼的一极是电池的
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下:
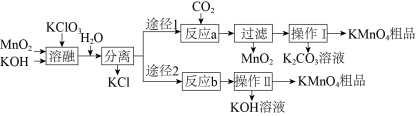
(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择____________________________
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:______________________________________
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在____________ (填性质)上的差异,采用浓缩结晶、趁热过滤得到KMnO4。趁热过滤的原因是______________________________________
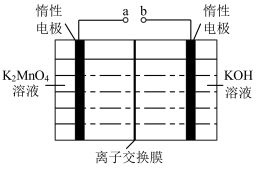
(4)反应b是电解法制备KMnO4,其装置如图所示,a作____________ 极(填“阳”或“阴”),中间的离子交换膜是_____ (填“阳”或“阴”)离子交换膜。阳极的电极反应式为____________
(5)取反应b后的电解液,加硫酸溶解后,用0.1000mol ·L-1FeSO4标准溶液滴定至终点时,消耗250.0mL标准溶液,则电解后溶液中的KMnO4的质量是_________ g。
(6)两种途径的制备方法,途径1与途径2理论产率之比为_________
(7)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________ (填标号)。
a.双氧水 b.84消液(NaClO溶液) c.75%酒精 d.苯酚

(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在
(4)反应b是电解法制备KMnO4,其装置如图所示,a作

(5)取反应b后的电解液,加硫酸溶解后,用0.1000mol ·L-1FeSO4标准溶液滴定至终点时,消耗250.0mL标准溶液,则电解后溶液中的KMnO4的质量是
(6)两种途径的制备方法,途径1与途径2理论产率之比为
(7)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
a.双氧水 b.84消液(NaClO溶液) c.75%酒精 d.苯酚
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________ (填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
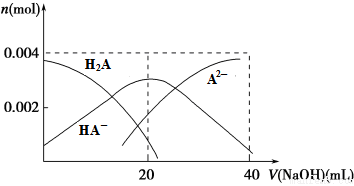
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________ ,水的电离程度比纯水________ (填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
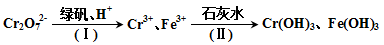
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________ 。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________ 。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
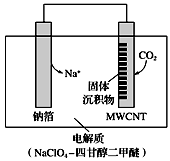
①放电时,正极的电极反应式为_____________________________ 。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______ g。
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。

则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
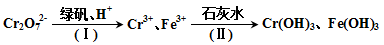
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2
 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
①放电时,正极的电极反应式为
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
【推荐2】锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
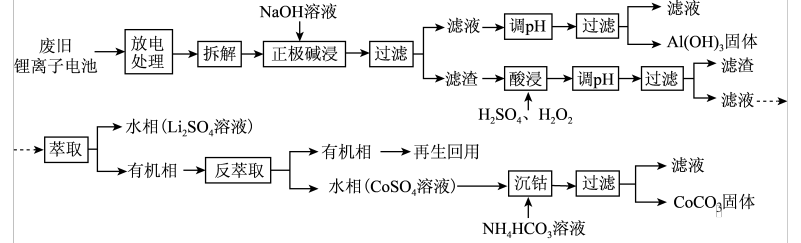
回答下列问题:
(1)LiCoO2中,Co元素的化合价为__________ 。
(2)写出“正极碱浸”中发生反应的离子方程式_____________________ 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式_________________________________________________________ ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是__________________________ 。
(4)写出“沉钴”过程中发生反应的化学方程式______________________ 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式_________________________________________________________ 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是______ 。在整个回收工艺中,可回收到的金属化合物有_______________ (填化学式)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为
(2)写出“正极碱浸”中发生反应的离子方程式
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式
(4)写出“沉钴”过程中发生反应的化学方程式
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】(1)二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下反应:
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g)△H1=-90.1 kJ·mol-1
水煤气变换反应:②CO(g) + H2O (g)=CO2(g)+H2(g)△H2=-41.1 kJ·mol-1
二甲醚合成反应:③2CH3OH(g)=CH3OCH3(g)+H2O(g)△H3=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_________________
(2)室温下,2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧的热化学方程式:_____________________ ;若1g水蒸气转化成液态水放热2.44kJ,则室温下1mol C6H6完全燃烧生成气态水放出的热量为__________ 。
(3)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO
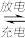 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
①放电时,正极的电极反应式是_______________________ ;
②电解液中H2SO4的浓度将变________ ;当外电路通过1mol电子时,理论上负极板的质量增加_________ g。
(4)①已知酒精的热值为29.7 kJ·g-1,写出酒精在空气中完全燃烧的热化学方程式:________________ 。
②已知乙烷的标准燃烧热为1559.8 kJ·mol-1,写出乙烷在空气中完全燃烧的热化学方程式:__________________ 。
甲醇合成反应:①CO(g)+ 2H2(g)=CH3OH(g)△H1=-90.1 kJ·mol-1
水煤气变换反应:②CO(g) + H2O (g)=CO2(g)+H2(g)△H2=-41.1 kJ·mol-1
二甲醚合成反应:③2CH3OH(g)=CH3OCH3(g)+H2O(g)△H3=-24.5 kJ·mol-1
由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
(2)室温下,2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧的热化学方程式:
(3)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO

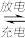 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):①放电时,正极的电极反应式是
②电解液中H2SO4的浓度将变
(4)①已知酒精的热值为29.7 kJ·g-1,写出酒精在空气中完全燃烧的热化学方程式:
②已知乙烷的标准燃烧热为1559.8 kJ·mol-1,写出乙烷在空气中完全燃烧的热化学方程式:
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】C、H、O、N 是构成生命的基本元素,是中学化学研究的重要内容之一。
(1)对碳原子核外两个未成对电子的描述,正确的是_____
A. 电子云形状不同
B. 自旋方向相同
C. 能量不同
D. 在同一轨道
(2)C、O、N 三种元素第一电离能由大到小的顺序是_____
(3)HCHO 分子中碳原子轨道的杂化类型是_____ ,福尔马林(HCHO 的水溶液),HCHO 极易与水互溶的主要原因是_____
(4)在有机银镜反应实验中其中一种反应物是配合物,写出此配合物离子的结构简式_____ ,提供孤电子对的成键原子是_____ 。
(5)如图是金刚石晶胞,每个碳原子的配位数是_____ ;每个晶胞中含有的碳原子个数是_____ ;若晶胞的边长是anm,该晶胞中两个碳原子之间的最短距离为_____ nm。

(1)对碳原子核外两个未成对电子的描述,正确的是
A. 电子云形状不同
B. 自旋方向相同
C. 能量不同
D. 在同一轨道
(2)C、O、N 三种元素第一电离能由大到小的顺序是
(3)HCHO 分子中碳原子轨道的杂化类型是
(4)在有机银镜反应实验中其中一种反应物是配合物,写出此配合物离子的结构简式
(5)如图是金刚石晶胞,每个碳原子的配位数是

您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】砷和镍是重要的材料和化工领域用途广泛。请回答下列问题:
(1)基态As原子中,价电子的电子云轮廓图形状为_______ 。与砷同周期的主族元素的基态原子中,电负性最大的为_______ (填元素符号)。
(2) 可用于碘的微量分析。
可用于碘的微量分析。
①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为_______ 。
②其中阴离子的VSEPR模型为_______ ,与其互为等电子体的分子为_______ (只写一种分子式即可)。
(3)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
NiO晶胞中Ni2+的配位数为_______ ,NiO熔点比NaCl高的原因是_______ 。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为_______ 。区分晶体Ni和非晶体Ni的最可靠的科学方法为_______ 。
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为 ,该晶体的密度ρ=
,该晶体的密度ρ=_______ g·cm-3。
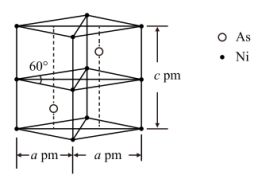
(1)基态As原子中,价电子的电子云轮廓图形状为
(2)
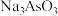 可用于碘的微量分析。
可用于碘的微量分析。①Na+的焰色反应呈黄色,很多金属元素能产生焰色反应的微观原因为
②其中阴离子的VSEPR模型为
(3)NiO的晶体结构类型与氯化钠的相同,相关离子半径如下表:
| Na+ | 102pm | Cl- | 181pm |
| Ni2+ | 69pm | O2- | 140pm |
NiO晶胞中Ni2+的配位数为
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点都比金属Ca高,原因为
(5)某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为
 ,该晶体的密度ρ=
,该晶体的密度ρ=
您最近半年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐3】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如 等与卤素单质结构相似、性质相近。
等与卤素单质结构相似、性质相近。 、
、 、
、 沸点由高到低的顺序为
沸点由高到低的顺序为___________ , 和
和 相比。电负性较大的是
相比。电负性较大的是___________ 。
(2) 属于多卤素阳离子,根据
属于多卤素阳离子,根据 模型推测
模型推测 的空间构型为
的空间构型为___________ ,中心 原子的杂化轨道类型为
原子的杂化轨道类型为___________ 。
(3)请推测① 、②
、②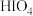 、③
、③ 该物质为五元酸
该物质为五元酸 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为___________  填序号
填序号 。
。
(4)离子化合物 存在复合阴离子,且晶体结构与
存在复合阴离子,且晶体结构与 相似,晶胞边长为
相似,晶胞边长为 晶胞中含有
晶胞中含有 ___________ 个氯原子, 晶体的密度是
晶体的密度是___________  只要求列算式,不必计算出数值。阿伏加德罗常数为
只要求列算式,不必计算出数值。阿伏加德罗常数为 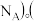 下图为
下图为 晶胞
晶胞

(1)卤素互化物如
 等与卤素单质结构相似、性质相近。
等与卤素单质结构相似、性质相近。 、
、 、
、 沸点由高到低的顺序为
沸点由高到低的顺序为 和
和 相比。电负性较大的是
相比。电负性较大的是(2)
 属于多卤素阳离子,根据
属于多卤素阳离子,根据 模型推测
模型推测 的空间构型为
的空间构型为 原子的杂化轨道类型为
原子的杂化轨道类型为(3)请推测①
 、②
、②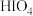 、③
、③ 该物质为五元酸
该物质为五元酸 三种物质的酸性由强到弱的顺序为
三种物质的酸性由强到弱的顺序为 填序号
填序号 。
。(4)离子化合物
 存在复合阴离子,且晶体结构与
存在复合阴离子,且晶体结构与 相似,晶胞边长为
相似,晶胞边长为 晶胞中含有
晶胞中含有  晶体的密度是
晶体的密度是 只要求列算式,不必计算出数值。阿伏加德罗常数为
只要求列算式,不必计算出数值。阿伏加德罗常数为 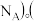 下图为
下图为 晶胞
晶胞

您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
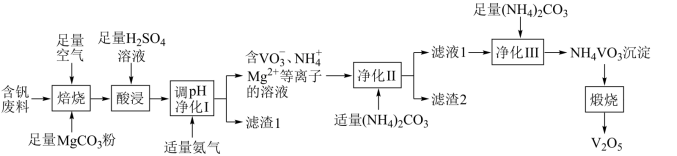
【推荐1】V2O5是化工生产中重要的催化剂,可用于制备硫酸和彩色玻璃。一种以含钒废料(主要成分为V2O3,还含有Fe2O3、Al2O3、CuO、有机物杂质)制备V2O5的工艺流程如下图所示。
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②该流程温度下:Ksp[Fe(OH)3]=8.0×10-38;Ksp[Al(OH)3]=1.0×10-33;Ksp[Cu(OH)2]=1.0×10-19
请回答下列问题:
(1)“焙烧”的目的之一是将V2O3转化为Mg(VO3)2,还有一个目的是_______ ;
(2)已知Mg(VO3)2难溶于水,能溶于酸,写出在“酸浸”时(pH<2)发生的离子反应方程式_______ 。为提高酸浸速率,可采取的措施_______ (填序号)。
a.使用98%的硫酸 b.加速搅拌
c.升高温度 d.增大压强
(3)“调pH净化I”时需将Fe3+、Al3+、Cu2+三种离子去除干净(浓度<1×10-5 mol∙L-1时视为去除干净),需调节pH范围为_______ (pH值保留1位小数)。
(4)“净化II”时,若加入过量(NH4)2CO3,可能导致的结果是_______ 。
(5)“煅烧”时,改变环境会得到不同产物,但都会有V2O5生成。若煅烧时隔绝空气,还生成物质A和一种参与大气循环的物质,且A可在该流程中循环使用,则A的化学式为_______ ;若煅烧时通入空气,还生成两种参与大气循环的物质,该反应的化学方程式为_______ 。

已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  | 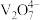 |
请回答下列问题:
(1)“焙烧”的目的之一是将V2O3转化为Mg(VO3)2,还有一个目的是
(2)已知Mg(VO3)2难溶于水,能溶于酸,写出在“酸浸”时(pH<2)发生的离子反应方程式
a.使用98%的硫酸 b.加速搅拌
c.升高温度 d.增大压强
(3)“调pH净化I”时需将Fe3+、Al3+、Cu2+三种离子去除干净(浓度<1×10-5 mol∙L-1时视为去除干净),需调节pH范围为
(4)“净化II”时,若加入过量(NH4)2CO3,可能导致的结果是
(5)“煅烧”时,改变环境会得到不同产物,但都会有V2O5生成。若煅烧时隔绝空气,还生成物质A和一种参与大气循环的物质,且A可在该流程中循环使用,则A的化学式为
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】根据信息书写反应的方程式:
(1)碳酸镁常用来治疗胃酸过多,写出该反应的离子方程式:___________ 。
(2)氢氧化钠溶液滴加到硫酸铵溶液中,微热,有刺激性气味的气体产生。写出该反应的化学方程式:___________ 。
(3)五氧化二钒(V2O5)是一种酸性氧化物,微溶于水,制取流程如下(部分生成物略去):
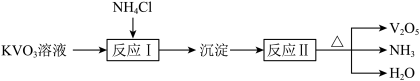
①写出“反应I”的化学方程式:___________ 。
②“反应II”为分解反应,写出“反应II”的化学方程式:___________ 。
③写出V2O5溶于KOH溶液发生反应的离子方程式:___________ 。
(1)碳酸镁常用来治疗胃酸过多,写出该反应的离子方程式:
(2)氢氧化钠溶液滴加到硫酸铵溶液中,微热,有刺激性气味的气体产生。写出该反应的化学方程式:
(3)五氧化二钒(V2O5)是一种酸性氧化物,微溶于水,制取流程如下(部分生成物略去):

①写出“反应I”的化学方程式:
②“反应II”为分解反应,写出“反应II”的化学方程式:
③写出V2O5溶于KOH溶液发生反应的离子方程式:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下。

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式_________ 。
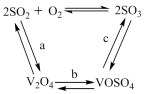
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下图)。其中a、c二步的化学方程式可表示为_________________ ,______________ 。
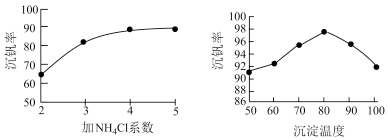
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数为_________ ,控制温度的方法为_________________ 。
(4)将滤液1和滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子反应方程式为___ 。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

(6)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ + V2++2H+  VO2+ +H2O +V3+。电池充电时阳极的电极反应式为
VO2+ +H2O +V3+。电池充电时阳极的电极反应式为___________ 。
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下图)。其中a、c二步的化学方程式可表示为

(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数为

(4)将滤液1和滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子反应方程式为
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

| A.先分解失去H2O,再分解失去NH3 | B.先分解失去NH3,再分解失去H2O |
| C.同时分解失去H2O和NH3 | D.同时分解失去H2、N2和H2O |
 VO2+ +H2O +V3+。电池充电时阳极的电极反应式为
VO2+ +H2O +V3+。电池充电时阳极的电极反应式为
您最近半年使用:0次



