随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。部分含钒物质在水中的溶解性如下表所示:
该工艺的主要流程如下。

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式_________ 。
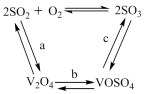
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下图)。其中a、c二步的化学方程式可表示为_________________ ,______________ 。
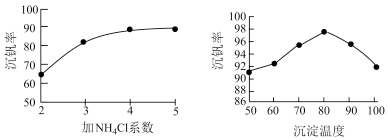
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数为_________ ,控制温度的方法为_________________ 。
(4)将滤液1和滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子反应方程式为___ 。
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

(6)全钒电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ + V2++2H+  VO2+ +H2O +V3+。电池充电时阳极的电极反应式为
VO2+ +H2O +V3+。电池充电时阳极的电极反应式为___________ 。
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下图)。其中a、c二步的化学方程式可表示为

(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数为

(4)将滤液1和滤液2混合后用氯酸钾氧化,氯元素被还原为最低价,其反应的离子反应方程式为
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示。则NH4VO3在分解过程中_________。

| A.先分解失去H2O,再分解失去NH3 | B.先分解失去NH3,再分解失去H2O |
| C.同时分解失去H2O和NH3 | D.同时分解失去H2、N2和H2O |
 VO2+ +H2O +V3+。电池充电时阳极的电极反应式为
VO2+ +H2O +V3+。电池充电时阳极的电极反应式为
更新时间:2019-03-08 18:47:14
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
①H 1________ 0,ΔH 3____ 0。(填“>”或“<”)
②N2(g)+O2(g) === 2NO(g) ΔH=_____ kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) ===5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是______ (填字母)。

(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) === 4NO(g)+CO2(g)+2H2O(g) ΔH= -574 kJ·mol-1
CH4(g)+4NO(g) === 2N2(g)+CO2(g)+2H2O(g) ΔH= -1160 kJ·mol-1
H2O(l) === H2O(g) ΔH=44 kJ·mol-1CH4 与NO2 反应生成N2(g)和H2O(g)的热化学方程式为______ ,1.6gCH4还原NO2 生成N2和液态水时放出的热量为____ kJ。
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为____ 。
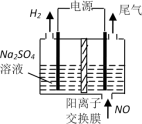
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
| 反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
| 反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
| 热量值kJ·mol-1 | 945 | 498 | 630 |
①H 1
②N2(g)+O2(g) === 2NO(g) ΔH=
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) ===5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是

(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) === 4NO(g)+CO2(g)+2H2O(g) ΔH= -574 kJ·mol-1
CH4(g)+4NO(g) === 2N2(g)+CO2(g)+2H2O(g) ΔH= -1160 kJ·mol-1
H2O(l) === H2O(g) ΔH=44 kJ·mol-1CH4 与NO2 反应生成N2(g)和H2O(g)的热化学方程式为
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为
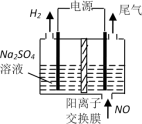
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】二氧化氯(ClO2)是一种重要的氧化剂,可用于某些污染物的处理。
(1)ClO2可由图1所示装置制备(电极不反应)。
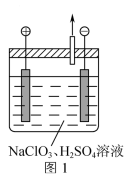

①电解时电解质溶液的pH________ (填“减小”“增大”或“不变”)。
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为________ 。
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。
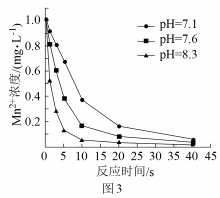
①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO ,该反应的离子方程式为:
,该反应的离子方程式为:________ 。
②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是________ 。
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
I.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=________ kcal•mol-1。

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。添加NO时,SO2氧化率比不添加NO时高,其原因可能是
变化如图5所示。添加NO时,SO2氧化率比不添加NO时高,其原因可能是________ 。
(1)ClO2可由图1所示装置制备(电极不反应)。


①电解时电解质溶液的pH
②阴极上产生ClO2的机理如图2所示(A、B均为含氯微粒,其他微粒未标出)。该机理可描述为
(2)ClO2可用于水体中Mn2+的去除。控制其他条件不变,在水体pH分别为7.1、7.6、8.3时,测得Mn2+浓度随反应时间的变化如图3所示。

①pH=8.3时水体中Mn2+转化为MnO2,ClO2转化为ClO
 ,该反应的离子方程式为:
,该反应的离子方程式为:②反应相同时间,水体中Mn2+浓度随pH增大而降低的原因是
(3)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
I.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=

②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随 变化如图5所示。添加NO时,SO2氧化率比不添加NO时高,其原因可能是
变化如图5所示。添加NO时,SO2氧化率比不添加NO时高,其原因可能是
您最近一年使用:0次
【推荐3】回答下列问题:
(1)氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图:

①氯化铁用作水处理剂的原因是_____ (用离子方程式表示)。
②试写出吸收塔中吸收剂Q是FeCl2溶液,反应的离子方程式:_____ 。
③温度超过400度,捕集器中收集到的物质的相对分子质量为325,该物质的分子式为_____ 。
④常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=______ mol/L。(常温下Ksp[Fe(OH)3=2.6×10-39])。
⑤FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用cmol•L-1Na2S2O3溶液滴定,用去Na2S2O3溶液VmL。(已知:I2+2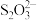 =2I-+
=2I-+ )滴定终点的现象是:
)滴定终点的现象是:_____ ,样品中氯化铁的质量分数为_____ (用字母m、c、V来表示)。
(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

①甲烷燃料电池负极反应为_____ 。
②电解NaCl溶液的总反应为_____ 。
③若每个电池甲烷通入量为2L,且反应完全,则理论上最多能产生的相同状况下氯气体积为_____ L。
(1)氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图:

①氯化铁用作水处理剂的原因是
②试写出吸收塔中吸收剂Q是FeCl2溶液,反应的离子方程式:
③温度超过400度,捕集器中收集到的物质的相对分子质量为325,该物质的分子式为
④常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=
⑤FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用cmol•L-1Na2S2O3溶液滴定,用去Na2S2O3溶液VmL。(已知:I2+2
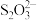 =2I-+
=2I-+ )滴定终点的现象是:
)滴定终点的现象是:(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

①甲烷燃料电池负极反应为
②电解NaCl溶液的总反应为
③若每个电池甲烷通入量为2L,且反应完全,则理论上最多能产生的相同状况下氯气体积为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】硼酸可以改善玻璃制品的耐热、透明性能,大量用于玻璃工业。以铁硼矿(主要成分为 和
和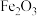 ,含少量
,含少量 、
、 和
和 等)为原料制备硼酸(
等)为原料制备硼酸(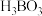 )的工艺流程如图所示:
)的工艺流程如图所示:

回答下列问题:
(1)“溶浸”过程中 与硫酸反应的化学方程式为
与硫酸反应的化学方程式为_______ ;浸渣的主要成分为_______ (填化学式)。
(2)“沉铁”时发生反应的离子方程式为_______ 。
(3)“沉镁”时若溶液酸度过高,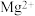 沉淀不完全,原因是
沉淀不完全,原因是_______ ;滤液X循环利用的操作单元是_______ 。
(4)“沉铁”后溶液中仍会残留微量的 ,分析化学中常用“化学放大”法测定其含量,具体操作为:取100mL“沉铁”后溶液,酸化后加入过量的KI,再用
,分析化学中常用“化学放大”法测定其含量,具体操作为:取100mL“沉铁”后溶液,酸化后加入过量的KI,再用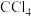 萃取、分液;有机相用
萃取、分液;有机相用 水溶液进行还原并反萃取,反萃取生成的
水溶液进行还原并反萃取,反萃取生成的 再加入过量的
再加入过量的 将其氧化为
将其氧化为 ,煮沸除去
,煮沸除去 ,加入过量的KI,酸化后用
,加入过量的KI,酸化后用 标准溶液进行滴定,达到滴定终点时消耗V mL。则“沉铁”后溶液中
标准溶液进行滴定,达到滴定终点时消耗V mL。则“沉铁”后溶液中 的浓度为
的浓度为_______  (已知:
(已知: ,
, )。
)。
 和
和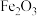 ,含少量
,含少量 、
、 和
和 等)为原料制备硼酸(
等)为原料制备硼酸(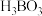 )的工艺流程如图所示:
)的工艺流程如图所示:
回答下列问题:
(1)“溶浸”过程中
 与硫酸反应的化学方程式为
与硫酸反应的化学方程式为(2)“沉铁”时发生反应的离子方程式为
(3)“沉镁”时若溶液酸度过高,
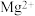 沉淀不完全,原因是
沉淀不完全,原因是(4)“沉铁”后溶液中仍会残留微量的
 ,分析化学中常用“化学放大”法测定其含量,具体操作为:取100mL“沉铁”后溶液,酸化后加入过量的KI,再用
,分析化学中常用“化学放大”法测定其含量,具体操作为:取100mL“沉铁”后溶液,酸化后加入过量的KI,再用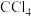 萃取、分液;有机相用
萃取、分液;有机相用 水溶液进行还原并反萃取,反萃取生成的
水溶液进行还原并反萃取,反萃取生成的 再加入过量的
再加入过量的 将其氧化为
将其氧化为 ,煮沸除去
,煮沸除去 ,加入过量的KI,酸化后用
,加入过量的KI,酸化后用 标准溶液进行滴定,达到滴定终点时消耗V mL。则“沉铁”后溶液中
标准溶液进行滴定,达到滴定终点时消耗V mL。则“沉铁”后溶液中 的浓度为
的浓度为 (已知:
(已知: ,
, )。
)。
您最近一年使用:0次
【推荐2】氨水及铵盐是化学工业的重要原料。回答下列问题:
(1)氨水中各种离子的物质的量的浓度从大到小的顺序是______ ,其他条件不变,往稀氨水溶液中加入少量蒸馏水,则混合液中水的电离程度______ (填“增大”“减小”或“不变”)。
(2)常温下向某氨水中缓缓通入HCl气体,溶液中 与pH的关系如图所示。常温下
与pH的关系如图所示。常温下 的电离平衡常数
的电离平衡常数
______ (用含有a的代数式表示),温度升高A点的位置可能是______ (填“A1”或“A2”),a______ (填“>”“<”或“=”)7。

(3)某化学兴趣小组以某废液(主要含有 、
、 、
、 )为原料制取
)为原料制取 的工艺流程及各离子开始沉淀、完全沉淀的pH如图所示(常温下
的工艺流程及各离子开始沉淀、完全沉淀的pH如图所示(常温下 的
的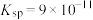 ):
):

①“沉铁、铝”时反应液的pH应控制的范围是______ 。
②“沉锰”时温度不能较高的原因是______ , 完全沉淀时
完全沉淀时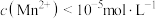 ,则此时溶液中
,则此时溶液中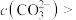
______  。
。
(1)氨水中各种离子的物质的量的浓度从大到小的顺序是
(2)常温下向某氨水中缓缓通入HCl气体,溶液中
 与pH的关系如图所示。常温下
与pH的关系如图所示。常温下 的电离平衡常数
的电离平衡常数

(3)某化学兴趣小组以某废液(主要含有
 、
、 、
、 )为原料制取
)为原料制取 的工艺流程及各离子开始沉淀、完全沉淀的pH如图所示(常温下
的工艺流程及各离子开始沉淀、完全沉淀的pH如图所示(常温下 的
的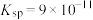 ):
):
金属离子 |
|
|
|
开始沉淀pH | 2.2 | 4.1 | 8.8 |
完全沉淀pH | 3.5 | 5.4 | 10.8 |
①“沉铁、铝”时反应液的pH应控制的范围是
②“沉锰”时温度不能较高的原因是
 完全沉淀时
完全沉淀时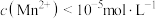 ,则此时溶液中
,则此时溶液中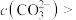
 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硫酸锰在锰系产品中具有重要地位,由软锰矿(MnO2) 和硫铁矿(FeS2)制备流程如下:
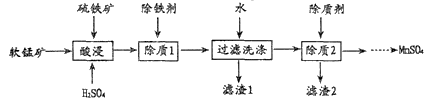
(1)从“除质2”后的溶液中得到MnSO4的操作为______ 、降温结晶、过滤和干燥。
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:
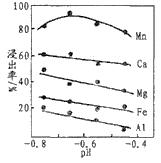
①__________ ;②__________ 。提高软锰矿浸出率的措施还有______ 和_______ 。
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为______ ,加入其目的是_________ 。
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式____________ 。
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?_________ (列式计算)。

(1)从“除质2”后的溶液中得到MnSO4的操作为
(2)下图是在一定条件下,不同浓度的硫酸对各元素浸出率的影响,由此得出的相关结论是:

①
(3)除铁剂为H2SO5和氨水。
①H2SO5 中S的化合价为+6,其中过氧键的数目为
②写出Fe3+生成沉淀黄铵铁矾NH4Fe3(SO4)2(OH)6的离子方程式
(4)工业除质剂为MnF2,发生反应为(已知,该温度下MnF2、CaF2 和MgF2 的Ksp分别为5.0×10-3、2.0×10-10、8.0×10-11)
反应I:MnF2(s) +Ca2+=CaF2(s) +Mn2+
反应II:MnF2(s) +Mg2+=MgF2(s) + Mn2+
若滤液中c(Mg2+) =0.02 mol/L,加入MnF2(s),使Ca2+恰好沉淀完全即溶液中c(Ca2+) =1.0×10-5mol/L,此时是否有MgF2 沉淀生成?
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】五氧化二钒在冶金、化工等领域有重要应用。实验室以含钒矿渣(主要成分为FeO·V2O3、V2O5,含少量SiO2杂质)为原料制备V2O5的主要流程如下:
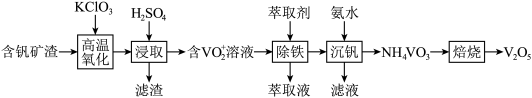
已知:①钒有多种价态,其中+5价最稳定
②
回答下列问题:
(1)“高温氧化”过程中消耗1molKClO3转移6mol电子,该反应的化学方程式为___________ 。滤渣的主要成分为___________ 。
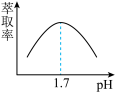
(2)“除铁”时,萃取剂(HA)萃取Fe3+的原理为: 的萃取率与pH的关系如下图所示。pH<1.7时,萃取率上升的原因是
的萃取率与pH的关系如下图所示。pH<1.7时,萃取率上升的原因是___________ 。
(3)“沉钒”过程中主要反应的离子方程式为___________ 。
(4)研究表明“焙烧”过程分为三步,每一步产生NH3和H2O(g)的物质的量之比分别为2∶1、3∶1、x。取117gNH4VO3固体进行热重分析,剩余固体质量与温度的关系如图所示。图中m=___________ ;分解过程最后一步产生的NH3和H2O(g)的物质的量之比x=___________ 。


已知:①钒有多种价态,其中+5价最稳定
②

回答下列问题:
(1)“高温氧化”过程中消耗1molKClO3转移6mol电子,该反应的化学方程式为
(2)“除铁”时,萃取剂(HA)萃取Fe3+的原理为:
 的萃取率与pH的关系如下图所示。pH<1.7时,萃取率上升的原因是
的萃取率与pH的关系如下图所示。pH<1.7时,萃取率上升的原因是
(3)“沉钒”过程中主要反应的离子方程式为
(4)研究表明“焙烧”过程分为三步,每一步产生NH3和H2O(g)的物质的量之比分别为2∶1、3∶1、x。取117gNH4VO3固体进行热重分析,剩余固体质量与温度的关系如图所示。图中m=

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
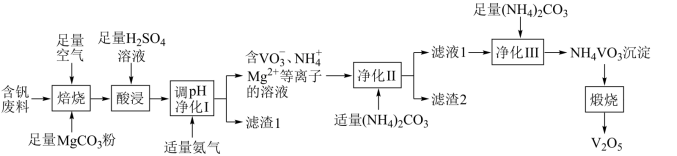
【推荐2】V2O5是化工生产中重要的催化剂,可用于制备硫酸和彩色玻璃。一种以含钒废料(主要成分为V2O3,还含有Fe2O3、Al2O3、CuO、有机物杂质)制备V2O5的工艺流程如下图所示。
已知:①含钒离子在溶液中的存在形式与溶液pH的关系
②该流程温度下:Ksp[Fe(OH)3]=8.0×10-38;Ksp[Al(OH)3]=1.0×10-33;Ksp[Cu(OH)2]=1.0×10-19
请回答下列问题:
(1)“焙烧”的目的之一是将V2O3转化为Mg(VO3)2,还有一个目的是_______ ;
(2)已知Mg(VO3)2难溶于水,能溶于酸,写出在“酸浸”时(pH<2)发生的离子反应方程式_______ 。为提高酸浸速率,可采取的措施_______ (填序号)。
a.使用98%的硫酸 b.加速搅拌
c.升高温度 d.增大压强
(3)“调pH净化I”时需将Fe3+、Al3+、Cu2+三种离子去除干净(浓度<1×10-5 mol∙L-1时视为去除干净),需调节pH范围为_______ (pH值保留1位小数)。
(4)“净化II”时,若加入过量(NH4)2CO3,可能导致的结果是_______ 。
(5)“煅烧”时,改变环境会得到不同产物,但都会有V2O5生成。若煅烧时隔绝空气,还生成物质A和一种参与大气循环的物质,且A可在该流程中循环使用,则A的化学式为_______ ;若煅烧时通入空气,还生成两种参与大气循环的物质,该反应的化学方程式为_______ 。

已知:①含钒离子在溶液中的存在形式与溶液pH的关系
| 溶液pH | <4.0 | 6.0≤pH≤8.0 | >8.0 |
| 钒元素存在形式 |  |  |  |
请回答下列问题:
(1)“焙烧”的目的之一是将V2O3转化为Mg(VO3)2,还有一个目的是
(2)已知Mg(VO3)2难溶于水,能溶于酸,写出在“酸浸”时(pH<2)发生的离子反应方程式
a.使用98%的硫酸 b.加速搅拌
c.升高温度 d.增大压强
(3)“调pH净化I”时需将Fe3+、Al3+、Cu2+三种离子去除干净(浓度<1×10-5 mol∙L-1时视为去除干净),需调节pH范围为
(4)“净化II”时,若加入过量(NH4)2CO3,可能导致的结果是
(5)“煅烧”时,改变环境会得到不同产物,但都会有V2O5生成。若煅烧时隔绝空气,还生成物质A和一种参与大气循环的物质,且A可在该流程中循环使用,则A的化学式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐3】根据信息书写反应的方程式:
(1)碳酸镁常用来治疗胃酸过多,写出该反应的离子方程式:___________ 。
(2)氢氧化钠溶液滴加到硫酸铵溶液中,微热,有刺激性气味的气体产生。写出该反应的化学方程式:___________ 。
(3)五氧化二钒(V2O5)是一种酸性氧化物,微溶于水,制取流程如下(部分生成物略去):
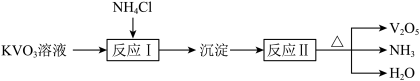
①写出“反应I”的化学方程式:___________ 。
②“反应II”为分解反应,写出“反应II”的化学方程式:___________ 。
③写出V2O5溶于KOH溶液发生反应的离子方程式:___________ 。
(1)碳酸镁常用来治疗胃酸过多,写出该反应的离子方程式:
(2)氢氧化钠溶液滴加到硫酸铵溶液中,微热,有刺激性气味的气体产生。写出该反应的化学方程式:
(3)五氧化二钒(V2O5)是一种酸性氧化物,微溶于水,制取流程如下(部分生成物略去):

①写出“反应I”的化学方程式:
②“反应II”为分解反应,写出“反应II”的化学方程式:
③写出V2O5溶于KOH溶液发生反应的离子方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】五氧化二钒(V2O5)是一种重要的工业催化剂,可采用以下两种途径制备V2O5。

已知:①VO +2H+
+2H+ VO
VO +H2O。②NH4VO3微溶于冷水,易溶于热水,难溶于乙醇。回答下列问题:
+H2O。②NH4VO3微溶于冷水,易溶于热水,难溶于乙醇。回答下列问题:
(1)SO 的空间结构为
的空间结构为______ 。
(2)途径Ⅰ“浸取”得到的浸出液中含钒物质的化学式是______ ,滤渣①为______ (填化学式)。
(3)途径Ⅱ“浸取”时,可产生VO2+,写出V2O4发生反应的离子方程式:______ 。
(4)途径Ⅱ“氧化”时,除了Fe2+被氧化外,还有______ 离子被氧化,写出此离子被氧化的离子方程式:______ 。
(5)“沉钒”时温度需要控制在60℃左右,其原因是______ ;已知:室温下,Ksp(NH4VO3)=1.6×10-3、Ksp[Ca(VO3)2]=4×10-6,向偏钒酸铵(NH4VO3)的悬浊液中加入CaCl2,当c(Ca2+)=1mol•L-1时,溶液中的c(NH )=
)=______ 。

已知:①VO
 +2H+
+2H+ VO
VO +H2O。②NH4VO3微溶于冷水,易溶于热水,难溶于乙醇。回答下列问题:
+H2O。②NH4VO3微溶于冷水,易溶于热水,难溶于乙醇。回答下列问题:(1)SO
 的空间结构为
的空间结构为(2)途径Ⅰ“浸取”得到的浸出液中含钒物质的化学式是
(3)途径Ⅱ“浸取”时,可产生VO2+,写出V2O4发生反应的离子方程式:
(4)途径Ⅱ“氧化”时,除了Fe2+被氧化外,还有
(5)“沉钒”时温度需要控制在60℃左右,其原因是
 )=
)=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
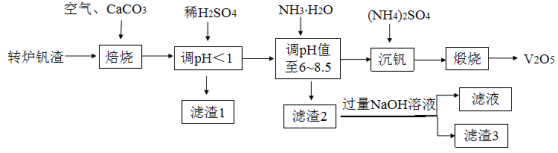
【推荐2】一种以转炉钒渣(主要成分为V2O3、FeO、SiO2及少量MgO、CaO、Al2O3)为原料实现低成本回收钒资源的生产工艺如下:
表一:相关金属离子[c0(Mn+)=0.01mol·L−1]形成氢氧化物沉淀的pH范围如下:
表二:部分含钒物质在水溶液中主要存在形式如下:
已知:①“焙烧”的主要反应为:CaCO3(s)=CaO(s)+CO2(g);
②在焙烧过程中产生Ca2V2O7;其中,Ca2V2O7在水中的溶解度小,易溶于稀硫酸和碱溶液。
回答下列问题:
(1)Ca2V2O7中V的化合价为_______ ,写出流程中氧化“钒”的化学方程式_______ 。
(2)“酸浸”后钒元素主要以VO 存在,生成VO
存在,生成VO 的离子方程式为
的离子方程式为_______ 。
(3)“滤渣2”的主要成分是_______ 。
(4)“调pH”中一般控制温度不超过40℃,原因是_______ 。
(5)利用上述表格数据,计算Fe(OH)3的Ksp=_______ 。
(6)已知“沉钒”得到NH4VO3,该环节通常需要加入过量(NH4)2SO4,其原因是_______ 。
(7)滤液经浓缩后,经电解后得到高纯度的氢氧化物,该反应阴极电极反应式为_______ 。

表一:相关金属离子[c0(Mn+)=0.01mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 7.5 | 2.2 | 3.7 | 9.4 |
| 沉淀完全的pH | 9.0 | 3.2 | 4.7 | 10.9 |
| pH | <1 | 1~4 | 6~8.5 | >13 |
| 主要形式 | VO | V2O5 | VO | VO |
| 备注 | 多钒酸盐在水中溶解度较小 | |||
②在焙烧过程中产生Ca2V2O7;其中,Ca2V2O7在水中的溶解度小,易溶于稀硫酸和碱溶液。
回答下列问题:
(1)Ca2V2O7中V的化合价为
(2)“酸浸”后钒元素主要以VO
 存在,生成VO
存在,生成VO 的离子方程式为
的离子方程式为(3)“滤渣2”的主要成分是
(4)“调pH”中一般控制温度不超过40℃,原因是
(5)利用上述表格数据,计算Fe(OH)3的Ksp=
(6)已知“沉钒”得到NH4VO3,该环节通常需要加入过量(NH4)2SO4,其原因是
(7)滤液经浓缩后,经电解后得到高纯度的氢氧化物,该反应阴极电极反应式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
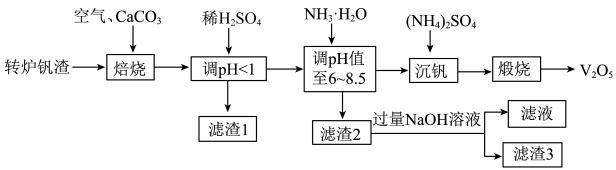
【推荐3】一种以转炉钒渣(主要成分为V2O3、FeO、SiO2及少量MgO、CaO、Al2O3)为原料实现低成本回收钒资源的生产工艺如下:
表一:相关金属离子[c0(Mn+) = 0.01 mol·L−1]形成氢氧化物沉淀的pH范围如下:
表二:部分含钒物质在水溶液中主要存在形式如下:
已知:①“焙烧”的主要反应之一为:CaCO3(s) = CaO(s) + CO2(g);
②在焙烧过程中产生Ca2V2O7;其中,Ca2V2O7在水中的溶解度小,易溶于稀硫酸和碱溶液。
(1)焙烧前将转炉钒渣研磨的目的是___________ 。
(2)Ca2V2O7中V的化合价为___________ ,写出在焙烧过程中产生Ca2V2O7的化学方程式___________ 。
(3)写出用稀H2SO4调pH<1的离子方程式为___________ 。
(4)“滤渣2”的主要成分是___________ 。
(5)“调pH值至6~8.5”时控制温度不超过40℃,原因是___________ 。
(6)沉钒后的操作是___________ 、干燥,得到NH4VO3.写出NH4VO3分解生成V2O5的化学方程式___________ 。

表一:相关金属离子[c0(Mn+) = 0.01 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 7.5 | 2.2 | 3.7 | 9.4 |
| 沉淀完全的pH | 9.0 | 3.2 | 4.7 | 10.9 |
| pH | <1 | 1 ~ 4 | 6 ~ 8.5 | >13 |
| 主要形式 | VO | V2O5 | VO | VO |
| 备注 | 多钒酸盐在水中溶解度较小 | |||
②在焙烧过程中产生Ca2V2O7;其中,Ca2V2O7在水中的溶解度小,易溶于稀硫酸和碱溶液。
(1)焙烧前将转炉钒渣研磨的目的是
(2)Ca2V2O7中V的化合价为
(3)写出用稀H2SO4调pH<1的离子方程式为
(4)“滤渣2”的主要成分是
(5)“调pH值至6~8.5”时控制温度不超过40℃,原因是
(6)沉钒后的操作是
您最近一年使用:0次



