名校
解题方法
1 . 下列物质性质实验对应的离子方程式书写正确的是
A.铁与稀硫酸反应: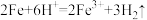 |
B. 溶液中通入硫化氢: 溶液中通入硫化氢: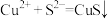 |
C. 通入酸性 通入酸性 溶液中: 溶液中: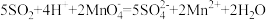 |
D. 溶液中加入稀硫酸: 溶液中加入稀硫酸: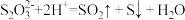 |
您最近一年使用:0次
2023-03-16更新
|
2085次组卷
|
4卷引用:广东省广州市2023届高三一模考试化学试题
名校
2 . 载人航天器中的物质和能量资源都十分宝贵,我国科学家进行了如图所示的氧循环研究,实现了空间站中氧气的再生。下列说法不正确的是


| A.用于循环的氢原子利用率为100% |
| B.太阳能可作为反应①和②的能量来源 |
C.反应①为 |
D.等物质的量的 和 和 含有的电子数相同 含有的电子数相同 |
您最近一年使用:0次
2023-03-16更新
|
2053次组卷
|
8卷引用:广东省广州市2023届高三一模考试化学试题
名校
解题方法
3 . 已知电离常数:Ka(HCN)=5×10-10,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,下列离子方程式书写正确的是
A.向KCN(aq)中通入少量的CO2气体:CO2+H2O+2CN-=2HCN+CO |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.氢氧化铁沉淀溶解于过量氢碘酸溶液中:2Fe(OH)3+6H++2I-=2Fe2++6H2O+I2 |
D.向Ba(OH)2溶液中加入少量的NaHCO3溶液:2HCO +Ba2++2OH-=BaCO3↓+CO +Ba2++2OH-=BaCO3↓+CO +2H2O +2H2O |
您最近一年使用:0次
2023-06-18更新
|
1731次组卷
|
8卷引用:2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题
2024届广东省梅州市兴宁市第一中学高三下学期二模化学试题河南省郑州外国语学校2023届高三下学期全真模拟五理综化学试题2024届湖南省长沙市雅礼中学高三下学期4月综合测试化学试题湖南省雅礼中学2024届高三下学期综合自主压轴测试 (一)化学题(已下线)第九章单元测试卷(已下线)考点1 电离平衡(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)电离平衡江西省赣州地区2023-2024学年十大教学能手选拔赛高中化学试题
名校
解题方法
4 . 碳酸镍是合成纳米镍的一种前驱体。一种用铁镍合金废料(还含有少量铜、钙、镁、硅的氧化物)制备纯度较高的碳酸镍的工艺流程如图:

已知:H2S的电离常数 ,
,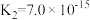 ,
,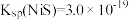 ;
;
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸:
①金属镍溶解的离子方程式是_______ 。
②“酸溶”时产生的废渣成分有_______ 。
③该过程控制温度70℃-80℃的原因是_______ 。
(2)“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀对后续操作较为有利:
①黄钠铁矾中Fe元素的化合价为_______ 。
②“除铁”加入Na2CO3时,生成黄钠铁矾的离子方程式是_______ 。
(3)“除铜”后,溶液中c(H2S)=0.1mol·L-1,c(Ni2+)=0.1mol·L-1,溶液中c(H+) ≥_______ mol·L-1(列计算式)才不会使Ni2+形成NiS沉淀。
(4)“沉镍”后,滤液的主要成分是_______ 。
(5)“沉镍”时,若用Na2CO3溶液做沉淀剂,产物容易不纯,该杂质的化学式为_______ 。

已知:H2S的电离常数
 ,
,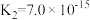 ,
,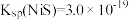 ;
;回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸:
①金属镍溶解的离子方程式是
②“酸溶”时产生的废渣成分有
③该过程控制温度70℃-80℃的原因是
(2)“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾[NaFe3(SO4)2(OH)6]沉淀对后续操作较为有利:
①黄钠铁矾中Fe元素的化合价为
②“除铁”加入Na2CO3时,生成黄钠铁矾的离子方程式是
(3)“除铜”后,溶液中c(H2S)=0.1mol·L-1,c(Ni2+)=0.1mol·L-1,溶液中c(H+) ≥
(4)“沉镍”后,滤液的主要成分是
(5)“沉镍”时,若用Na2CO3溶液做沉淀剂,产物容易不纯,该杂质的化学式为
您最近一年使用:0次
2022-03-07更新
|
1829次组卷
|
4卷引用:广东省广州市执信中学2022届高三下学期联考化学试题
广东省广州市执信中学2022届高三下学期联考化学试题广东广雅中学2023届高三下学期2月阶段测试化学试题(已下线)专题16 工艺流程题-三年(2020-2022)高考真题分项汇编(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题
名校
5 . 半导体芯片行业是金属靶材的主要应用领域之一。利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③氧化性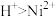
④室温: ;
;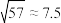
(1)“酸浸”时镍发生反应的化学方程式为_______ 。
(2)铂在王水中生成二元强酸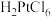 ,其中Pt元素的化合价为
,其中Pt元素的化合价为_______ ,该反应的离子方程式为_______ 。
(3)设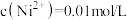 “调pH”应控制的pH范围是
“调pH”应控制的pH范围是_______ 。
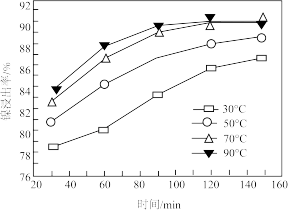
(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是_______ 。
(5)沉铂过程中,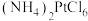 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释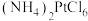 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因_______ 。
(6)在“沉铂”过程中,若向 的溶液里加入等体积的
的溶液里加入等体积的 溶液,使
溶液,使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度最小值为
溶液的浓度最小值为_______ mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。

已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ |  |  |  |
| 开始沉淀时(c=0.01mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时 (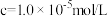 )的pH )的pH | 8.7 | 4.7 | 3.2 | 9.0 |
③氧化性
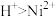
④室温:
 ;
;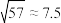
(1)“酸浸”时镍发生反应的化学方程式为
(2)铂在王水中生成二元强酸
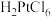 ,其中Pt元素的化合价为
,其中Pt元素的化合价为(3)设
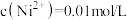 “调pH”应控制的pH范围是
“调pH”应控制的pH范围是(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是

(5)沉铂过程中,
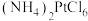 的沉淀率随温度的升高而增大,结合平衡移动原理解释
的沉淀率随温度的升高而增大,结合平衡移动原理解释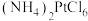 沉淀率随温度变化的主要原因
沉淀率随温度变化的主要原因(6)在“沉铂”过程中,若向
 的溶液里加入等体积的
的溶液里加入等体积的 溶液,使
溶液,使 沉淀完全,则加入
沉淀完全,则加入 溶液的浓度最小值为
溶液的浓度最小值为(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。
| A.蒸馏水 | B.浓盐酸 | C.氯化铵溶液 | D.王水 |
您最近一年使用:0次
2022-04-29更新
|
1502次组卷
|
4卷引用:广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题
广东省粤港澳大湾区普通高中2022届高三第二次模拟考试化学试题(已下线)押广东卷化学第18题 化学工艺流程题-备战2022年高考化学临考题号押题(广东卷)湖南省衡山县岳云中学2021-2022学年高三下学期期中考试化学试卷(已下线)2022年全国乙卷高考变式题(非选择题)
名校
解题方法
6 . 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示:
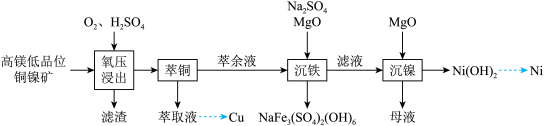
回答下列问题:
(1)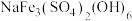 中,
中, 元素的化合价为
元素的化合价为_______ 。
(2)为提高“氧压浸出”的速率,可行的操作有_______ (任填一个)。
(3)“氧压浸出”的滤渣有S和_______ ,该环节中 发生的化学反应方程式为
发生的化学反应方程式为_______ 。
(4)“萃铜”时的反应为: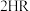 (有机相)
(有机相)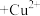 (水相)
(水相)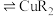 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。
(5)已知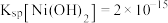 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为_______ ,“沉镍”后的母液,含有的主要溶质为_______ (填化学式)。

回答下列问题:
(1)
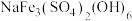 中,
中, 元素的化合价为
元素的化合价为(2)为提高“氧压浸出”的速率,可行的操作有
(3)“氧压浸出”的滤渣有S和
 发生的化学反应方程式为
发生的化学反应方程式为(4)“萃铜”时的反应为:
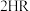 (有机相)
(有机相)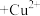 (水相)
(水相)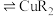 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。A.向萃取液中加入稀硫酸进行“反萃取”,可得到单质 |
B.萃余液中的阳离子为: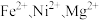 |
C.一定条件下,萃取平衡时,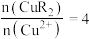 ,则 ,则 的萃取率为80% 的萃取率为80% |
D.为提高 的萃取率,可适当提高溶液 的萃取率,可适当提高溶液 |
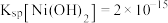 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为
您最近一年使用:0次
2023-02-09更新
|
1279次组卷
|
3卷引用:广东省佛山市2023届普通高中教学质量检测(一)化学试题
7 . 锑(Sb)可用作阻燃剂、电极材料、催化剂等物质的原材料。一种以辉锑矿(主要成分为Sb2S3,还含有Fe2O3、Al2O3、MgO、SiO2等)为原料提取锑的工艺如下:
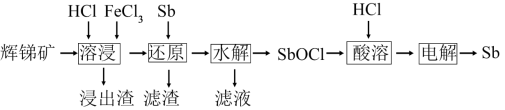
已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为___________ 。
(2)“还原”时加入Sb的目的是将___________ 还原,提高产物的纯度。
(3)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为___________ 。
②下列能促进该水解反应的措施有___________ (填字母)。
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于___________ mol·L-1。
(4)“滤液”中含有的金属阳离子有___________ 。向“滤液”中通入足量___________ (填化学式)气体,再将滤液pH调至3.5,可析出Fe(OH)3沉淀。将沉淀溶于浓盐酸后,产物可返回___________ 工序循环使用。
(5)Sb可由SbCl 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为___________ 。

已知:溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 2.2 | 3.7 | 7.5 | 9.6 |
| 完全沉淀时(c=1.0×10-5mol·L-1)的pH | 3.2 | 4.7 | 9.0 | 11.1 |
(1)“溶浸”时氧化产物是S,Sb2S3被氧化的化学方程式为
(2)“还原”时加入Sb的目的是将
(3)“水解”时需控制溶液pH=2.5。
①Sb3+发生水解的离子方程式为
②下列能促进该水解反应的措施有
A.升高温度 B.增大c(H+) C.增大c(Cl-) D.加入Na2CO3粉末
③为避免水解产物中混入Fe(OH)3,Fe3+浓度应小于
(4)“滤液”中含有的金属阳离子有
(5)Sb可由SbCl
 电解制得,阴极的电极反应式为
电解制得,阴极的电极反应式为
您最近一年使用:0次
2022-03-17更新
|
1529次组卷
|
4卷引用:广东省广州市2022届高三一模考试化学试题
名校
解题方法
8 . 碲化镉玻璃中主要含有CdTe(其中含有少量Fe、Ni、Mg、Si、O等元素组成的化合物),工业上利用废弃碲化镉(CdTe)玻璃回收其中金属的工艺流程如下。
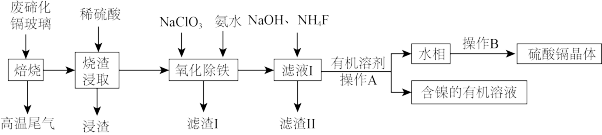
已知:①常温时,有关物质的 如下表。
如下表。
②当溶液中离子浓度小于 时,可认为沉淀完全。
时,可认为沉淀完全。
回答下列问题:
(1)在“焙烧”时为提高效率可采用的措施有_______ (答出一条即可)。写出“浸渣”的工业用途:_______ 。
(2)实验室中,“操作A”需要的玻璃仪器有_______ 。“高温尾气”中的 在水溶液中可用
在水溶液中可用 将其还原为Te单质,写出该反应的化学方程式:
将其还原为Te单质,写出该反应的化学方程式:_______ 。
(3)“氧化除铁”步骤中可以先调节pH为5,然后再加入 ,则此时
,则此时 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)测得“滤液I”中 浓度为
浓度为 ,取1L滤液,则至少加入
,取1L滤液,则至少加入_______ g 固体才能使
固体才能使 沉淀完全。
沉淀完全。
(5)取1吨含碲化镉80%的废弃玻璃,最终回收得到0.64吨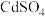 ,则硫酸镉的回收率为
,则硫酸镉的回收率为_______ (保留三位有效数字)。

已知:①常温时,有关物质的
 如下表。
如下表。 |  |  |  |  |
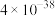 | 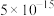 | 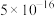 |  | 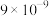 |
 时,可认为沉淀完全。
时,可认为沉淀完全。回答下列问题:
(1)在“焙烧”时为提高效率可采用的措施有
(2)实验室中,“操作A”需要的玻璃仪器有
 在水溶液中可用
在水溶液中可用 将其还原为Te单质,写出该反应的化学方程式:
将其还原为Te单质,写出该反应的化学方程式:(3)“氧化除铁”步骤中可以先调节pH为5,然后再加入
 ,则此时
,则此时 被氧化的离子方程式为
被氧化的离子方程式为(4)测得“滤液I”中
 浓度为
浓度为 ,取1L滤液,则至少加入
,取1L滤液,则至少加入 固体才能使
固体才能使 沉淀完全。
沉淀完全。(5)取1吨含碲化镉80%的废弃玻璃,最终回收得到0.64吨
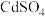 ,则硫酸镉的回收率为
,则硫酸镉的回收率为
您最近一年使用:0次
2022-11-04更新
|
1356次组卷
|
4卷引用:广东省2023届高三一轮复习联考(二)广东卷化学试题
广东省2023届高三一轮复习联考(二)广东卷化学试题广东省部分学校2022-2023学年高三上学期一轮复习联考(二)化学试题(已下线)热点情景汇编-专题十 工艺流程中的新工艺福建省惠安第一中学2022-2023学年高三上学期第三次月考化学试题
9 . Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

回答下列问题:
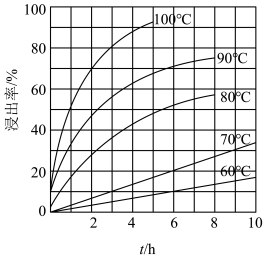
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为____________________________ 。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式____________________ 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
分析40℃时TiO2·xH2O转化率最高的原因_______________________________________ 。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为___________ 。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成______________ (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式____________ 。

回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为

(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ | 30 | 35 | 40 | 45 | 50 |
| TiO2·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为
(5)若“滤液②”中c(Mg2+)=0.02 mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol/L,此时是否有Mg3(PO4)2沉淀生成
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式
您最近一年使用:0次
2017-08-09更新
|
12687次组卷
|
23卷引用:广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题
广东省深圳中学2020年高中毕业班教学质量监测卷理科综合化学试题【全国百强校】河南省实验中学2019届高三上学期质量预测模拟(三)化学试题吉林省四平四中2019届高三下学期第二次模拟考试化学试题(已下线)广东省深圳中学2020届高三3月份教学质量监测卷理综化学试题广东省华南师范大学附属中学2021-2022学年高三上学期1月模拟考试化学试题广东省梅州市梅江区梅州中学2021-2022学年高三下学期开学模拟考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅰ卷精编版)重庆市第二中学2018届高三3月测试化学试题(已下线)《考前20天终极攻略》-5月28日 工艺流程分析(已下线)解密19 工艺流程题(教师版)——备战2018年高考化学之高频考点解密四川省成都实验高级中学2020届高三上学期入学考试化学试题四川省棠湖中学2020届高三10月月考理综化学试题2020届高考化学二轮复习大题精准训练——化学工艺流程专题百所名校联考-化学实验综合题型云南省大理白族自治州祥云县第一中学2020届高三下学期4月月考理综化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分湖北省武汉市华中师范大学第一附属中学2020届高三下学期四月份网络教学质量监测理科综合化学试题四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密10 水溶液中离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河南省商丘市回民中学2022-2023学年高三上学期期末考试(线上)化学试题
10 . 铋酸钠(NaBiO3)是一种可测定锰的强氧化剂。由辉铋矿(主要成分为Bi2S3,含FeS2、SiO2、CuO等杂质)制备NaBiO3的工艺流程如下:
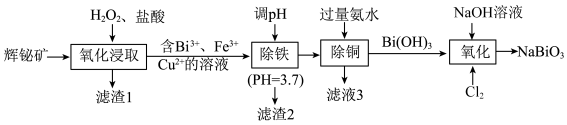
已知:① 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。
②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的pH如表:
回答下列问题:
(1)基态 的3d电子轨道表示式为
的3d电子轨道表示式为___________ 。“滤渣1”的主要成分为___________ (填化学式)。
(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是___________ , 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
(3)已知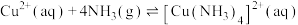 ,
, 中
中 的配位数为
的配位数为___________ ,配体的空间结构为___________ 。
(4)“氧化”过程发生反应的离子方程式为___________ 。
(5)取1.0g制得的 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应
稀溶液,发生反应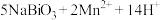
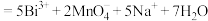 ,完全反应后再用0.1000
,完全反应后再用0.1000 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗23.50mL
,当溶液紫红色恰好褪去时,消耗23.50mL 标准溶液,则产品的纯度为
标准溶液,则产品的纯度为___________ %。
(6)我国科学家对新型二维半导体芯片材料——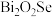 的研究取得了突破性进展。
的研究取得了突破性进展。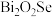 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为bpm,晶体密度为
),已知晶胞为竖直的长方体,高为bpm,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长
为阿伏加德罗常数的值,则晶胞底边边长
___________ (填含b、 、
、 的计算式,不必化简)。
的计算式,不必化简)。


已知:①
 易水解,
易水解, 难溶于冷水,与热水反应,
难溶于冷水,与热水反应, 不溶于水。
不溶于水。②“氧化浸取”时,硫元素转化为硫单质。
③常温下,有关金属离子开始沉淀和沉淀完全的pH如表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 7.6 | 2.7 | 4.8 | 4.5 |
| 沉淀完全的pH | 9.6 | 3.7 | 6.4 | 5.5 |
(1)基态
 的3d电子轨道表示式为
的3d电子轨道表示式为(2)“氧化浸取”过程中,需要控制温度不超过40℃的原因是
 发生反应的化学方程式为
发生反应的化学方程式为(3)已知
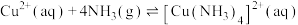 ,
, 中
中 的配位数为
的配位数为(4)“氧化”过程发生反应的离子方程式为
(5)取1.0g制得的
 产品,加入足量稀硫酸和
产品,加入足量稀硫酸和 稀溶液,发生反应
稀溶液,发生反应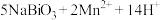
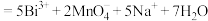 ,完全反应后再用0.1000
,完全反应后再用0.1000 的
的 标准溶液滴定生成的
标准溶液滴定生成的 ,当溶液紫红色恰好褪去时,消耗23.50mL
,当溶液紫红色恰好褪去时,消耗23.50mL 标准溶液,则产品的纯度为
标准溶液,则产品的纯度为(6)我国科学家对新型二维半导体芯片材料——
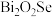 的研究取得了突破性进展。
的研究取得了突破性进展。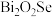 的晶胞结构中
的晶胞结构中 的位置如图所示(略去
的位置如图所示(略去 、
、 ),已知晶胞为竖直的长方体,高为bpm,晶体密度为
),已知晶胞为竖直的长方体,高为bpm,晶体密度为 。设
。设 为阿伏加德罗常数的值,则晶胞底边边长
为阿伏加德罗常数的值,则晶胞底边边长
 、
、 的计算式,不必化简)。
的计算式,不必化简)。
您最近一年使用:0次



