名校
解题方法
1 . 下面的化学方程式或离子方程式中,错误的是
A.为获得性能良好的纳米材料,利用团簇化合物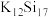 和 和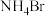 反应制备纳米硅: 反应制备纳米硅: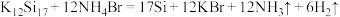 |
B.硒代硫酸根在酸性条件下与一定浓度的 反应: 反应: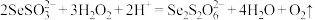 |
C.单质 与 与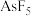 在溶剂 在溶剂 中按计量比6:3反应: 中按计量比6:3反应: |
D.利用 和溴酸根溶液制备高溴酸根: 和溴酸根溶液制备高溴酸根: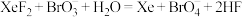 |
您最近一年使用:0次
2022-12-24更新
|
699次组卷
|
3卷引用:辽宁省部分学校2023年普通高等学校招生选择性考试模拟(一)化学试题
名校
解题方法
2 . 含氮化合物对环境、生产和人类活动有很大影响。
(1)氨气具有还原性。将氨气通入灼热的氧化铜固体中,黑色氧化铜变为红色,该过程的化学方程式是__________ 。
(2) 为无色、无味的气体,在潮湿的环境中易变质生成HF、NO、
为无色、无味的气体,在潮湿的环境中易变质生成HF、NO、 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为________ ,N、O、F三种元素的第一电离能从小到大的顺序为____________ ; 分子的VSERP模型为
分子的VSERP模型为_________________ 。
(3)某课题组用间接电解法除NO。其原理如图所示:
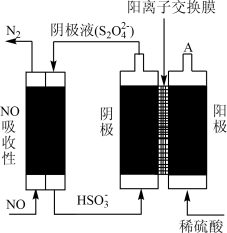
①从A口中出来的物质的是___________ 、_________________ 。
②写出电解池阴极的电极反应式_________________ 。
(1)氨气具有还原性。将氨气通入灼热的氧化铜固体中,黑色氧化铜变为红色,该过程的化学方程式是
(2)
 为无色、无味的气体,在潮湿的环境中易变质生成HF、NO、
为无色、无味的气体,在潮湿的环境中易变质生成HF、NO、 ,该反应中氧化剂与还原剂的物质的量之比为
,该反应中氧化剂与还原剂的物质的量之比为 分子的VSERP模型为
分子的VSERP模型为(3)某课题组用间接电解法除NO。其原理如图所示:

①从A口中出来的物质的是
②写出电解池阴极的电极反应式
您最近一年使用:0次
名校
解题方法
3 . 利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的 ,制取石膏(
,制取石膏( )的过程如下:
)的过程如下:
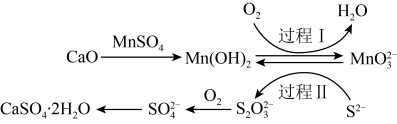
下列说法正确的是
 ,制取石膏(
,制取石膏( )的过程如下:
)的过程如下:
下列说法正确的是
A. 的空间结构名称为正四面体 的空间结构名称为正四面体 |
| B.过程Ⅰ后溶液pH增大 |
C.过程Ⅱ中反应的离子方程式为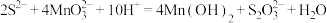 |
D. 属于混合物 属于混合物 |
您最近一年使用:0次
名校
4 . 工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经过高温煅烧NiC2O4制取Ni2O3的流程如图所示
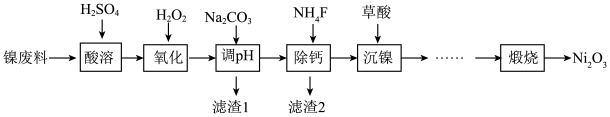
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法_______ (写一种即可)。
(2)加入H2O2发生的主要反应的离子方程式为_______ 。
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为_______ 。
(4)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为_______ 。
(5)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,
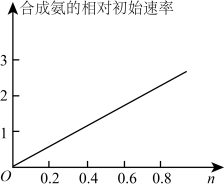
由图可知Co2+、Ni2+两种离子中催化效果更好的是_______ 。

已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法
(2)加入H2O2发生的主要反应的离子方程式为
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为
(4)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为
(5)Ni2O3还可用于制备合成氨的催化剂ConNi(1-n)Fe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图,

由图可知Co2+、Ni2+两种离子中催化效果更好的是
您最近一年使用:0次
2022-12-11更新
|
375次组卷
|
2卷引用:辽宁省沈阳市浑南区东北育才学校2023届高三一模化学试题
5 . 以银量法滴定产生的废液、废渣(主要含有 、
、 等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
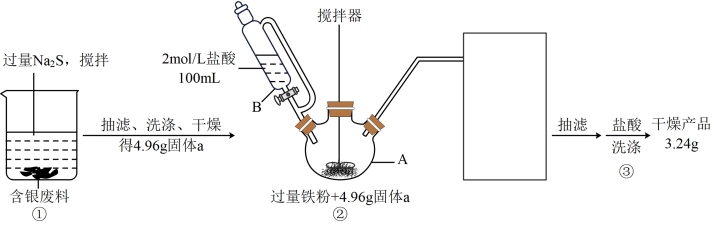
请回答下列问题:
(1)已知银是第五周期元素,与铜同族,写出基态银原子价层电子排布式___________ ;
(2)步骤①中加入过量 的目的是
的目的是___________ ;在获得沉淀时要多搅拌一段时间以获取团聚的沉淀物,该操作对后续处理的意义是___________ ;
(3)仪器B的名称为___________ ;
(4)仪器A中物质在搅拌下充分反应,有臭鸡蛋气味气体产生,并获得黑色不溶物,溶液呈现出浅绿色,写出该反应的离子方程式___________ ;
(5)步骤②图中缺失的尾气处理仪器与药品可选择___________(填序号);
(6)步骤③用盐酸洗涤的目的是___________ ,主要离子反应方程式为___________ ;
(7)利用实验中给出的数据计算本次实验从固体a获得银单质的收率为___________ 。
 、
、 等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
等)为原料,先用沉淀剂充分将银沉出,再还原出单质银,可实现银的回收。实验过程如下:
请回答下列问题:
(1)已知银是第五周期元素,与铜同族,写出基态银原子价层电子排布式
(2)步骤①中加入过量
 的目的是
的目的是(3)仪器B的名称为
(4)仪器A中物质在搅拌下充分反应,有臭鸡蛋气味气体产生,并获得黑色不溶物,溶液呈现出浅绿色,写出该反应的离子方程式
(5)步骤②图中缺失的尾气处理仪器与药品可选择___________(填序号);
A.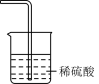 | B.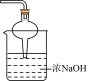 | C.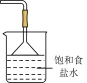 | D.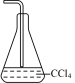 |
(7)利用实验中给出的数据计算本次实验从固体a获得银单质的收率为
您最近一年使用:0次
2022-09-08更新
|
615次组卷
|
3卷引用:辽宁省鞍山市普通高中2022-2023学年高三第一次质量监测化学试题
辽宁省鞍山市普通高中2022-2023学年高三第一次质量监测化学试题云南省部分重点中学2022-2023学年高三上学期月考化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题
6 . 一种利用有机胺(TBA)参与联合生产碳酸氢钠和二氯乙烷的工艺流程如图所示。下列说法错误的是
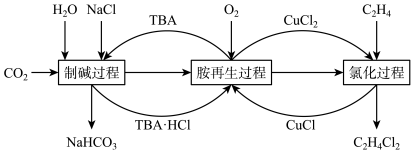
| A.TBA替代了侯德榜制碱法中的氨气 |
B.胺再生过程的反应为 |
| C.整个工艺原子利用率为100%,符合绿色化学的要求 |
D.氯化过程每生成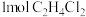 ,总反应中消耗 ,总反应中消耗 |
您最近一年使用:0次
2022-09-05更新
|
685次组卷
|
7卷引用:辽宁省葫芦岛市2024届高三一模化学试题
辽宁省葫芦岛市2024届高三一模化学试题2024届辽宁省葫芦岛市高三下学期一模化学试题福建省福州第一中学2024届高三下学期质量检测化学试题山东省临沂市2022-2023学年高三上学期开学摸底考试化学试题山东省临沂市2021-2022学年高二下学期期末考试化学试题(已下线)上海市华东师范大学第二附属中学2022-2023学年高二上学期12月月考化学试题河北省石家庄市第二十四中学2023-2024高三上学期第一次月考化学试题
名校
解题方法
7 . 废旧太阳能电池CIGS具有较高的回收利用价值,其主要组成为CuIn0.5Ga0.5Se2.某探究小组回收处理流程如图:

回答下列问题:
(1)硒(Se)为第四周期与硫为同族元素,Se的原子序数为_______ ;镓(Ga)和铟(In)位于元素周期表第IIIA族,CuIn0.5Ga0.5Se2中Cu的化合价为_______ 。
(2)“酸浸氧化”发生的主要氧化还原反应的离子方程式为_______ 。
(3)已知:25°C,Kb(NH3·H2O)≈2.0×10−5,Kp[Ga(OH)3]≈1.0×10−35,Ksp[In(OH)3]=1.0×10−33。当金属阳离子浓度小于1.0×10−5 mol∙L−1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为_______ (保留一位小数);为探究Ga(OH)3在氨水中能否溶解,计算反应Ga(OH)3(s)+NH3·H2O [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K=_______ 。(已知:Ga3++4OH- [Ga(OH)4]-,K'=
[Ga(OH)4]-,K'= ≈1.0×1034)
≈1.0×1034)
(4)“回流过滤”中加入的SOCl2是一种液态化合物,极易与水反应,写出SOCl2与水反应的化学反应方程式_______ ;SOCl2的作用是将氢氧化物转化为氯化物和_______ 。
(5)“高温气相沉积”过程中发生的化学反应方程式为_______ 。

回答下列问题:
(1)硒(Se)为第四周期与硫为同族元素,Se的原子序数为
(2)“酸浸氧化”发生的主要氧化还原反应的离子方程式为
(3)已知:25°C,Kb(NH3·H2O)≈2.0×10−5,Kp[Ga(OH)3]≈1.0×10−35,Ksp[In(OH)3]=1.0×10−33。当金属阳离子浓度小于1.0×10−5 mol∙L−1时沉淀完全,In3+恰好完全沉淀时溶液的pH约为
 [Ga(OH)4]-+NH
[Ga(OH)4]-+NH 的平衡常数K=
的平衡常数K= [Ga(OH)4]-,K'=
[Ga(OH)4]-,K'= ≈1.0×1034)
≈1.0×1034)(4)“回流过滤”中加入的SOCl2是一种液态化合物,极易与水反应,写出SOCl2与水反应的化学反应方程式
(5)“高温气相沉积”过程中发生的化学反应方程式为
您最近一年使用:0次
2022-08-20更新
|
398次组卷
|
2卷引用:辽宁省沈阳市法库县高级中学2022届高三下学期4月线上模拟考试化学试题
名校
8 . 工业上常利用软锰矿浆(主要成分是 ,还含有硅、铁和少量重金属镍的化合物等杂质)制备
,还含有硅、铁和少量重金属镍的化合物等杂质)制备 溶液,并以
溶液,并以 溶液为原料制取单质锰及
溶液为原料制取单质锰及 粗产品。
粗产品。
(1) 溶液的制备:
溶液的制备:
①还原:以稀硫酸作介质,纤维素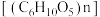 还原
还原 生成
生成 和
和 时,发生反应的化学方程式为
时,发生反应的化学方程式为_______ 。
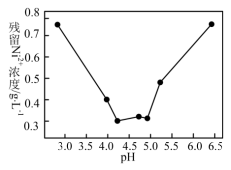
②除杂:除去硅、铁等杂质后,通常用BaS来除去溶液中的镍,pH对除镍效果的影响如图所示。当pH<4.2,pH越小除镍效果越差的原因是_______ 。
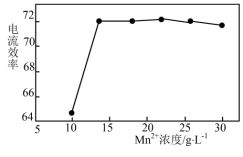
(2)电解法制锰:为保证电解顺利进行,电解液中 必须保持一定的浓度。
必须保持一定的浓度。 浓度和电流效率(电流效率是指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比)的关系如图所示。由图可知当
浓度和电流效率(电流效率是指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比)的关系如图所示。由图可知当 浓度大于
浓度大于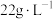 时,电流效率随
时,电流效率随 浓度增大反而下降,其原因是
浓度增大反而下降,其原因是_______ 。
(3) 溶液可得到
溶液可得到 粗产品。通过下列方法测定产品纯度:准确称取3.000g样品,加适量ZnO及
粗产品。通过下列方法测定产品纯度:准确称取3.000g样品,加适量ZnO及 煮沸、冷却,转移至锥形瓶中,用
煮沸、冷却,转移至锥形瓶中,用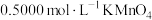 标准溶液滴定至溶液呈红色且半分钟不褪色,消耗标准溶液20.00mL。计算
标准溶液滴定至溶液呈红色且半分钟不褪色,消耗标准溶液20.00mL。计算 样品的纯度(写出计算过程)。
样品的纯度(写出计算过程)。_______ 已知: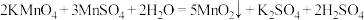
 ,还含有硅、铁和少量重金属镍的化合物等杂质)制备
,还含有硅、铁和少量重金属镍的化合物等杂质)制备 溶液,并以
溶液,并以 溶液为原料制取单质锰及
溶液为原料制取单质锰及 粗产品。
粗产品。(1)
 溶液的制备:
溶液的制备:①还原:以稀硫酸作介质,纤维素
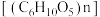 还原
还原 生成
生成 和
和 时,发生反应的化学方程式为
时,发生反应的化学方程式为②除杂:除去硅、铁等杂质后,通常用BaS来除去溶液中的镍,pH对除镍效果的影响如图所示。当pH<4.2,pH越小除镍效果越差的原因是

(2)电解法制锰:为保证电解顺利进行,电解液中
 必须保持一定的浓度。
必须保持一定的浓度。 浓度和电流效率(电流效率是指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比)的关系如图所示。由图可知当
浓度和电流效率(电流效率是指电解时在电极上实际沉积或溶解的物质的量与按理论计算出的析出或溶解量之比)的关系如图所示。由图可知当 浓度大于
浓度大于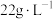 时,电流效率随
时,电流效率随 浓度增大反而下降,其原因是
浓度增大反而下降,其原因是
(3)
 溶液可得到
溶液可得到 粗产品。通过下列方法测定产品纯度:准确称取3.000g样品,加适量ZnO及
粗产品。通过下列方法测定产品纯度:准确称取3.000g样品,加适量ZnO及 煮沸、冷却,转移至锥形瓶中,用
煮沸、冷却,转移至锥形瓶中,用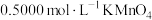 标准溶液滴定至溶液呈红色且半分钟不褪色,消耗标准溶液20.00mL。计算
标准溶液滴定至溶液呈红色且半分钟不褪色,消耗标准溶液20.00mL。计算 样品的纯度(写出计算过程)。
样品的纯度(写出计算过程)。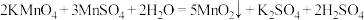
您最近一年使用:0次
2022-07-02更新
|
453次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2022-2023学年高三高考适应性测试(二)化学试题
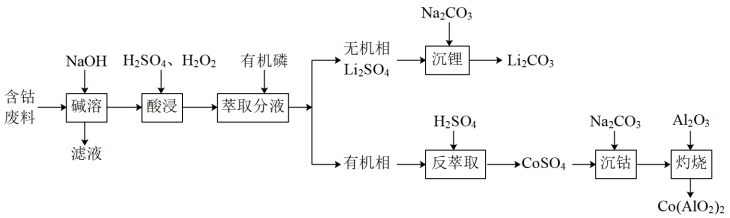
9 . 钴蓝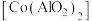 是一种重要的蓝色颜料。利用含钴废料(主要成分为
是一种重要的蓝色颜料。利用含钴废料(主要成分为 ,还含有少量的铝箔)制备钴蓝的一种工艺流程如图:
,还含有少量的铝箔)制备钴蓝的一种工艺流程如图:
已知: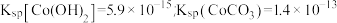
请回答以下问题:
(1)Co元素位于元素周期表第_______ 周期第_______ 族
(2)写出“酸浸”步骤中 发生反应的化学方程式
发生反应的化学方程式_______ ;在实际生产中,“酸浸”不用盐酸的原因是_______
(3)已知钴、锂在有机磷萃取剂中的萃取率与pH的关系如图1所示,则有机磷萃取的最佳pH为_______
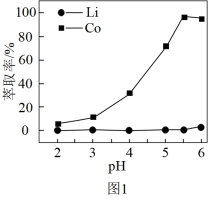
(4)根据图2判断,“沉锂”步骤中获取 的操作依次是
的操作依次是_______ 、_______ 、洗涤、干燥

(5)若 溶液中
溶液中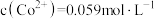 ,为防止沉钴过程中产生
,为防止沉钴过程中产生 沉淀,需控制溶液的pH不高于
沉淀,需控制溶液的pH不高于_______ (保留一位小数)
(6)写出灼烧过程中主要反应的化学方程式_______
 是一种重要的蓝色颜料。利用含钴废料(主要成分为
是一种重要的蓝色颜料。利用含钴废料(主要成分为 ,还含有少量的铝箔)制备钴蓝的一种工艺流程如图:
,还含有少量的铝箔)制备钴蓝的一种工艺流程如图:
已知:
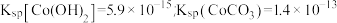
请回答以下问题:
(1)Co元素位于元素周期表第
(2)写出“酸浸”步骤中
 发生反应的化学方程式
发生反应的化学方程式(3)已知钴、锂在有机磷萃取剂中的萃取率与pH的关系如图1所示,则有机磷萃取的最佳pH为

(4)根据图2判断,“沉锂”步骤中获取
 的操作依次是
的操作依次是
(5)若
 溶液中
溶液中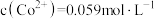 ,为防止沉钴过程中产生
,为防止沉钴过程中产生 沉淀,需控制溶液的pH不高于
沉淀,需控制溶液的pH不高于(6)写出灼烧过程中主要反应的化学方程式
您最近一年使用:0次
解题方法
10 . 七钼酸铵[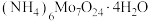 ]在超导、激光等高科技领域中发挥着重要作用。由钼焙砂(主要成分为
]在超导、激光等高科技领域中发挥着重要作用。由钼焙砂(主要成分为 、
、 ,含有CuO、
,含有CuO、 、
、 等杂质)制备七钼酸铵的工艺流程如图所示。
等杂质)制备七钼酸铵的工艺流程如图所示。
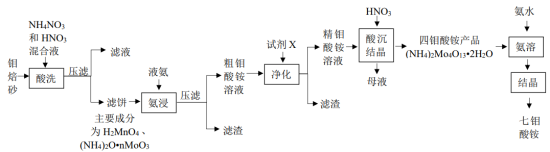
请回答下列问题:
(1)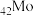 的价电子排布式为
的价电子排布式为_______ 。
(2)“酸洗”时 被稀
被稀 氧化为
氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为_______ ;酸洗加入硝酸铵的目的,除提供反应需要的 外,其主要作用是
外,其主要作用是_______ 。
(3)“净化”步骤的目的是进一步除去少量残留的 ,若试剂X为FeS,反应的离子方程式为
,若试剂X为FeS,反应的离子方程式为_______ ;该反应的平衡常数值为_______ 。
[已知: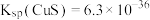 ,
,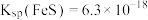 ]
]
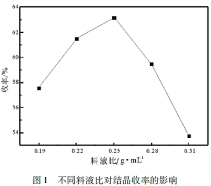
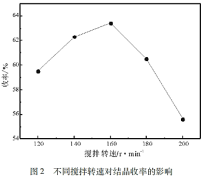
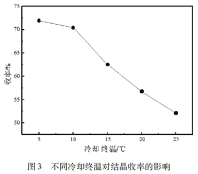
(4)酸沉结晶后得到的母液经处理后可返回_______ 工序继续使用。
(5)四钼酸铵溶于氨水中后通过降温结晶的方式得到七钼酸铵。由下图可知,应选用最佳结晶条件为_______ 。
(6)某工厂用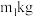 钼焙砂(含
钼焙砂(含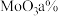 、
、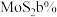 )制备
)制备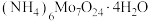 ,最终得到产品
,最终得到产品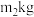 ,产率为
,产率为_______ (写出表达式)。
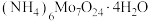 ]在超导、激光等高科技领域中发挥着重要作用。由钼焙砂(主要成分为
]在超导、激光等高科技领域中发挥着重要作用。由钼焙砂(主要成分为 、
、 ,含有CuO、
,含有CuO、 、
、 等杂质)制备七钼酸铵的工艺流程如图所示。
等杂质)制备七钼酸铵的工艺流程如图所示。
请回答下列问题:
(1)
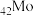 的价电子排布式为
的价电子排布式为(2)“酸洗”时
 被稀
被稀 氧化为
氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为 外,其主要作用是
外,其主要作用是(3)“净化”步骤的目的是进一步除去少量残留的
 ,若试剂X为FeS,反应的离子方程式为
,若试剂X为FeS,反应的离子方程式为[已知:
 ,
,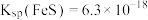 ]
](4)酸沉结晶后得到的母液经处理后可返回
(5)四钼酸铵溶于氨水中后通过降温结晶的方式得到七钼酸铵。由下图可知,应选用最佳结晶条件为



(6)某工厂用
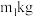 钼焙砂(含
钼焙砂(含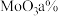 、
、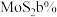 )制备
)制备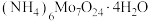 ,最终得到产品
,最终得到产品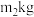 ,产率为
,产率为
您最近一年使用:0次



