名校
解题方法
1 . “NaH2PO2还原法”制备高纯度氢碘酸和亚磷酸钠(Na2HPO3)的工业流程如图。

请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为______________ 。
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为_____________ 。
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为___________ (填化学式)。
(4)“调pH=11”的作用为__________ 。
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:

①a为电源______ (填“正极”或“负极”)。
②B膜应选择___________ (填“阴离子”“质子”或“阳离子”)交换膜。
③阳极的电极反应式为____________ 。

请回答:
(1)“合成”过程,主要氧化产物为亚磷酸(H3PO3),相应的化学方程式为
(2)“除铅”过程,FeS除去微量Pb2+的离子方程式为
(3)“减压蒸馏”过程,I-回收率为95%,则剩余固体的主要成分为
(4)“调pH=11”的作用为
(5)工业上常用电解Na2HPO3溶液制备亚磷酸,其装置示意图:

①a为电源
②B膜应选择
③阳极的电极反应式为
您最近一年使用:0次
2020-06-20更新
|
500次组卷
|
2卷引用:黑龙江省哈尔滨第三中学2021届高三第二次模拟考试理科综合化学试题
名校
解题方法
2 . 铋酸钠(NaBiO3)常用作Mn2+鉴定的强氧化剂,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如图:
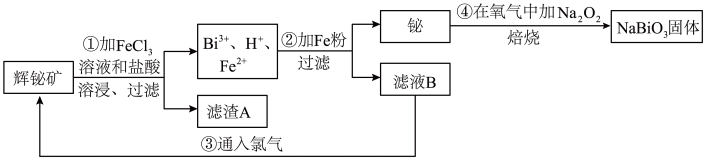
已知:①NaBiO3是一种难溶于水的物质
②BiCl3极易水解生成不溶性的BiOCl沉淀
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有___ (填标号)。
a.加入足量的蒸馏水b.搅拌c.粉碎矿石d.降低温度
(2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是___ ,滤渣A的主要成分为___ (填化学式)。
(3)反应④的化学方程式为___ 。
(4)NaBiO3可在酸性介质中将Mn2+氧化为MnO ,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为
,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为___ 。
(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要___ 。
(6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液进行滴定,滴定完成后消耗24.80mLFeSO4溶液。则该样品中NaBiO3纯度为___ %(结果保留小数点后一位)。

已知:①NaBiO3是一种难溶于水的物质
②BiCl3极易水解生成不溶性的BiOCl沉淀
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有
a.加入足量的蒸馏水b.搅拌c.粉碎矿石d.降低温度
(2)溶浸时通常加入FeCl3溶液和浓盐酸,加入的浓盐酸需过量的目的是
(3)反应④的化学方程式为
(4)NaBiO3可在酸性介质中将Mn2+氧化为MnO
 ,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为
,故可用于Mn2+的鉴定。已知NaBiO3被还原为Bi3+,该反应的离子方程式为(5)实验室为了测定NaBiO3样品的纯度,需要配制250mL0.500mol/LFeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要
(6)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,稀释至100mL,取出20.00mL溶液,然后用新配制的0.500mol/LFeSO4溶液进行滴定,滴定完成后消耗24.80mLFeSO4溶液。则该样品中NaBiO3纯度为
您最近一年使用:0次
2020-06-17更新
|
441次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2020届高三6月复课线下考查理综化学试题
解题方法
3 . 用一种硫化矿(含45%SiO2、20.4% Al2O3、30%FeS和少量GeS2等)制取盆景肥料NH4Fe(SO4)2及铝硅合金材料的工艺流程如下 :
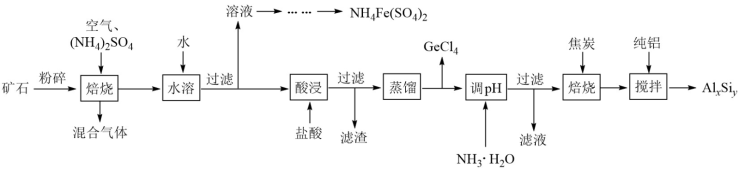
(1)“矿石”粉碎的目的是_____________________ 。
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为____________________ 。
②“混合气体”的主要成分是_______________ (填化学式).
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为_______________ 。 Al2O3也能发生类似反应.这两种氧化物转化为硫酸盐的转化率与温度的关系如图,上述流程中最适宜的“焙烧” 温度为_____________________ 。

(3)GeCl4的沸点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是_________ 。
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为______________________ 。
(5)假设流程中SiO2损失了20%,Al2O3损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=______________ 。

(1)“矿石”粉碎的目的是
(2)“混合气体”经过水吸收和空气氧化能再次利用。
①“焙烧”时,GeS2发生反应的化学方程式为
②“混合气体”的主要成分是
③FeS焙烧产生的Fe2O3会与(NH4)2SO4反应生成NH4Fe(SO4)2,该反应的化学方程式为

(3)GeCl4的沸点低,可在酸性条件下利用蒸馏的方法进行分离,酸性条件的目的是
(4)用电解氧化法可以增强合金 AlxSiy的防腐蚀能力,电解后在合金表面形成致密、耐腐蚀的氧化膜(主要成分为Al2O3), 电解质溶液为 H2SO4-H2C2O4混合溶液,阳极的电极反应式为
(5)假设流程中SiO2损失了20%,Al2O3损失了25%,当投入1 t硫化矿,加入了54kg纯铝时,铝硅合金中x:y=
您最近一年使用:0次
2020-06-11更新
|
299次组卷
|
2卷引用:黑龙江省部分学校2020届高三5月联考理综化学试题
名校
解题方法
4 . 某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。

回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__ ,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__ 。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__ ,浸取后过滤得到的滤渣的化学式为__ 。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__ ,检验Fe3+是否完全被还原,应选择__ (填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__ 。
(5)加入NH4HCO3生成FeCO3的离子方程式为__ ,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__ 。

回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为
(5)加入NH4HCO3生成FeCO3的离子方程式为
您最近一年使用:0次
解题方法
5 . 一种由明矾石[主要成分:KAl3(SO4)2(OH)6]和地开石[主要成分:Al4(Si4O10)(OH)8]提取K2SO4和Al的工艺流程:

已知:K2SO4在不同温度下的溶解度
回答下列问题:
(1)硫酸熟化工艺是指浓硫酸在矿物颗粒表面均匀分布并向内扩散的过程,该过程中矿物颗粒_____ (填“是”或“不是”)越细越好。
(2)完成并配平还原焙烧时明矾石与硫反应的化学方程式:________
 KAl3(SO4)2(OH)6+
KAl3(SO4)2(OH)6+ S→
S→ K2SO4+
K2SO4+ Al2O3+
Al2O3+ ___________+
___________+ H2O
H2O
(3)从水浸后的滤液中得到K2 SO4晶体的操作a是_____ ,写出K2SO4的一种用途 _____ .
(4)碱浸过程中发生的主要反应的离子方程式为____ 、 ____ 。
(5)流程中制Al的化学方程式为________________________
(6)现利用还原焙烧产生的SO2来生产硫酸。若明矾石的质量为41.4t,主要成分含量为50%,SO2的利用率为96%,则可生产质量分数为98%的硫酸____ t。[KAl3(SO4)2(OH)6的相对分子质量为414]

已知:K2SO4在不同温度下的溶解度
| 温度/℃ | 10 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 9.3 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
回答下列问题:
(1)硫酸熟化工艺是指浓硫酸在矿物颗粒表面均匀分布并向内扩散的过程,该过程中矿物颗粒
(2)完成并配平还原焙烧时明矾石与硫反应的化学方程式:
 KAl3(SO4)2(OH)6+
KAl3(SO4)2(OH)6+ S→
S→ K2SO4+
K2SO4+ Al2O3+
Al2O3+ ___________+
___________+ H2O
H2O(3)从水浸后的滤液中得到K2 SO4晶体的操作a是
(4)碱浸过程中发生的主要反应的离子方程式为
(5)流程中制Al的化学方程式为
(6)现利用还原焙烧产生的SO2来生产硫酸。若明矾石的质量为41.4t,主要成分含量为50%,SO2的利用率为96%,则可生产质量分数为98%的硫酸
您最近一年使用:0次
6 . 硫代硫酸钠 (Na2S2O3)在生产生活中具有广泛应用。硫化碱法是工业上制取硫代硫酸钠的方法之一。实验室模拟工业生产装置如图所示:_______ 。
(2)装置B中生成的Na2S2O3同时还生成CO2,反应的离子方程式为_______ ;在该装置中使用多孔球泡的目的是_____ 。
(3)装置C的作用是检验装置B中SO2的吸收效果,C中可选择的试剂是__ (填字母)。
a.H2O2溶液 b.溴水 c.KMnO4溶液 d.BaCl2溶液
(4)Na2S2O3溶液常用于测定废水中Ba2+浓度。
①取废水20.00mL,控制适当的酸度,加入足盐K2Cr2O7溶液,得到 BaCrO4沉淀,过滤洗涤后用适量稀酸溶解,此时 CrO42-全部转化为Cr2O72-;再加过量 KI溶液,将Cr2O72-充分反应;然后加入淀粉溶液作指示剂,用0.100 mol/L的Na2S2O3溶液进行滴定:(I2 +2 S2O32-= S4O62-+ 2I-),滴定终点的现象为__________ 。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00mL。则该废水中Ba2+的物质的量浓度为____ mol/L,
②在滴定过程中,下列实验操作会造成实验结果偏高的是______ (填字母)。
a.滴定管未用Na2S2O3溶液润洗
b.滴定终点时俯视读数
c.锥形瓶用蒸馏水洗涤后未进行干燥处理
d.滴定管尖嘴处滴定前无气泡,滴定终点发现有气泡

(2)装置B中生成的Na2S2O3同时还生成CO2,反应的离子方程式为
(3)装置C的作用是检验装置B中SO2的吸收效果,C中可选择的试剂是
a.H2O2溶液 b.溴水 c.KMnO4溶液 d.BaCl2溶液
(4)Na2S2O3溶液常用于测定废水中Ba2+浓度。
①取废水20.00mL,控制适当的酸度,加入足盐K2Cr2O7溶液,得到 BaCrO4沉淀,过滤洗涤后用适量稀酸溶解,此时 CrO42-全部转化为Cr2O72-;再加过量 KI溶液,将Cr2O72-充分反应;然后加入淀粉溶液作指示剂,用0.100 mol/L的Na2S2O3溶液进行滴定:(I2 +2 S2O32-= S4O62-+ 2I-),滴定终点的现象为
②在滴定过程中,下列实验操作会造成实验结果偏高的是
a.滴定管未用Na2S2O3溶液润洗
b.滴定终点时俯视读数
c.锥形瓶用蒸馏水洗涤后未进行干燥处理
d.滴定管尖嘴处滴定前无气泡,滴定终点发现有气泡
您最近一年使用:0次
2020-04-09更新
|
593次组卷
|
5卷引用:东北三省四市教研联合体2019届高考模拟试卷(一)理综化学试题
东北三省四市教研联合体2019届高考模拟试卷(一)理综化学试题(已下线)2020年高考化学押题预测卷02(新课标Ⅲ卷)--《2020年高考押题预测卷》江苏省徐州市2023-2024学年高三第四次模拟考试化学试卷 安徽省黄山市屯溪第一中学2019-2020学年高二下学期入学考试化学试题四川省绵阳市南山中学2020-2021学年高二下学期开学考试化学试题
名校
解题方法
7 . 磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____ 列;As原子能量最高的3个轨道在空间相互____ ;1个黄砷(As4)分子中含有_____ 个As﹣As键,键角_____ 度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____ (选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____ (选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___ H2O →____ Ni+____ H2PO3﹣+___ H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______ 。
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
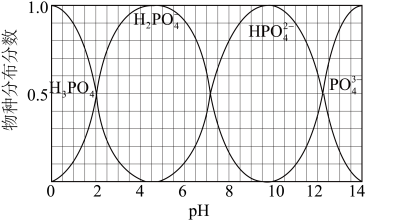
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________ 。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________ 。
(1)砷(As)元素位于元素周期表第
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。

①pH=8时,溶液中主要含磷物种浓度大小关系为
②为获得尽可能纯的NaH2PO4,pH应控制在
您最近一年使用:0次
2020-03-24更新
|
168次组卷
|
2卷引用:黑龙江绥化市第一中学2021-2022学年高三下学期临考冲刺化学试题
解题方法
8 . 炼锌厂的铜镉废渣中含有铜、锌、镉、铁、砷等元素,其含量依次减少。对这些元素进行提取分离会减小环境污染,同时制得ZnSO4·7H2O实现资源的再利用,其流程图如下。已知FeAsO4难溶于水和酸;ZnSO4·7H2O易溶于水,难溶于酒精。

常温下金属离子沉淀的pH
请回答下列问题:
(1)提高浸出速率可以采用的方法是(写出其中一点即可)________ 。
(2)滤液Ⅰ中有少量AsO33—,若不除去,则AsO33—与Cd反应会产生一种有毒氢化物气体,其分子式为____ ,向滤液Ⅰ中逐滴滴入酸性KMnO4溶液可与AsO33—反应生成FeAsO4,完成并配平下列反应的离子方程式___ :Fe2++AsO33—+MnO4—+___=FeAsO4↓+Mn2++__,判断该滴定终点的现象是__________ 。
(3)流程中②调节pH时可以选用的试剂为________ ,滤渣Ⅱ的成分为________ 。
(4)常温下Zn(OH)2的溶度积Ksp=________ 。
(5)制得的ZnSO4·7H2O需洗涤,洗涤晶体时可选用试剂为________ 。

常温下金属离子沉淀的pH
| 金属离子 | Fe3+ | Zn2+ | Mn2+ | Cu2+ | Cd2+ |
| 开始沉淀pH | 2.7 | 6.5 | 7.7 | 5.2 | 6.9 |
| 沉淀完全pH | 3.2 | 8.0 | 9.8 | 6.4 | 9.4 |
(1)提高浸出速率可以采用的方法是(写出其中一点即可)
(2)滤液Ⅰ中有少量AsO33—,若不除去,则AsO33—与Cd反应会产生一种有毒氢化物气体,其分子式为
(3)流程中②调节pH时可以选用的试剂为
(4)常温下Zn(OH)2的溶度积Ksp=
(5)制得的ZnSO4·7H2O需洗涤,洗涤晶体时可选用试剂为
您最近一年使用:0次
2020-03-14更新
|
216次组卷
|
4卷引用:2017届东北三省四市高三高考第二次模拟考试理综化学试卷
2017届东北三省四市高三高考第二次模拟考试理综化学试卷吉林省长春市2017届高三下学期第三次模拟考试理综化学试题四川省成都市实验中学2020届高三上学期第十八次周考理科综合化学试题(已下线)第5单元 常见的金属元素(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
名校
9 . 下列离子方程式的书写及评价均正确的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将1molCl2通入到含1molFeI2溶液中: 2Fe2++2I﹣+2Cl2═2Fe3++4Cl﹣+I2 | 正确;Cl2过量,可将Fe2+、I﹣均氧化 |
| B | 1mol•L﹣1的NaAlO2溶液和2.5 mol•L﹣1的HCl溶液等体积互相均匀混合: 2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O | 正确;AlO2﹣与Al(OH)3消耗的H+的物质的量之比为2:3 |
| C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO﹣═HClO+HSO3﹣ | 正确;说明酸性:H2SO3强于HClO |
| D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-11-23更新
|
1511次组卷
|
18卷引用:【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题
【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题辽宁省丹东市2018届高三一模考试理综-化学试题【全国校级联考】山东省七校联合体2018届高三第二次联考理科综合化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题1【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题2江西省师范大学附属中学2018届高三10月月考化学试题江西省赣州寻乌县二中2018届高三上学期期中考试化学试卷广东省惠州市燕岭学校2019届高三8月月考化学试题【全国百强校】河北省武邑中学2019届高三上学期第一次调研考试化学试题辽宁省葫芦岛协作校2019届高三上学期第一次月考化学试题山东省泰安市第一中学2020届高三10月月考化学试题山东省莱州市第一中学2020届高三10月月考化学试题山东省泰安市宁阳县第一中学2020届高三上学期第二次段考化学试题辽宁省大连海湾高级中学2019-2020学年高三上学期期中考试化学试题安徽省宿州市灵璧中学2019-2020学年度高三上学期第三次月考化学试题(已下线)专题2.2 离子反应-巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》(已下线)考点04 离子反应-2020年高考化学命题预测与模拟试题分类精编陕西省西安市长安区第一中学2021届高三上学期第二次月考化学试题
名校
10 . 粗铜精炼后的阳极泥含有Cu、Ag和Au(金)等。湿法处理阳极泥的一种工艺流程如下:

(1)在粗铜精炼过程中,粗铜与电源的__________ 极(填正、负)连接;阴极的电极反应式为______________________________________________________ 。
(2)在浸铜过程中,浸铜反应的离子方程式为_______________________________________________________ ,
生产中实际需要H2O2的量要远远超过浸铜所需的理论用量,可能的原因是________________________________________________ 。
(3)已知:浸金时,Au转化为AuCl4-。在理论上,提取金的过程中反应消耗NaClO3和H2C2O4的物质的量之比为__________ 。
(4)已知: 浸银时发生反应AgCl+2SO32- Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
①为减少废液排放,充分利用资源,向浸银残液中通入气体X得到Na2SO3再生液,X是__________ 。
②在提取银过程中,其他条件不变,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示。

试结合平衡移动原理,解释产生这种变化的原因_____________________________________________ 。

(1)在粗铜精炼过程中,粗铜与电源的
(2)在浸铜过程中,浸铜反应的离子方程式为
生产中实际需要H2O2的量要远远超过浸铜所需的理论用量,可能的原因是
(3)已知:浸金时,Au转化为AuCl4-。在理论上,提取金的过程中反应消耗NaClO3和H2C2O4的物质的量之比为
(4)已知: 浸银时发生反应AgCl+2SO32-
 Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。①为减少废液排放,充分利用资源,向浸银残液中通入气体X得到Na2SO3再生液,X是
②在提取银过程中,其他条件不变,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示。

试结合平衡移动原理,解释产生这种变化的原因
您最近一年使用:0次
2019-04-15更新
|
462次组卷
|
3卷引用:黑龙江省大庆铁人中学2021届高三第四次模拟考试化学试题
黑龙江省大庆铁人中学2021届高三第四次模拟考试化学试题【区级联考】北京市顺义区2019届高三下学期第二次统练化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题02-2020年北京新高考化学模拟试题



