名校
1 . 锰的化合物在工业、医疗等领域有重要应用。某兴趣小组设计实验模拟制备KMnO4及探究Mn2+能否氧化为 。
。
Ⅰ. 的制备:
的制备:
步骤一:
步骤二: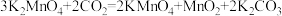
实验操作:
步骤一:将一定比例的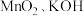 和
和 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性
固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性 溶液放入烧杯C中。
溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取 晶体。
晶体。
装置图如下:

(1)B中试剂的作用_______ 。
(2)反应结束后,未及时分离 晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是
晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是_______ 。
Ⅱ.该小组继续探究 能否氧化为
能否氧化为 ,进行了下列实验:
,进行了下列实验:
已知:ⅰ. 为棕黑色固体,难溶于水;
为棕黑色固体,难溶于水;
ⅱ. 在酸性环境下缓慢分解产生
在酸性环境下缓慢分解产生 。
。
(3)实验①中生成棕黑色沉淀可能的原因_______ 。
(4)实验②中迅速生成棕黑色沉淀的离子方程式_______ 。
(5)实验③说明_______ 。
(6)甲同学猜测实验④中紫红色消失的原因:酸性条件下 不稳定,分解产生了
不稳定,分解产生了 ,乙同学认为不成立,理由是
,乙同学认为不成立,理由是_______ ;乙同学认为是溶液中剩余的 将
将 还原,并设计了实验方案证明此推测成立,其方案为
还原,并设计了实验方案证明此推测成立,其方案为_______ 。
探究结果:在酸性条件下,某些强氧化剂可以将 氧化为
氧化为 。
。
 。
。Ⅰ.
 的制备:
的制备:步骤一:

步骤二:
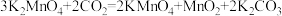
实验操作:
步骤一:将一定比例的
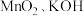 和
和 固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性
固体混合加热,得到墨绿色的固体,冷却后加水溶解得到碱性 溶液放入烧杯C中。
溶液放入烧杯C中。步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取
 晶体。
晶体。装置图如下:

(1)B中试剂的作用
(2)反应结束后,未及时分离
 晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是
晶体,发现C中紫红色溶液变浅。出现这一现象可能的原因是Ⅱ.该小组继续探究
 能否氧化为
能否氧化为 ,进行了下列实验:
,进行了下列实验:| 装置图 | 试剂X | 实验现象 |
 | ① 溶液 溶液 | 生成浅棕色沉淀,一段时间后变为棕黑色 |
② 和 和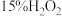 混合液 混合液 | 立即生成棕黑色沉淀 | |
③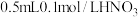 溶液 溶液 | 无明显现象 | |
④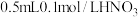 溶液和少量 溶液和少量 | 滴加 无明显现象,加入 无明显现象,加入 立即变为紫红色,稍后紫红色很快消失,生成棕黑色沉淀 立即变为紫红色,稍后紫红色很快消失,生成棕黑色沉淀 |
 为棕黑色固体,难溶于水;
为棕黑色固体,难溶于水;ⅱ.
 在酸性环境下缓慢分解产生
在酸性环境下缓慢分解产生 。
。(3)实验①中生成棕黑色沉淀可能的原因
(4)实验②中迅速生成棕黑色沉淀的离子方程式
(5)实验③说明
(6)甲同学猜测实验④中紫红色消失的原因:酸性条件下
 不稳定,分解产生了
不稳定,分解产生了 ,乙同学认为不成立,理由是
,乙同学认为不成立,理由是 将
将 还原,并设计了实验方案证明此推测成立,其方案为
还原,并设计了实验方案证明此推测成立,其方案为探究结果:在酸性条件下,某些强氧化剂可以将
 氧化为
氧化为 。
。
您最近一年使用:0次
名校
解题方法
2 . 海水中蕴含着丰富的资源,氯碱工业、海水提镁、海水提溴为人类提供了大量的工业原料。
(1)海水提溴过程中溴元素的变化如图所示:

①过程Ⅱ中,用热空气将溴吹出,再用浓碳酸钠溶液吸收。完成并配平下列化学方程式:_______ 。

② 是一种分析试剂。向硫酸酸化的
是一种分析试剂。向硫酸酸化的 溶液中逐滴加入
溶液中逐滴加入 溶液,当加入
溶液,当加入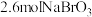 时,测得反应后溶液中溴和碘的存在形式及物质的量如下表。则原溶液中
时,测得反应后溶液中溴和碘的存在形式及物质的量如下表。则原溶液中 的物质的量是
的物质的量是_______  。
。
(2)海水中提取镁的传统工艺如下图所示:
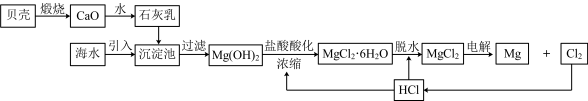
① 脱水得到
脱水得到 的过程中,通入
的过程中,通入 的作用是
的作用是_______ 。
②实验室模拟该工艺, 时,在沉镁的过程中,将
时,在沉镁的过程中,将 溶液滴加到
溶液滴加到 悬浊液中,当混合溶液中
悬浊液中,当混合溶液中 时,同时存在
时,同时存在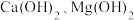 两种沉淀,则此时溶液中
两种沉淀,则此时溶液中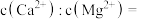
_______ 。判断此时
_______ (填“是”或“否”)完全沉淀。(已知: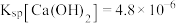 ,
,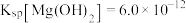 ;当某离子浓度降到
;当某离子浓度降到 以下时,认为该离子已经完全沉淀。)
以下时,认为该离子已经完全沉淀。)
③工业制备镁的新工艺已经广泛应用,其第一步原理是向含氧化镁的熔浆中添加三氯化铈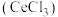 再通入氯气,生成
再通入氯气,生成 和无水氯化镁。请写出该反应的化学方程式
和无水氯化镁。请写出该反应的化学方程式_______ 。
④某实验小组对 进行热重曲线分析:
进行热重曲线分析:

分析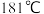 时固体产物的化学式为
时固体产物的化学式为_______ 。写出从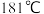 加热到
加热到 时生成固体产物(一种含镁的碱式盐)的化学方程式
时生成固体产物(一种含镁的碱式盐)的化学方程式_______ 。
(1)海水提溴过程中溴元素的变化如图所示:

①过程Ⅱ中,用热空气将溴吹出,再用浓碳酸钠溶液吸收。完成并配平下列化学方程式:

②
 是一种分析试剂。向硫酸酸化的
是一种分析试剂。向硫酸酸化的 溶液中逐滴加入
溶液中逐滴加入 溶液,当加入
溶液,当加入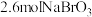 时,测得反应后溶液中溴和碘的存在形式及物质的量如下表。则原溶液中
时,测得反应后溶液中溴和碘的存在形式及物质的量如下表。则原溶液中 的物质的量是
的物质的量是 。
。| 粒子 |  |  |  |
物质的量/ | 0.5 | 1.3 | ? |

①
 脱水得到
脱水得到 的过程中,通入
的过程中,通入 的作用是
的作用是②实验室模拟该工艺,
 时,在沉镁的过程中,将
时,在沉镁的过程中,将 溶液滴加到
溶液滴加到 悬浊液中,当混合溶液中
悬浊液中,当混合溶液中 时,同时存在
时,同时存在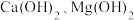 两种沉淀,则此时溶液中
两种沉淀,则此时溶液中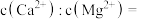

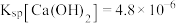 ,
,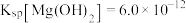 ;当某离子浓度降到
;当某离子浓度降到 以下时,认为该离子已经完全沉淀。)
以下时,认为该离子已经完全沉淀。)③工业制备镁的新工艺已经广泛应用,其第一步原理是向含氧化镁的熔浆中添加三氯化铈
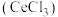 再通入氯气,生成
再通入氯气,生成 和无水氯化镁。请写出该反应的化学方程式
和无水氯化镁。请写出该反应的化学方程式④某实验小组对
 进行热重曲线分析:
进行热重曲线分析:
分析
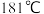 时固体产物的化学式为
时固体产物的化学式为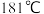 加热到
加热到 时生成固体产物(一种含镁的碱式盐)的化学方程式
时生成固体产物(一种含镁的碱式盐)的化学方程式
您最近一年使用:0次
名校
3 . 利用雾霾中的污染物NO、SO2获得产品NH4NO3的流程图如图,下列方程式错误的是
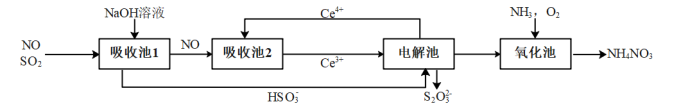

A.“吸收池1”中反应的离子方程式: |
B.“吸收池2”中生成等物质的量HNO2和HNO3的离子方程式: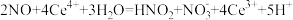 |
C.“电解池”中阴极的电极反应式: |
D.“氧化池”中反应的离子方程式: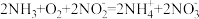 |
您最近一年使用:0次
名校
解题方法
4 . 钛铁矿( ,其中Ti为
,其中Ti为 价)在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示。下列说法正确的是
价)在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示。下列说法正确的是
 ,其中Ti为
,其中Ti为 价)在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示。下列说法正确的是
价)在高温下经氯化得到四氯化钛,再制取金属钛的流程如图所示。下列说法正确的是
A.氯化反应中 与C的物质的量之比为1∶1 与C的物质的量之比为1∶1 |
B.氯化过程中 既不是氧化剂也不是还原剂 既不是氧化剂也不是还原剂 |
C.根据制取金属钛的反应可得出还原性: |
| D.制取金属钛时选用Ar气的目的是隔绝空气 |
您最近一年使用:0次
2023-03-10更新
|
387次组卷
|
3卷引用:黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试卷(二)
名校
解题方法
5 . 四氯化碳( )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:

已知:
① 可与溴水反应生成硫酸和氢溴酸:
可与溴水反应生成硫酸和氢溴酸:
② 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
⑧硫单质的沸点445℃, 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6g/cm3。
的沸点76.8℃、密度1.6g/cm3。
(1) 分子的空间结构为
分子的空间结构为______ 。
(2)上述仪器的连接顺序为:a→______→______→______→______→______→______→______→______。______ 。
A装置中导管k的作用为______ 。在制备气体的实验中若用普通的分液漏斗,在其他条件相同的情况下,从装置A中排出气体的体积与本实验相比______ (填“偏大”“偏小”或“不变”)。
(3)B装置中发生反应的化学方程式为______ 。
(4)实验过程中F装置的作用有______ 、______ 。反应结束后关闭 、
、 ,此时F装置的作用为
,此时F装置的作用为______ 。
(5)反应结束先过滤除去固体,再经过______ (填操作名称)可得到 。
。
 )主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:
)主要用作优良的溶剂、灭火剂、制冷剂、萃取剂等。某化学小组模拟工业原理,用二硫化碳与氯气反应制取四氯化碳,所用实验各部分装置如下:
已知:
①
 可与溴水反应生成硫酸和氢溴酸:
可与溴水反应生成硫酸和氢溴酸:②
 与
与 在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;
在铁作催化剂的条件下,在85℃~95℃反应可生成四氯化碳;⑧硫单质的沸点445℃,
 的沸点46.5℃,
的沸点46.5℃, 的沸点76.8℃、密度1.6g/cm3。
的沸点76.8℃、密度1.6g/cm3。(1)
 分子的空间结构为
分子的空间结构为(2)上述仪器的连接顺序为:a→______→______→______→______→______→______→______→______。
A装置中导管k的作用为
(3)B装置中发生反应的化学方程式为
(4)实验过程中F装置的作用有
 、
、 ,此时F装置的作用为
,此时F装置的作用为(5)反应结束先过滤除去固体,再经过
 。
。
您最近一年使用:0次
解题方法
6 . 我国科学家开发催化剂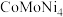 来提高
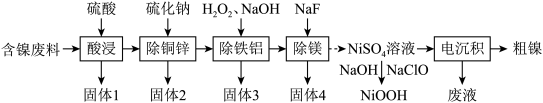
来提高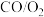 燃料电池的性能。某小组以含镍废料(主要含
燃料电池的性能。某小组以含镍废料(主要含 、
、 ,以及少量
,以及少量 、
、 、
、 、
、 、
、 、
、 和
和 等)为原料提取镍的流程如下:
等)为原料提取镍的流程如下:
已知常温下部分难溶物的 如表所示:
如表所示:
请回答下列问题:
(1)“酸浸”中产生了一种还原性气体,它是_______ (填化学式);“除铁铝”中双氧水的作用是_______ 。
(2)“固体2”中除 、
、 外,还可能含硫单质等物质,生成硫单质的离子方程式为
外,还可能含硫单质等物质,生成硫单质的离子方程式为_______ 。
(3)为提高原料利用率,“电沉积”得到的“废液”可以循环用于_______ (填名称)工序。
(4)常温下,在“除铁铝”中,当滤液中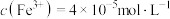 时,其
时,其
_______ 。
(5)可以通过电解法提纯镍,粗镍作_______ (填“阳”或“阴”)极,阴极的电极反应式为_______ 。
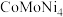 来提高
来提高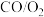 燃料电池的性能。某小组以含镍废料(主要含
燃料电池的性能。某小组以含镍废料(主要含 、
、 ,以及少量
,以及少量 、
、 、
、 、
、 、
、 、
、 和
和 等)为原料提取镍的流程如下:
等)为原料提取镍的流程如下:
已知常温下部分难溶物的
 如表所示:
如表所示:| 物质 |  |  |  |  |  |  |  |
 |  | 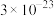 | 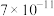 | 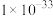 | 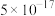 | 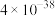 | 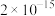 |
(1)“酸浸”中产生了一种还原性气体,它是
(2)“固体2”中除
 、
、 外,还可能含硫单质等物质,生成硫单质的离子方程式为
外,还可能含硫单质等物质,生成硫单质的离子方程式为(3)为提高原料利用率,“电沉积”得到的“废液”可以循环用于
(4)常温下,在“除铁铝”中,当滤液中
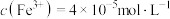 时,其
时,其
(5)可以通过电解法提纯镍,粗镍作
您最近一年使用:0次
名校
7 . 工业上采用电化学法对煤进行脱硫处理(煤中含硫物质主要是 ),以减少硫排放。模拟装置如图所示。下列说法错误的是
),以减少硫排放。模拟装置如图所示。下列说法错误的是
 ),以减少硫排放。模拟装置如图所示。下列说法错误的是
),以减少硫排放。模拟装置如图所示。下列说法错误的是
| A.电子流向:b极→石墨2→电解质溶液→石墨1→a极 |
B.石墨1为阳极,发生氧化反应, 被氧化 被氧化 |
C.脱硫反应为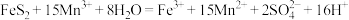 |
D.电路中转移 电子,理论上处理 电子,理论上处理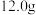  |
您最近一年使用:0次
2023-02-17更新
|
699次组卷
|
6卷引用:黑龙江省大庆市2023届高三下学期第一次教学质量检测化学试题
黑龙江省大庆市2023届高三下学期第一次教学质量检测化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题6-10)广东省佛山市南海区狮山石门高级中学2022-2023学年高二下学期3月月考化学试题(已下线)专题10 电化学的综合应用湖南省衡阳市第一中学2023届高三下学期5月月考化学试题浙江省杭州市富阳区场口中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
8 . 工业上利用废锰渣(主要成分为MnO2、KOH、MgO)制备MnSO4的流程如下图所示:
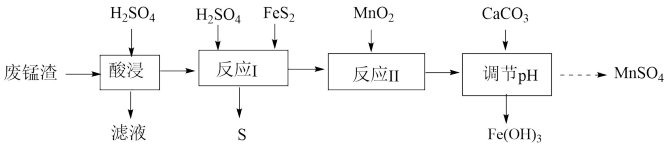
已知反应Ⅰ中生成Fe2+、Mn2+、 S等。下列说法不正确的是
| A.酸浸时适当升高温度或加速搅拌都可加快酸浸反应速率 |
| B.反应Ⅰ中每消耗60 gFeS2,转移的电子数为1 mol |
| C.滤液中主要存在的阳离子有: Mg2+、 K+、Mn2+、 H+ |
| D.反应Ⅱ的离子方程式为MnO2+2Fe2++4H+=2Fe3++Mn2++2H2O |
您最近一年使用:0次
2023-02-11更新
|
894次组卷
|
9卷引用:黑龙江省齐齐哈尔市2023-2024学年高三下学期一模化学试题
黑龙江省齐齐哈尔市2023-2024学年高三下学期一模化学试题江苏省南京师范大学附属中学2022-2023学年高二上学期期末考试化学试题安徽省合肥市2022-2023学年高一下学期4月期中考试化学试题陕西省安康市2022-2023学年高一下学期4月期中考试化学试题河南省原阳县第三高级中学2022-2023学年高一下学期第一次月考化学试题江苏省常州高级中学2023~2024 学年高二上学期10月阶段检测化学试题(已下线)专题03 离子反应与氧化还原反应-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)(已下线)专题04 化学实验基础-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)四川省自贡市第一中学校2023-2024学年高二下学期开学考试化学试题
解题方法
9 . 下列离子方程式书写错误的是
| A.将标准状况下2.24LSO2通入1L0.5mol•L-1Ca(ClO)2溶液中:Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl- |
| B.向含1molFeBr2的溶液中通入标准状况下22.4LCl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
C.向FeSO4溶液中滴加NaHCO3溶液和稀氨水,产生大量白色沉淀:Fe2++HCO +NH3•H2O=FeCO3+NH +NH3•H2O=FeCO3+NH +H2O +H2O |
D.向明矾溶液中滴加过量Ba(OH)2溶液:2Al3++3SO +3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ +3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓ |
您最近一年使用:0次
2022-10-09更新
|
416次组卷
|
4卷引用:黑龙江省大庆市2023-2024学年高三上学期第一次教学质量检测化学试题
名校
解题方法
10 . 下列过程中的化学反应,相应的离子方程式正确的是
A.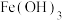 溶于足量氢碘酸溶液中: 溶于足量氢碘酸溶液中: 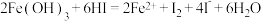 |
B.KI与稀硫酸的混合液久置变质: |
C. 通入酸性 通入酸性 溶液: 溶液: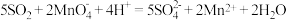 |
D.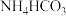 溶液与足量KOH溶液反应: 溶液与足量KOH溶液反应: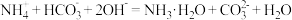 |
您最近一年使用:0次



