1 . 大力推广锂电池新能源汽车对实现“碳达峰”“碳中和”具有重要意义. 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下: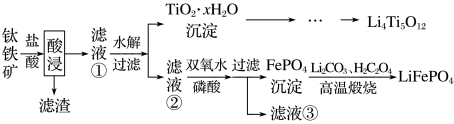
A.酸浸后,得到滤渣的主要成分是 |
B.在滤液②中主要的金属阳离子有 、 、 |
C.高温煅烧时发生的反应为 |
D.制备 过程中会生成 过程中会生成 (Ti为+4价),则 (Ti为+4价),则 中不含过氧键 中不含过氧键 |
您最近一年使用:0次
2023-12-21更新
|
616次组卷
|
4卷引用:化学(九省联考考后提升卷,吉林、黑龙江卷)-2024年1月“九省联考”真题完全解读与考后提升
(已下线)化学(九省联考考后提升卷,吉林、黑龙江卷)-2024年1月“九省联考”真题完全解读与考后提升陕西省汉中市2023-2024学年高三上学期教学质量第一次检测(一模)化学试卷(已下线)押题卷02(15+4题型) -2024高考化学考点必杀300题(新高考通用)陕西省汉中市2023-2024学年高三上学期第一次质量检测化学试题
2 . 电解粗铜工业得到的粗硫酸镍晶体中含有 、
、 、
、 、
、 等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:

已知:①氢氧化物沉淀的范围如下表所示:
②离子沉淀完全时,该离子的浓度小于 。
。
③室温下,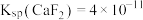 。
。
(1)粗硫酸镍晶体水浸后通入 的主要目的是
的主要目的是___________ 。
(2)滤渣1的主要成分是___________ ,将滤渣1充分焙烧后,再用硫酸酸化即可得到一种工业原料,该原料可用于气体水份的检验,焙烧滤渣1发生的反应的化学方程式为___________ 。
(3)反应II加入 反应的离子方程式为
反应的离子方程式为___________ 。
(4)加入的试剂X可以是___________ ,调整溶液 的范围为
的范围为___________ 。
(5)若反应III中 的浓度为
的浓度为 ,取等体积的
,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 完全沉淀,所加
完全沉淀,所加 溶液的浓度至少为
溶液的浓度至少为___________  。
。
 、
、 、
、 、
、 等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
等杂质离子,现欲进一步提纯硫酸镍晶体,设计如下流程:
已知:①氢氧化物沉淀的范围如下表所示:
| 金属阳离子 |  |  |  |
开始沉淀的 | 6.3 | 1.5 | 6.9 |
沉淀完全的 | 8.3 | 2.8 | 8.9 |
 。
。③室温下,
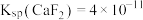 。
。(1)粗硫酸镍晶体水浸后通入
 的主要目的是
的主要目的是(2)滤渣1的主要成分是
(3)反应II加入
 反应的离子方程式为
反应的离子方程式为(4)加入的试剂X可以是
 的范围为
的范围为(5)若反应III中
 的浓度为
的浓度为 ,取等体积的
,取等体积的 溶液与该溶液混合,要使反应结束时
溶液与该溶液混合,要使反应结束时 完全沉淀,所加
完全沉淀,所加 溶液的浓度至少为
溶液的浓度至少为 。
。
您最近一年使用:0次
3 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即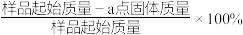 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即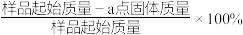 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为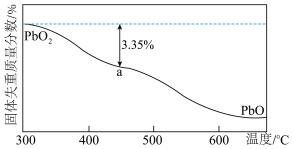
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
4 . 向重铬酸盐酸性溶液中加入乙醚和 ,水层发生反应:
,水层发生反应: (已知
(已知 的结构为
的结构为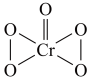 ),乙醚层发生反应:
),乙醚层发生反应: 。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色(
。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色( ),下列说法正确的是
),下列说法正确的是
 ,水层发生反应:
,水层发生反应: (已知
(已知 的结构为
的结构为 ),乙醚层发生反应:
),乙醚层发生反应: 。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色(
。反应上层出现蓝色,一段时间后溶液蓝色褪去,且水相变为绿色( ),下列说法正确的是
),下列说法正确的是A.由水层反应可知,氧化性: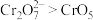 |
| B.乙醚在检验过程中可用乙醇代替 |
C.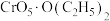 中不存在非极性键 中不存在非极性键 |
D.水相变为绿色的离子反应为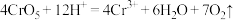 ,该反应生成 ,该反应生成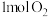 转移 转移 电子 电子 |
您最近一年使用:0次
5 . 高铁酸钾 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
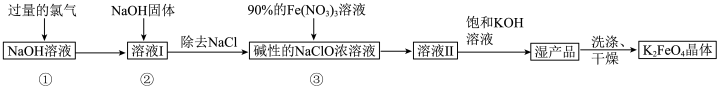
已知:① 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为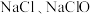 和
和 ;温度较高时产物为
;温度较高时产物为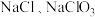 和
和 。
。
②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:___________ 。
(2)向“溶液Ⅰ”中加入 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、___________ 、___________ ;
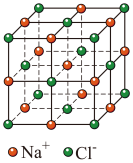
(3) 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为___________  ,该晶体的密度为
,该晶体的密度为___________  。(列出计算式)
。(列出计算式)
(4)配制 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为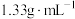 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为___________  。(保留3位有效数字)
。(保留3位有效数字)
(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)
___________ 。对“湿产品”进行“洗涤、干燥”时,洗涤剂最好选用___________ (填标号)溶液和异丙醇。
A. B.
B. C.
C.
 是新型多功能水处理剂,其生产工艺如图所示:
是新型多功能水处理剂,其生产工艺如图所示:
已知:①
 与
与 溶液反应的产物与反应温度有关,温度较低时产物为
溶液反应的产物与反应温度有关,温度较低时产物为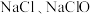 和
和 ;温度较高时产物为
;温度较高时产物为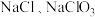 和
和 。
。②同一条件下,溶液的碱性越强,高铁酸盐的稳定性越高。
回答下列问题:
(1)写出
 与
与 溶液在较高温度下反应的离子方程式:
溶液在较高温度下反应的离子方程式:(2)向“溶液Ⅰ”中加入
 固体起到的作用有降低
固体起到的作用有降低 的溶解度、
的溶解度、(3)
 晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的
晶胞结构如图,设晶胞边长为apm,NA为阿伏加德罗常数的值,则距离最近的 间的距离为
间的距离为 ,该晶体的密度为
,该晶体的密度为 。(列出计算式)
。(列出计算式)
(4)配制
 溶液时,将
溶液时,将 固体溶解在
固体溶解在 水中(水的密度近似为
水中(水的密度近似为 ),所得溶液的密度为
),所得溶液的密度为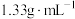 ,则该溶液的物质的量浓度为
,则该溶液的物质的量浓度为 。(保留3位有效数字)
。(保留3位有效数字)(5)步骤③发生的反应中氧化剂与还原剂的物质的量之比n(氧化剂)∶n(还原剂)

A.
 B.
B. C.
C.
您最近一年使用:0次
2023-09-09更新
|
283次组卷
|
2卷引用:黑龙江省大庆市2023-2024学年高三上学期第一次教学质量检测化学试题
名校
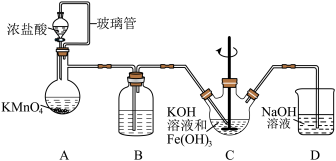
6 . 高铁酸钾(K2FeO4)是一种高效的水处理剂,实验室制备K2FeO4的装置如图所示。(夹持装置略去)
查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是___________ ,玻璃管的作用是___________ 。
(2)装置B中盛放的试剂是___________ 。
(3)装置C中KOH溶液过量的目的是___________ 。搅拌操作,除了防止因局部溶液碱性减弱,使K2FeO4与水反应产生Fe(OH)3和O2,另外的作用是___________ 。
(4)装置C中生成K2FeO4的离子方程式为___________ 。该反应放热,不利于K2FeO4固体析出,写出一条实验改进措施___________ 。
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用___________ 除水。(填标号)
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是___________ 。

查阅K2FeO4资料如下:①紫色固体,可溶于水、微溶于KOH溶液,不溶于乙醚、醇和氯仿等有机溶剂。②在0~5℃的强碱性溶液中比较稳定。③在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。④KOH溶于醇,微溶于乙醚。
回答下列问题:
(1)装置A为氯气发生装置,KMnO4体现的性质是
(2)装置B中盛放的试剂是
(3)装置C中KOH溶液过量的目的是
(4)装置C中生成K2FeO4的离子方程式为
(5)反应结束后过滤装置C中浊液,得到K2FeO4粗产品,用冷的3 mo·L-1KOH溶液洗涤粗产品后,再用
a.苯 b.浓硫酸 c.异丙醇
(6)装置D的作用是
您最近一年使用:0次
2023-09-07更新
|
583次组卷
|
3卷引用:黑龙江省大庆市2023届高三下学期第二次教学质量检测理科综合化学试题
10-11高三·山东聊城·阶段练习
名校
解题方法
7 . 高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH-→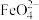 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
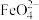 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
| B.高铁酸钾中铁显+6价 |
C.由上述反应可知,Fe(OH)3的氧化性强于FeO |
| D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近一年使用:0次
2023-08-23更新
|
431次组卷
|
26卷引用:【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题
【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题(已下线)2012届山东莘县实验高中高三第三次月考化学试卷2016届北京市通州区潞河中学高三上学期期中测试化学试卷2017届四川省泸州市泸化中学高三上10月月考化学卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题福建省龙海市第二中学2019届高三年级上学期开学考化学试题广东省佛山市第一中学2020届高三10月月考化学试题甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应福建省永春第一中学2018-2019学年高二下学期期末考试化学试题内蒙古包钢第一中学2020届高三上学期10月月考化学试题山东省潍坊第四中学2021-2022学年高三上学期10月月考化学试题山东省潍坊市昌乐二中2021-2022学年高三10月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)辽宁省沈阳市新民市第一高级中学2021-2022学年高三上学期第二次阶段测试化学试题浙江省杭州地区(含周边)重点中学2022-2023学年高一上学期期中考试化学试卷【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)(已下线)第二章 单元测试卷河北省衡水市武强中学2023-2024学年高一上学期期中考试化学试题河北省石家庄精英中学2023-2024学年高一上学期期中考试化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第二次月考 化学试题陕西省兴平市南郊高级中学2023-2024学年高一上学期第三次化学质量检测题
名校
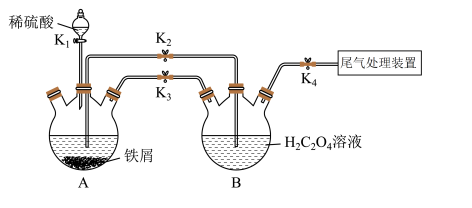
8 . K3[Fe(C2O4)3]·3H2O[三草酸合铁酸钾(M=491 g·mol-1)]易溶于水,难溶于乙醇,常用作有机反应的催化剂。某同学利用下图装置制备FeC2O4·2H2O,然后再制备三草酸合铁酸钾。
回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式______________ 。
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为__________________ 。
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为______________________ ;将上述混合物煮沸,加入饱和H2C2O4溶液,充分反应后冷却、结晶;结晶完全后减压抽滤、洗涤、干燥得到目标产物。
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是___________________ 。
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是_______________ 。
iii.为促进结晶,冷却后可加入_____________ (填试剂名称)。
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz- (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(4)阴离子电荷数为____________ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果_____ (填“偏高“偏低”或“无影响”)。

回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是
iii.为促进结晶,冷却后可加入
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz-
 (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。(4)阴离子电荷数为
您最近一年使用:0次
名校
解题方法
9 . 利用锌精矿(ZnS)和软锰矿(MnO2)两种矿料(含少量杂质Fe、Cu、Pb等元素的化合物及SiO2)生产硫酸锌和硫酸锰的流程如下:

已知常温下:①H2S的电离常数为:Ka1=1.0 ×10-7,Ka2=1.0 ×10-13;
②Ksp(ZnS)=1.0 ×10-22,Ksp(MnS)=1.0 ×10-13;
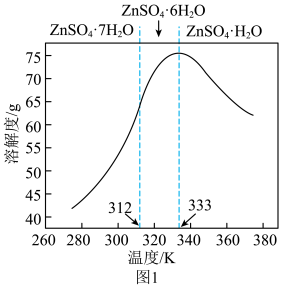
③ZnSO4的溶解度如图1所示:
回答下列问题:
(1)基态S原子占据最高能级的原子轨道形状为_________________________ 。
(2)“滤渣1”主要成分为_____________ 和硫;写出“酸浸”过程中MnO2和ZnS反应的化学方程式_________________ 。
(3)“除铁”的萃取剂为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为___________ 。
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为_____________ ;若溶液中S2-的浓度控制不当,会造成Zn2+、Mn2+沉淀而损失,若溶液中Zn2+、Mn2+的浓度为0.10 mol·L-1,则应控制溶液中c(H+)不小于_____________ mol·L-1。(已知溶液中H2S的浓度为1.0×10-3 mol/L)
(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为:控制温度在_________________ K以上,蒸发至有大量固体析出、________________ 、洗涤、干燥。
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。

已知常温下:①H2S的电离常数为:Ka1=1.0 ×10-7,Ka2=1.0 ×10-13;
②Ksp(ZnS)=1.0 ×10-22,Ksp(MnS)=1.0 ×10-13;
③ZnSO4的溶解度如图1所示:

回答下列问题:
(1)基态S原子占据最高能级的原子轨道形状为
(2)“滤渣1”主要成分为
(3)“除铁”的萃取剂为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为
(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为:控制温度在
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。
| A.滴定前,锥形瓶和滴定管均须用标准溶液润洗 |
| B.将标准溶液装入滴定管时,应借助漏斗转移 |
| C.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小 |
| D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大 |
您最近一年使用:0次
10 . Ar气氛下,高价态钒镁氧化物晶体作为催化剂进行乙苯脱氢制备苯乙烯,并将CO2转化为CO,反应机理如图(a)所示;同时采用电解法处理含苯乙烯的废水,其工作原理如图(b)(电解液是含苯乙烯和硫酸的废水,pH≈ 6),已知:·OH具有很强的氧化性。下列说法不正确的是
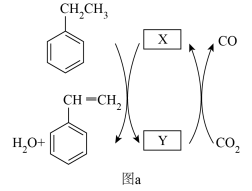
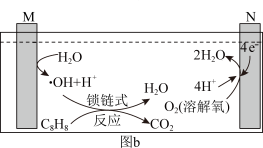


| A.图a由MgVmOn+1转化为MgVmOn的过程,乙苯发生氧化反应 |
| B.M连接电源的正极 |
| C.苯乙烯被·OH氧化的化学方程式为C8H8-40e- +40·OH =8CO2↑+ 24H2O |
| D.若电路中通过10mol电子,理论上有26g苯乙烯(M= 104 g/mol)被氧化成CO2和H2O |
您最近一年使用:0次



