名校
1 . ZnO在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上可由菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Mn等元素)制备。工艺如图所示:

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如表:
已知:① “溶浸”后的溶液中金属离子主要有:Zn2+、Fe2+、Cd2+、Mn2+、Ni2+。
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+ >Cd2+ >Zn2+
回答下列问题:
(1)“溶浸”过程中,提高浸出率的措施有_______ 。(写一条即可)
(2)“调pH”是向“溶浸”后的溶液中加入少量_______ (填化学式)调节至弱酸性(pH约为5)。
(3)加KMnO4“氧化除杂”发生反应的离子方程式分别是MnO +3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+和
+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+和_______ 。
(4)“还原除杂”除去的离子是_______ ;加入的还原剂是_______ 。
(5)“沉锌”生成碱式碳酸锌[ZnCO3·2Zn(OH)2·2H2O]沉淀,写出加入Na2CO3溶液沉锌的化学方程式_______ 。

相关金属离子[c0(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ | Mn2+ | Ni2+ |
| 开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 | 8.1 | 6.9 |
| 沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 | 10.1 | 8.9 |
②弱酸性溶液中KMnO4能将Mn2+氧化生成MnO2。
③氧化性顺序:Ni2+ >Cd2+ >Zn2+
回答下列问题:
(1)“溶浸”过程中,提高浸出率的措施有
(2)“调pH”是向“溶浸”后的溶液中加入少量
(3)加KMnO4“氧化除杂”发生反应的离子方程式分别是MnO
 +3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+和
+3Fe2++7H2O=3Fe(OH)3↓+MnO2↓+5H+和(4)“还原除杂”除去的离子是
(5)“沉锌”生成碱式碳酸锌[ZnCO3·2Zn(OH)2·2H2O]沉淀,写出加入Na2CO3溶液沉锌的化学方程式
您最近一年使用:0次
2021-11-18更新
|
1524次组卷
|
11卷引用:黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题
黑龙江省大庆市2022届高三上学期第一次教学质量检测化学试题黑龙江省大庆市2023-2024学年高三上学期第一次模拟考试化学试题(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)黑龙江省哈尔滨市第三十二中学2021-2022学年高三上学期期末考试化学试题黑龙江省肇东市第四中学2021-2022学年高三12月月考化学试题河南省示范性高中2021-2022学年高三上学期阶段性调研联考二化学试题(已下线)2022年湖南卷高考真题变式题(15-19)(已下线)2022年全国甲卷高考真题变式题(非选择题)江西省赣州市赣县第三中学2021-2022学年高二下学期4月月考化学试题第三部分··精编题天天练一一30天轻松突破拿高分天天练1-5陕西省西安中学2023-2024学年高三(实验班)上学期12月练考理科综合试题
2 . 从钒铬锰矿渣(主要成分为 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:
(1)Cr元素位于元素周期表第_______ 周期_______ 族。
(2)用 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为_______ 。
(3)常温下,各种形态五价钒粒子总浓度的对数[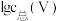 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中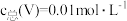 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为_______ (填化学式)。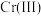 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为_______ ;在该条件下滤液B中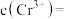
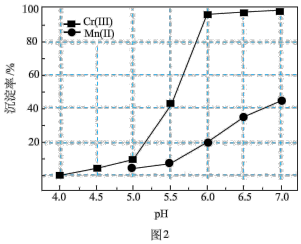
_______  【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。 的离子方程式为
的离子方程式为_______ 。
(6)“提纯”过程中 的作用为
的作用为_______ 。
 、
、 、
、 )中提铬的一种工艺流程如下:
)中提铬的一种工艺流程如下: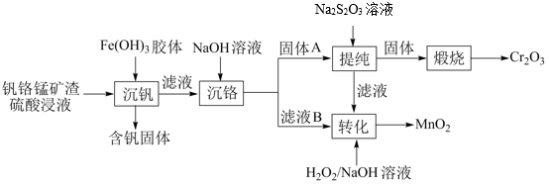
 ](在空气中易被氧化.回答下列问题:
](在空气中易被氧化.回答下列问题:(1)Cr元素位于元素周期表第
(2)用
 溶液制备
溶液制备 胶体的化学方程式为
胶体的化学方程式为(3)常温下,各种形态五价钒粒子总浓度的对数[
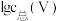 ]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中
]与pH关系如图1。已知钒铬锰矿渣硫酸浸液中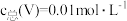 ,“沉钒”过程控制
,“沉钒”过程控制 ,则与胶体共沉降的五价钒粒子的存在形态为
,则与胶体共沉降的五价钒粒子的存在形态为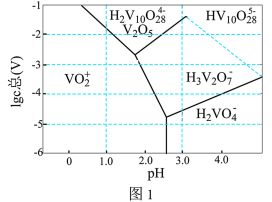
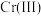 、
、 的沉淀率与pH关系如图2。“沉铬”过程最佳pH为
的沉淀率与pH关系如图2。“沉铬”过程最佳pH为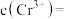
 【
【 近似为
近似为 ,
, 的
的 近似为
近似为 】。
】。
 的离子方程式为
的离子方程式为(6)“提纯”过程中
 的作用为
的作用为
您最近一年使用:0次
2021-09-13更新
|
10991次组卷
|
16卷引用:黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(三)试题
黑龙江省牡丹江市第二高级中学2023-2024学年高三下学期考前热身卷化学(三)试题2021年辽宁高考化学试题变式题11-192021年新高考辽宁化学高考真题辽宁省实验中学2021-2022学年高二上学期11月期中阶段测化学试题(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密06 金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)微专题17 热点金属及其化合物制备流程(V、Cr、Mn、Co、Ni)-备战2023年高考化学一轮复习考点微专题湖北省枣阳市第一中学2022-2023学年高三上学期8月化学月考试题第二部分 热点专项突破——解题能力稳提升专项2 物质提纯类的工艺流程(已下线)专题29 无机化工流程综合分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)05 无机化工流程题(5) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
3 . 锂离子电池的应用很广,其正极材料可再生利用。某钴酸锂电池的正极材料含有钴酸锂(LiCoO2)、导电剂乙炔黑、铝箔及少量铁,通过如图工艺流程可回收铝、钴、锂。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为_______ 。
(2)写出“正极碱浸”中发生反应的离子方程式_______ 。
(3)“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:

“酸浸”的适宜温度_______ ,写出该步骤中发生的主要氧化还原反应的化学方程式_______ 。
(4)沉锂过程要对所得滤渣进行洗涤,检验沉淀是否洗净的操作为_______ 。
(5)充电时,该锂离子电池充电时阴极发生的反应为6C+xLi++xe-=LixC6充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式_______ 。上述工艺中,“放电处理”有利于锂在正极的回收,其原因是_________ 。
(6)某CoC2O4·2H2O样品中可能含有的杂质为Co2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
I.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。
用cmol·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
II.向上述溶液中加入适量还原剂将Co3+完全还原为Co2+,加入稀H2SO4酸化后,在75℃继续用cmol·L-1KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含H2C2O4·2H2O(M=126g/mol)的质量分数表达式为___ ;若所用KMnO4溶液实际浓度偏低,则测得样品中Co元素含量____ 。(填“偏高”、“偏低”、“无影响”)

回答下列问题:
(1)LiCoO2中,Co元素的化合价为
(2)写出“正极碱浸”中发生反应的离子方程式
(3)“酸浸”时Co、Li元素的浸出率随温度的变化如图所示:

“酸浸”的适宜温度
(4)沉锂过程要对所得滤渣进行洗涤,检验沉淀是否洗净的操作为
(5)充电时,该锂离子电池充电时阴极发生的反应为6C+xLi++xe-=LixC6充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式
(6)某CoC2O4·2H2O样品中可能含有的杂质为Co2(C2O4)3、H2C2O4·2H2O,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
I.取mg样品于锥形瓶中,加入稀H2SO4溶解,水浴加热至75℃。
用cmol·L-1的KMnO4溶液趁热滴定至溶液出现粉红色且30s内不褪色,消耗KMnO4溶液V1mL。
II.向上述溶液中加入适量还原剂将Co3+完全还原为Co2+,加入稀H2SO4酸化后,在75℃继续用cmol·L-1KMnO4溶液滴定至溶液出现粉红色且30s内不褪色,又消耗KMnO4溶液V2mL。
样品中所含H2C2O4·2H2O(M=126g/mol)的质量分数表达式为
您最近一年使用:0次
名校
4 . 对于下列实验,能正确描述其反应的离子方程式是
A.H2C2O4具有还原性:2MnO +5C2O +5C2O +16H+=2Mn2++10CO2↑+8H2O +16H+=2Mn2++10CO2↑+8H2O |
B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=AlO +H2↑ +H2↑ |
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO +3Cl-+4H++H2O +3Cl-+4H++H2O |
| D.同浓度同体积NH4HSO4溶液与NaOH溶液混合:H++OH-=H2O |
您最近一年使用:0次
名校
5 . 市售的高锰酸钾常含有少量杂质。KMnO4是强氧化剂,在水溶液中能自行分解,其分解反应为:4KMnO4+2H2O=4MnO2↓+4KOH+3O2↑,分解速率随溶液的pH而变化,反应原理为4 +12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。
+12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。
I.KMnO4溶液的配制
称取1.600gKMnO4溶于盛有500mL水的烧杯中,加热煮沸20-30min,并在水浴上保温1h,冷却后过滤,储存于洁净试剂瓶中。
II.KMnO4溶液的标定(标定:使用标准物测出某溶液的精确浓度的过程)
准确称取Na2C2O40.200g置于250mL锥形瓶中,加入蒸馏水40mL及3.000mol·L-1硫酸溶液10mL,加热至75-85℃(不可煮沸)立即用待标定的KMnO4溶液滴定。开始滴定时反应速率慢,应逐滴加入,当加入第一滴KMnO4溶液颜色褪去后再加入第二滴,待溶液中产生Mn2+后,滴定速度可加快。达滴定终点,记录消耗KMnO4溶液的体积。平行测定3次,体积的平均值为29.85mL。
回答下列问题:
(1)滴定时使用___ 式滴定管。
(2)为延长储存时间,配制的KMnO4溶液应呈_ 性,且存放方法是__ 。配制过程中,加热煮沸且冷却后过滤的目的是__ 。
(3)用离子方程式表示标定反应的反应原理____ 。
(4)开始滴定时滴加KMnO4溶液的速度不宜太快,原因是__ ,否则会导致测定结果__ (填“偏高”或“偏低”)。
(5)达滴定终点的判定依据是____ 。
(6)经计算,所配制的KMnO4溶液的物质的量浓度为___ (保留一位有效数字)。
 +12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。
+12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。I.KMnO4溶液的配制
称取1.600gKMnO4溶于盛有500mL水的烧杯中,加热煮沸20-30min,并在水浴上保温1h,冷却后过滤,储存于洁净试剂瓶中。
II.KMnO4溶液的标定(标定:使用标准物测出某溶液的精确浓度的过程)
准确称取Na2C2O40.200g置于250mL锥形瓶中,加入蒸馏水40mL及3.000mol·L-1硫酸溶液10mL,加热至75-85℃(不可煮沸)立即用待标定的KMnO4溶液滴定。开始滴定时反应速率慢,应逐滴加入,当加入第一滴KMnO4溶液颜色褪去后再加入第二滴,待溶液中产生Mn2+后,滴定速度可加快。达滴定终点,记录消耗KMnO4溶液的体积。平行测定3次,体积的平均值为29.85mL。
回答下列问题:
(1)滴定时使用
(2)为延长储存时间,配制的KMnO4溶液应呈
(3)用离子方程式表示标定反应的反应原理
(4)开始滴定时滴加KMnO4溶液的速度不宜太快,原因是
(5)达滴定终点的判定依据是
(6)经计算,所配制的KMnO4溶液的物质的量浓度为
您最近一年使用:0次
名校
解题方法
6 . 草酸用途广泛。工业制草酸的方法之一是钙化法,工艺流程如图所示。回答下列问题:

已知:草酸钙和硫酸钙的溶度积分别为:Ksp(CaC2O4)=2×10-6、Ksp(CaSO4)=9.1×10-6
(1)气体X是_______ 。(填化学式)
(2)酸化过程发生反应的离子方程式为__ ,为提高酸化反应的产率,可以采取的方法是___ 。
(3)工艺流程中能够循环使用的物质有___ 。
(4)碳酸、草酸在25℃的电离平衡常数如下表:
NaHC2O4溶液显____ 性,其与NaHCO3溶液反应的化学方程式为____ 。
(5)73gCaC2O4·H2O受热分解时,固体产物的质量随温度的变化如下表:
①500℃时固体产物为____ (填化学式)。
②请写出将CaC2O4·H2O加热至1100℃过程中总反应的化学方程式____ 。

已知:草酸钙和硫酸钙的溶度积分别为:Ksp(CaC2O4)=2×10-6、Ksp(CaSO4)=9.1×10-6
(1)气体X是
(2)酸化过程发生反应的离子方程式为
(3)工艺流程中能够循环使用的物质有
(4)碳酸、草酸在25℃的电离平衡常数如下表:
| H2CO3 | H2C2O4 | |
| 电离平衡常数 | Ka1=4.4×10-7 Ka2=4.7×10-11 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
(5)73gCaC2O4·H2O受热分解时,固体产物的质量随温度的变化如下表:
| 温度/℃ | 25 | 300 | 350 | 500 | 800 | 1100 | 1200 |
| 固体质量/g | 73 | 64 | 64 | 50 | 50 | 28 | 28 |
②请写出将CaC2O4·H2O加热至1100℃过程中总反应的化学方程式
您最近一年使用:0次
名校
解题方法
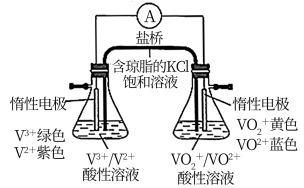
7 . 二氯化钒(VCl2)有强还原性和吸湿性,熔点为425°C、沸点为900°C,是制备多种医药、催化剂、含钒化合物的中间体。学习小组在实验室制备VCl2并进行相关探究。回答下列问题:
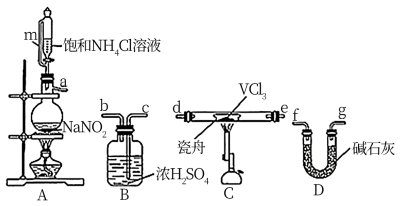
(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为_______ (用小写字母填空)。
②A中盛放NaNO2的仪器名称为_______ , 其中发生反应的离子方程式为_______ 。
③实验前需通入N2,其作用为_______ 。
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为_______ 。
②产品中VCl3与VCl2的物质的量之比为_______ 。
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为_______ ,则VO2+、V2+的还原性较强的是_______ 。

(1)小组同学通过VCl3分解制备VCl2。
①按气流方向,图中装置合理的连接顺序为
②A中盛放NaNO2的仪器名称为
③实验前需通入N2,其作用为
(2)测定产品纯度:实验后产品中混有少量VCl3杂质。称量2.795g样品,溶于水充分水解,调pH后滴加Na2CrO4作指示剂,用0.5000mol/LAgNO3标准溶液滴定Cl-,达到滴定终点时消耗标准液体积为100.00mL(Ag2CrO4为砖红色沉淀,杂质不参加反应)。
①滴定终点的现象为
②产品中VCl3与VCl2的物质的量之比为
(3)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,发生的电极反应式为

您最近一年使用:0次
2021-05-02更新
|
821次组卷
|
2卷引用:黑龙江省哈尔滨市第六中学2021届高三下学期第二次模拟考试理科综合化学试题
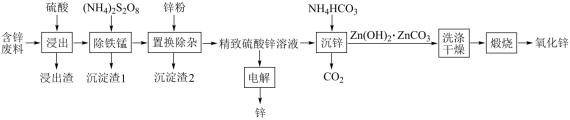
8 . 由含锌废料(主要含ZnO、PbO、CuO及少量FeO、MnO)生产锌及氧化锌的流程如图所示:
回答下列问题:
(1)浸出渣主要成分为_______ (填化学式,下同) ;沉淀渣2为_______ 。
(2)“除铁锰"”时,Mn(II)氧化生成MnO2( 转化为
转化为 ),配平该反应的离子方程式Mn2++
),配平该反应的离子方程式Mn2++ +H2O=MnO2↓+
+H2O=MnO2↓+ +H+,
+H+,_______ 。
(3)“沉锌”时,反应的化学方程式为_______ ;检验Zn(OH)2∙ZnCO3已洗涤干净的方法是_______ 。
(4)“电解”中产生_______ (填化学式)可在_______ (填操作单元名称)中循环利用。
(5)将Zn(OH)2∙ZnCO3加热分解可得到具有催化性能的活性氧化锌,若加热过程中固体质量减少了6. 2 kg,则理论上生成____ kg氧化锌。

回答下列问题:
(1)浸出渣主要成分为
(2)“除铁锰"”时,Mn(II)氧化生成MnO2(
 转化为
转化为 ),配平该反应的离子方程式Mn2++
),配平该反应的离子方程式Mn2++ +H2O=MnO2↓+
+H2O=MnO2↓+ +H+,
+H+,(3)“沉锌”时,反应的化学方程式为
(4)“电解”中产生
(5)将Zn(OH)2∙ZnCO3加热分解可得到具有催化性能的活性氧化锌,若加热过程中固体质量减少了6. 2 kg,则理论上生成
您最近一年使用:0次
名校
解题方法
9 . 以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是
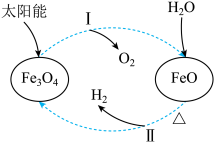

| A.过程Ⅰ中O2为还原产物 |
B.过程Ⅱ的化学方程式为3FeO+H2O Fe3O4+H2↑ Fe3O4+H2↑ |
| C.过程Ⅰ中的能量转化形式是太阳能→化学能 |
| D.铁氧化合物循环制H2具有节约能源、产物易分离等优点 |
您最近一年使用:0次
2020-11-29更新
|
419次组卷
|
3卷引用:黑龙江省哈尔滨第六中学2021届高三第四次模拟理综化学试题
名校
解题方法
10 . 锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl2•6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如图:


已知:①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质。
②BaSO4的溶度积常数为2.2×10-10,SrSO4的溶度积常数为3.3×10-7。
③SrCl2•6H2O的摩尔质量为267g/mol。
(1)工业上天青石焙烧前应先研磨粉碎,其目的是__ 。
(2)工业上天青石隔绝空气高温焙烧时,若0.5molSrSO4中只有S元素被还原,且转移了4mol电子。则该反应的化学方程式为__ 。
(3)浸取后加入硫酸的目的是___ ,用离子方程式表示___ 。
(4)产品纯度检测:称取2.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液。溶液中除Cl-外,不含其它与Ag+反应的离子,待Cl-完全沉淀后,滴入1—2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。已知:SCN-先与Ag+反应。
①滴定反应达到终点的现象是__ 。
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为___ (请列出计算式,无需计算)。
(5)由SrCl2•6H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有___ 。


已知:①经盐酸浸取后的溶液中除含有Sr2+和Cl-外,还有少量的Ba2+杂质。
②BaSO4的溶度积常数为2.2×10-10,SrSO4的溶度积常数为3.3×10-7。
③SrCl2•6H2O的摩尔质量为267g/mol。
(1)工业上天青石焙烧前应先研磨粉碎,其目的是
(2)工业上天青石隔绝空气高温焙烧时,若0.5molSrSO4中只有S元素被还原,且转移了4mol电子。则该反应的化学方程式为
(3)浸取后加入硫酸的目的是
(4)产品纯度检测:称取2.000g产品溶解于适量水中,向其中加入含AgNO30.01mol的AgNO3溶液。溶液中除Cl-外,不含其它与Ag+反应的离子,待Cl-完全沉淀后,滴入1—2滴含Fe3+的溶液作指示剂,用0.2000mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。已知:SCN-先与Ag+反应。
①滴定反应达到终点的现象是
②若滴定过程用去上述浓度的NH4SCN溶液20.00mL,则产品中SrCl2•6H2O的质量百分含量为
(5)由SrCl2•6H2O晶体制取无水氯化锶的主要仪器除了酒精灯、泥三角、三脚架外,还有
您最近一年使用:0次



