名校
1 . 实验室以 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体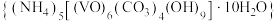 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体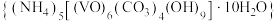 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
A.Ⅱ中的试剂为饱和 溶液 溶液 |
B.实验开始时应先打开活塞 ,一段时间后,再打开活塞 ,一段时间后,再打开活塞 |
| C.Ⅲ中的反应为氧化还原反应 |
D.反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于 保护下的干燥器中,静置过夜,得到晶体 保护下的干燥器中,静置过夜,得到晶体 |
您最近一年使用:0次
2024-05-13更新
|
299次组卷
|
2卷引用:2024届湖南省益阳市安化县第二中学高三下学期三模化学试题
名校
解题方法
2 . Na2FeO4具有强氧化性,是一种新型的绿色非氯净水消毒剂,碱性条件下可以稳定存在,酸性条件下会自身分解生成Fe(OH)3。可用Fe(OH)3与NaClO在强碱性条件下制取,某实验小组利用如图所示实验装置,制取Na2FeO4,并验证其处理含CN-废水的能力。

Ⅰ.制取Na2FeO4
(1)仪器D的名称为_____ 。洗气瓶B中盛有的试剂为_____ 。实验开始,先打开分液漏斗_____ (填“A”或“C”)的活塞。
(2)写出大试管中发生反应的离子方程式:_____ 。
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、______ 。
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO 和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有______ (填序号,下同)。

②计算NaCN溶液中CN-的去除率为______ (保留两位有效数字)。

Ⅰ.制取Na2FeO4
(1)仪器D的名称为
(2)写出大试管中发生反应的离子方程式:
(3)三颈烧瓶中的红褐色固体基本消失,得到紫色溶液时,停止通入Cl2。通入氯气的过程中三颈烧瓶中发生反应的离子方程式有:Cl2+2OH-=Cl-+ClO-+H2O、
Ⅱ.模拟并验证Na2FeO4处理含CN-废水的能力
(4)取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO
 和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有

②计算NaCN溶液中CN-的去除率为
您最近一年使用:0次
2023-03-15更新
|
582次组卷
|
4卷引用:湖南省益阳市安化县第二中学2023届高三三模化学试题
名校
3 . 金属钴是一种重要战略资源。利用草酸钴(CoC2O4)废料协同浸出水钴矿中钴的工艺流程如下。

已知:I.水钴矿的主要成分为 ,含MnS及Fe、Al、Ca、Si等元素的氧化物;
,含MnS及Fe、Al、Ca、Si等元素的氧化物;
II.该流程中一些金属氢氧化物沉淀时的pH如表:
(1)研磨的目的是_______ 。
(2)滤渣1的主要成分是 、
、_______ (写化学式)。
(3)“浸出”时, 转化成了
转化成了 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(4)“氧化”时, 只将
只将 氧化成
氧化成 ,则反应的氧化剂与还原剂的物质的量之比为
,则反应的氧化剂与还原剂的物质的量之比为_______ 。
(5)“沉淀”时,应将pH调至_______ 。
(6)已知 能被有机萃取剂(HA)萃取,其原理可表示为:
能被有机萃取剂(HA)萃取,其原理可表示为: 。反萃取的目的是将有机层中的
。反萃取的目的是将有机层中的 转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、
转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、_______ ,反萃取适宜选择的试剂是_______ (填序号)。
A.70% B.饱和食盐水 C.稀NaOH D.饱和
B.饱和食盐水 C.稀NaOH D.饱和 溶液
溶液

已知:I.水钴矿的主要成分为
 ,含MnS及Fe、Al、Ca、Si等元素的氧化物;
,含MnS及Fe、Al、Ca、Si等元素的氧化物;II.该流程中一些金属氢氧化物沉淀时的pH如表:
| 离子 |  |  |  |  |  |
| 开始沉淀时pH | 3.6 | 1.8 | 6.5 | 7.2 | 8.1 |
| 沉淀完全时pH | 4.7 | 3.2 | 8.3 | 9.4 | 12.7 |
(1)研磨的目的是
(2)滤渣1的主要成分是
 、
、(3)“浸出”时,
 转化成了
转化成了 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)“氧化”时,
 只将
只将 氧化成
氧化成 ,则反应的氧化剂与还原剂的物质的量之比为
,则反应的氧化剂与还原剂的物质的量之比为(5)“沉淀”时,应将pH调至
(6)已知
 能被有机萃取剂(HA)萃取,其原理可表示为:
能被有机萃取剂(HA)萃取,其原理可表示为: 。反萃取的目的是将有机层中的
。反萃取的目的是将有机层中的 转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、
转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、A.70%
 B.饱和食盐水 C.稀NaOH D.饱和
B.饱和食盐水 C.稀NaOH D.饱和 溶液
溶液
您最近一年使用:0次
2022-11-03更新
|
1240次组卷
|
4卷引用:湖南省益阳市第一中学2022-2023学年高三下学期模拟考试化学试题
名校
4 . 磷酸钒锂/碳复合材料 是常用的电极材料,其制备流程如下:
是常用的电极材料,其制备流程如下:

已知: ,
, 的电离常数
的电离常数 ,
,
下列说法不正确 的是
 是常用的电极材料,其制备流程如下:
是常用的电极材料,其制备流程如下:
已知:
 ,
, 的电离常数
的电离常数 ,
,下列说法
A. 溶液显酸性 溶液显酸性 |
| B.碳的作用是增强复合材料的导电性 |
| C.“洗涤”时用乙醇而不用水的目的是减少产品损耗 |
D.“混合I”时发生反应的化学方程式为 |
您最近一年使用:0次
2022-10-27更新
|
715次组卷
|
6卷引用:湖南省益阳市第一中学2022-2023学年高三下学期模拟考试化学试题
名校
5 . NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式是:  +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是
 +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是A.该反应中 被还原 被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1molNaNO3需消耗0.4molKMnO4 |
| D.横线中的粒子是OH- |
您最近一年使用:0次
2022-07-26更新
|
554次组卷
|
45卷引用:2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷
2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2014届福建省南侨中学等五校高中毕业班期末摸底考试化学试卷(已下线)2014高考化学名师知识点精编 专题4氧化还原反应练习卷2017届新疆兵团农二师华山中学高三上学前考试化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷天津市和平区2017-2018学年高一上学期期中质量调查化学试题辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题2018-2019学年人教版高中化学必修一模块综合测评题(A)2018-2019学年苏教版高中化学必修一 模块综合测评(A)河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题云南省漾濞二中2020届高三上学期开学考试化学试题江西省赣州市寻乌中学2020届高三上学期第一阶段考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)考试帮 模块综合测评B卷人教版(2019)高一必修第一册 模块综合测评-B卷贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖南省武冈市第二中学2020-2021学年高一上学期第一次月考化学试题(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题黑龙江省哈尔滨市第六中学2021-2022学年高三上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)4.2.2 氧化还原反应方程式的配平(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第八中学2022-2023学年高三上学期第一次调研(开学考试)化学试题黑龙江省哈尔滨市香坊区第九中学校2021-2022学年高一上学期期中考试化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省枣庄市第三中学2022-2023学年高一上学期12月期中考试化学试题宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题江西省南昌市第十九中学2022-2023学年高一上学期12月第二次月考化学试卷
名校
解题方法
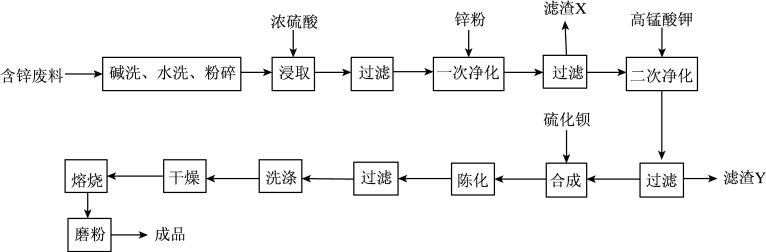
6 . 立德粉为ZnS和BaSO4的混合物,是通过硫酸锌和硫化钡合成制备。用含锌废料(主要成分为ZnO,含少量铜、铅、铁、锰的氧化物)制备立德粉的工艺流程如下:
已知:MnO2是两性氧化物,25℃时相关物质的Ksp见下表。
回答下列问题:
(1)硫酸锌溶液的粗制:取一定质量处理后的含锌废料于烧杯中,以固:水=3:1混合,在60~70℃下搅拌并缓慢加入硫酸。当pH=5左右停止加硫酸,控制温度为80~90℃,继续搅拌45min,使样品溶解趋于完全,终点的pH应为5.2~5.4。上述实验过程中,可采用的加热方式为_______ ,若终点处酸度不宜过高或过低,原因是_______ 。
(2)硫酸锌溶液的精制:“一次净化”时,滤渣X的成分主要是_______ 。“二次净化”时,加入高锰酸钾发生反应的离子方程式为_______ ,“二次净化”后过滤所得滤液的pH不低于_______ 。(杂质离子浓度低于10-5mol·L-1认为完全沉淀)
(3)“合成”时反应的化学方程式为_______ 。

已知:MnO2是两性氧化物,25℃时相关物质的Ksp见下表。
| 物质 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| Ksp | 1×10-16.3 | 1×10-38.0 | 1×10-12.7 | 1×10-16.2 |
(1)硫酸锌溶液的粗制:取一定质量处理后的含锌废料于烧杯中,以固:水=3:1混合,在60~70℃下搅拌并缓慢加入硫酸。当pH=5左右停止加硫酸,控制温度为80~90℃,继续搅拌45min,使样品溶解趋于完全,终点的pH应为5.2~5.4。上述实验过程中,可采用的加热方式为
(2)硫酸锌溶液的精制:“一次净化”时,滤渣X的成分主要是
(3)“合成”时反应的化学方程式为
您最近一年使用:0次
2022-05-01更新
|
183次组卷
|
2卷引用:湖南省益阳市沅江市第一中学2022届高三下学期第二次模拟考试试题
名校
解题方法
7 . 五氧化二钒( )广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有
)广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有 、
、 、
、 、
、 、
、 、
、 等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
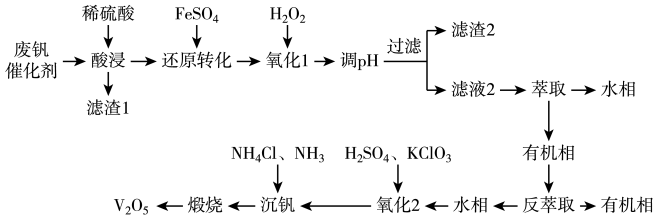
已知:
①“酸浸”时 和
和 与稀硫酸反应分别生成
与稀硫酸反应分别生成 和
和 。
。
②溶液中 与
与 可相互转化:
可相互转化: ,且
,且 为沉淀。
为沉淀。
(1)“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是___________ 。
(2)“还原转化”中加入 的目的是将
的目的是将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
(3)加入 的目的是将过量的
的目的是将过量的 转化为
转化为 。“氧化1”后,溶液中含有的金属阳离子主要有
。“氧化1”后,溶液中含有的金属阳离子主要有 、
、 、
、 ,调节
,调节 使离子沉淀,若溶液中
使离子沉淀,若溶液中 ,则调节溶液的
,则调节溶液的 最小值为
最小值为___________ 可使 沉淀完全(离子浓度≤
沉淀完全(离子浓度≤ 时沉淀完全),此时
时沉淀完全),此时___________ (填“有”或“无”) 沉淀生成。{假设溶液体积不变,
沉淀生成。{假设溶液体积不变, ,
, ,
, }
}
(4)“氧化2”过程中发生反应的离子方程式为___________ 。
(5)“沉钒”时,通入氨气的作用是___________ 。
(6)若该废钒催化剂中 的含量为10%(原料中所有的钒已换算成
的含量为10%(原料中所有的钒已换算成 )。取100g待处理样品,按照上述流程进行实验。当加入
)。取100g待处理样品,按照上述流程进行实验。当加入 溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是
溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是___________ %(假设与 反应后的操作步骤中钒元素无损失)。
反应后的操作步骤中钒元素无损失)。
 )广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有
)广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有 、
、 、
、 、
、 、
、 、
、 等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下:
已知:
①“酸浸”时
 和
和 与稀硫酸反应分别生成
与稀硫酸反应分别生成 和
和 。
。②溶液中
 与
与 可相互转化:
可相互转化: ,且
,且 为沉淀。
为沉淀。(1)“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是
(2)“还原转化”中加入
 的目的是将
的目的是将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:(3)加入
 的目的是将过量的
的目的是将过量的 转化为
转化为 。“氧化1”后,溶液中含有的金属阳离子主要有
。“氧化1”后,溶液中含有的金属阳离子主要有 、
、 、
、 ,调节
,调节 使离子沉淀,若溶液中
使离子沉淀,若溶液中 ,则调节溶液的
,则调节溶液的 最小值为
最小值为 沉淀完全(离子浓度≤
沉淀完全(离子浓度≤ 时沉淀完全),此时
时沉淀完全),此时 沉淀生成。{假设溶液体积不变,
沉淀生成。{假设溶液体积不变, ,
, ,
, }
}(4)“氧化2”过程中发生反应的离子方程式为
(5)“沉钒”时,通入氨气的作用是
(6)若该废钒催化剂中
 的含量为10%(原料中所有的钒已换算成
的含量为10%(原料中所有的钒已换算成 )。取100g待处理样品,按照上述流程进行实验。当加入
)。取100g待处理样品,按照上述流程进行实验。当加入 溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是
溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是 反应后的操作步骤中钒元素无损失)。
反应后的操作步骤中钒元素无损失)。
您最近一年使用:0次
2022-03-22更新
|
1360次组卷
|
8卷引用:湖南省益阳市南县第一中学2022届高三下学期第二次模拟考试化学试题
8 . 二氧化钛是钛的重要化合物,钛白(纯净的二氧化钛)是一种折射率高、着色力和遮盖力强、化学性质稳定的白色颜料。从钛铁矿(主要成分FeTiO3,含Fe2O3、SiO2等杂质)制取二氧化钛,常用硫酸法,其流程如下:

(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式___________ 。
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,适宜的条件还可以选择______________ (任写一种)。
(3)过滤时所需玻璃仪器为漏斗、玻璃棒和烧杯。从滤液中得到X为绿矾(FeSO4·7H2O)晶体的实验操作依次为:加热浓缩、冷却结晶、过滤洗涤、低温干燥。实验室要配制、保存该溶液时需加少量铁屑,目的是________________ 。
(4)第③步反应化学方程式_____________________ 。
(5)若实验时需要450mL2mol/L的C溶液,则在精确配制时,需用托盘天平称取NaOH固体___________ g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒、胶头滴管、药匙外,还必须有____________ (填仪器名称)。

(1)钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,该反应的化学方程式
(2)为提高“固体熔块”水浸取时的浸出率,除了采用循环浸取、延长时间、熔块粉碎外,适宜的条件还可以选择
(3)过滤时所需玻璃仪器为漏斗、玻璃棒和烧杯。从滤液中得到X为绿矾(FeSO4·7H2O)晶体的实验操作依次为:加热浓缩、冷却结晶、过滤洗涤、低温干燥。实验室要配制、保存该溶液时需加少量铁屑,目的是
(4)第③步反应化学方程式
(5)若实验时需要450mL2mol/L的C溶液,则在精确配制时,需用托盘天平称取NaOH固体
您最近一年使用:0次



