名校
解题方法
1 . 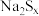 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中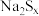 ,与
,与 的物质的量之比为
的物质的量之比为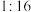 ,则x的值为
,则x的值为
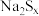 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中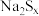 ,与
,与 的物质的量之比为
的物质的量之比为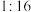 ,则x的值为
,则x的值为| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-02-08更新
|
632次组卷
|
36卷引用:湖南省岳阳市岳阳楼区岳阳楼市第一中学2020届高三考前模拟理科综合化学试题
湖南省岳阳市岳阳楼区岳阳楼市第一中学2020届高三考前模拟理科综合化学试题(已下线)湖南省衡阳市第八中学2010届高三年级第五次月考化学试题(已下线)2011-2012学年湖南衡阳一、八中高一下学期期中联考化学试卷(已下线)2012届高三上学期一轮复习化学单元验收试卷(4)(新人教版)(已下线)2012届黑龙江省大庆实验中学高三上学期期中考试化学试卷(已下线)2013届河北省邯郸一中高三9月月考化学化学试卷(已下线)2014届浙江省湖州市八校高三上学期第二次联考化学试卷福建省德化一中、永安一中、漳平一中2018届高三上学期三校联考化学试题黑龙江省齐齐哈尔市实验中学2017-2018学年高一上学期期中考试化学试题安徽省六安市霍邱县第二中学2019-2020学年高一上学期段考化学试题辽宁省辽河油田第二高级中学2020届高三12月考试化学试题2019年秋高三化学复习强化练习—— 氧化还原反应(强化练)2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)(已下线)【南昌新东方】2019 南昌五中 高一上期中辽宁省丹东市2020届高三总复习阶段测试化学试题黑龙江省哈尔滨市三中2020届高三第二次月考化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题河南省周口市中英文学校2020-2021学年高三上学期第一次月考化学试题甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题山东省济南市历城第一中学2021届高三上学期10月月考化学试题陕西省宝鸡市千阳县千阳中学2020-2021学年高一上学期期中考试化学试题山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练山西省运城市稷山中学2022届高三上学期月考(一)化学试题河北省沧州市第一中学2020-2021学年高一下学期开学测试化学试题陕西省韩城市西庄中学2021-2022学年高三上学期9月月考化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题四川省成都市树德中学2021-2022学年高一上学期11月阶段性测试(期中)化学试题重庆市南开中学校2021-2022学年高一上学期阶段性测试化学试题重庆市璧山中学校2021-2022学年高一上学期期中考试化学试题吉林省吉林市第一中学2021-2022学年高二6月月考(平行班)化学试题湖北省武汉中学2022-2023学年高一上学期期中阶段性考试化学试题第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)专题05 氧化还原反应方程式的配平与计算(一题多问)
解题方法
2 . 2019年诺贝尔化学奖颁给了日本化学家吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。工业中利用锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
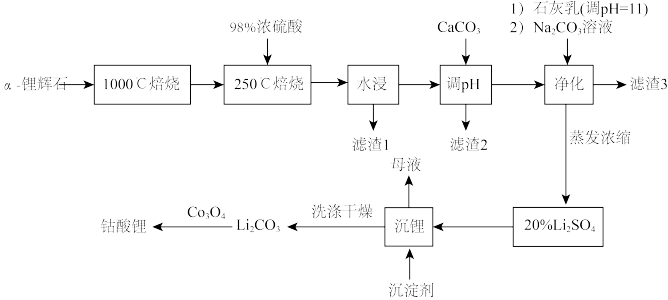
已知:
①α-锂辉石化学惰性较大,除HF外,几乎不与任何酸碱反应,α—锂辉石在高温下可转化为β-锂辉石,β—锂辉石具有更高的化学活性;
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2 + H2SO4→Li2SO4 +Al2O3·4SiO2·H2O;
③部分金属氢氧化物pKsp(pKsp=—lgKsp)的柱状图。

回答下列问题:
(1)1000℃焙烧α—锂辉石的目的为_______ ;锂辉石的主要成分为LiAl(SiO3)2,其氧化物的形式为_______ 。
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ (保留小数点后一位有效数字,已知:完全沉淀后离子浓度低于1×l0-5mol/L);“滤渣3”的主要成分为 _______ 。
(3)“沉锂”过程中加入的沉淀剂为饱和的Na2CO3溶液,判断该过程中所获得的沉淀是否洗涤干净的操作为:_______ 。
(4)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为_______ 。
(5)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池总反应为LiCoO2+C6 LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:_______ 。

已知:
①α-锂辉石化学惰性较大,除HF外,几乎不与任何酸碱反应,α—锂辉石在高温下可转化为β-锂辉石,β—锂辉石具有更高的化学活性;
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2 + H2SO4→Li2SO4 +Al2O3·4SiO2·H2O;
③部分金属氢氧化物pKsp(pKsp=—lgKsp)的柱状图。

回答下列问题:
(1)1000℃焙烧α—锂辉石的目的为
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为
(3)“沉锂”过程中加入的沉淀剂为饱和的Na2CO3溶液,判断该过程中所获得的沉淀是否洗涤干净的操作为:
(4)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
(5)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池总反应为LiCoO2+C6
 LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
您最近一年使用:0次
名校
3 . NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式是:  +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是
 +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是A.该反应中 被还原 被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1molNaNO3需消耗0.4molKMnO4 |
| D.横线中的粒子是OH- |
您最近一年使用:0次
2022-07-26更新
|
554次组卷
|
45卷引用:2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷
2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷湖南省武冈市第二中学2020-2021学年高一上学期第一次月考化学试题(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2014届福建省南侨中学等五校高中毕业班期末摸底考试化学试卷(已下线)2014高考化学名师知识点精编 专题4氧化还原反应练习卷2017届新疆兵团农二师华山中学高三上学前考试化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷天津市和平区2017-2018学年高一上学期期中质量调查化学试题辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题2018-2019学年人教版高中化学必修一模块综合测评题(A)2018-2019学年苏教版高中化学必修一 模块综合测评(A)河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题云南省漾濞二中2020届高三上学期开学考试化学试题江西省赣州市寻乌中学2020届高三上学期第一阶段考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)考试帮 模块综合测评B卷人教版(2019)高一必修第一册 模块综合测评-B卷贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题黑龙江省哈尔滨市第六中学2021-2022学年高三上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)4.2.2 氧化还原反应方程式的配平(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第八中学2022-2023学年高三上学期第一次调研(开学考试)化学试题黑龙江省哈尔滨市香坊区第九中学校2021-2022学年高一上学期期中考试化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省枣庄市第三中学2022-2023学年高一上学期12月期中考试化学试题宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题江西省南昌市第十九中学2022-2023学年高一上学期12月第二次月考化学试卷
解题方法
4 . Mg3N2是一种新型无机材料,在工业上应用非常广泛,可用于制备特殊的陶瓷材料或用于制造特种玻璃。实验室可以利用氮气和镁在高温下直接化合来制备Mg3N2。已知:室温下,纯净的氮化镁为黄绿色的粉末,遇水发生水解反应,需密封保存。现提供如图装置利用纯净的氮气和镁反应制取Mg3N2。

(1)Mg3N2是一种离子化合物,写出该化合物的电子式:____ ,Mg3N2能溶于酸,写出其与盐酸溶液反应的化学方程式:____ 。
(2)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为:____ 。
(3)请从图中选择合适的装置,按顺序组装一套装置利用纯净的氮气和镁反应制取Mg3N2(装置可以根据需要重复使用):____ (填字母)。装置B中盛放的液体是___ ,装置B的作用是____ 。
(4)实验结束后,取装置D的硬质玻璃管中的少量固体于试管中,加适量蒸馏水充分振荡,再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是____ 。
(5)Mg3N2制备过程中存在一些副反应导致产品不纯。某同学取2.250g Mg3N2样品与浓NaOH溶液充分反应,将产生的氨气用水吸收来测定Mg3N2的纯度(假设杂质与碱不反应,忽略NH3在强碱溶液中的溶解)。当反应完全后持续通入氮气将生成的氨气全部吹入烧杯中被水吸收,将烧杯中的溶液转移到250mL的容量瓶中,加水定容配制成250mL溶液,用____ 量取25.00mL氨水于锥形瓶中并加入几滴____ 作指示剂,用0.1000mol/L的盐酸滴定至终点,消耗盐酸的体积为36.00mL,经计算得Mg3N2的纯度为____ 。(保留到小数点后2位)
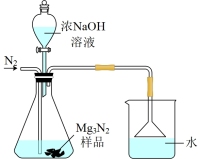

(1)Mg3N2是一种离子化合物,写出该化合物的电子式:
(2)装置C中的现象是黑色的氧化铜逐渐变红,有关反应的化学方程式为:
(3)请从图中选择合适的装置,按顺序组装一套装置利用纯净的氮气和镁反应制取Mg3N2(装置可以根据需要重复使用):
(4)实验结束后,取装置D的硬质玻璃管中的少量固体于试管中,加适量蒸馏水充分振荡,再弃去上层清液,加入盐酸,观察是否有气泡产生,该操作的目的是
(5)Mg3N2制备过程中存在一些副反应导致产品不纯。某同学取2.250g Mg3N2样品与浓NaOH溶液充分反应,将产生的氨气用水吸收来测定Mg3N2的纯度(假设杂质与碱不反应,忽略NH3在强碱溶液中的溶解)。当反应完全后持续通入氮气将生成的氨气全部吹入烧杯中被水吸收,将烧杯中的溶液转移到250mL的容量瓶中,加水定容配制成250mL溶液,用

您最近一年使用:0次
5 . 硼氢化钠(NaBH4)是常用的还原剂之一,与水反应可放出氢气,可用如下所示转化合成。已知硼氢化钠中B为+3价。下列有关说法错误的是
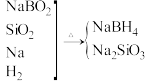
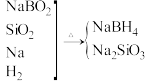
| A.该合成反应在隔绝空气的条件下进行 |
| B.该合成反应中Na和H2作还原剂 |
| C.NaBH4与水反应时,每生成1molH2转移1mole- |
D.该反应的化学方程式为NaBO2+2SiO2+4Na+2H2 2Na2SiO3+NaBH4 2Na2SiO3+NaBH4 |
您最近一年使用:0次
名校
6 . 工业尾气中含有H2S,会造成严重的环境污染。未脱除H2S的煤气在运输过程中还会腐蚀管道。氧化铁脱硫除去煤气中H2S的原理如图所示。下列说法错误的是
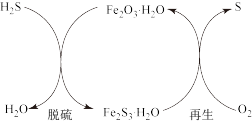

| A.单质硫为黄色固体,易溶于水和CS2 |
| B.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O |
| C.再生过程中,氧化剂与氧化产物的质量比为1:2 |
| D.脱硫过程中,增大反应物的接触面积可提高脱硫效率 |
您最近一年使用:0次
2021-01-20更新
|
568次组卷
|
4卷引用:湖南教育联合体2020届高三7月联考化学试题
湖南教育联合体2020届高三7月联考化学试题湖南师范大学附属中学2019-2020学年高二下学期期末考试化学试题(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练广东省深圳市观澜中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
7 . 下列离子方程式书写正确的是( )
A.用Na2SO3溶液吸收少量Cl2:3 +Cl2+H2O═2 +Cl2+H2O═2 +2Cl﹣+ +2Cl﹣+ |
| B.FeI2溶液中滴入过量溴水:2Fe2++2I﹣+2Br2═2Fe3++I2+4Br﹣ |
C.草酸使酸性高锰酸钾溶液褪色:2 +5 +5 +16H+═2Mn2++10CO2↑+8H2O +16H+═2Mn2++10CO2↑+8H2O |
D.向NH4HCO3溶液中滴加少量NaOH溶液: +OH﹣═NH3•H2O +OH﹣═NH3•H2O |
您最近一年使用:0次
2020-12-25更新
|
1203次组卷
|
6卷引用:湖南省衡阳市2022届高三下学期联考 (三模)化学试题
湖南省衡阳市2022届高三下学期联考 (三模)化学试题辽宁省大连市第二十四中学2021届高三上学期期中考试化学试题辽宁省大连市第一〇三中学2022届高三第八次考试化学试题(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密04 离子反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)
名校
8 . 图中展示的是乙烯催化氧化的过程(部分配平相关离子未画出),下列描述错误的是


A.PbCl 和Cu2+在反应中都起到催化剂的作用 和Cu2+在反应中都起到催化剂的作用 |
| B.该转化过程中,仅O2和Cu2+均体现了氧化性 |
| C.该转化过程中,涉及反应4Cu+ +O2+4H+=4Cu2++2H2O |
D.乙烯催化氧化的反应方程式为2CH2=CH2 + O2  2CH3CHO 2CH3CHO |
您最近一年使用:0次
2020-12-18更新
|
1676次组卷
|
15卷引用:湖南省岳阳市2021届高三二模考试化学试题
湖南省岳阳市2021届高三二模考试化学试题重庆市第八中学校2021届高三高考适应性月考卷(三)化学试题湖南省郴州市2022届高三上学期第一次月考化学试题辽宁省协作体2021-2022学年下学期高三第一次模拟考试化学试题辽宁省阜新市实验中学2021-2022学年高三下学期第一次模拟考试化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)河北省唐山市一中2020-2021学年高二下学期期中考试化学试题安徽省六校教育研究会2022届高三第一次素质测试化学试题安徽省合肥市第六中学2022届高三上学期开学考试化学试题河北省石家庄市第二中学2021-2022学年高三上学期10月联考化学试题安徽省亳州市第五完全中学2021-2022学年高三上学期期中考试化学试题辽宁省葫芦岛市四校2022-2023学年高三上学期期中联考化学试题天津市和平区2023届高三下学期第一次质量调查化学试题湖北省武汉市重点中学5G联合体2022-2023学年高二下学期期末考试化学试题
9 . 洋葱所含的微量元素硒(34Se)是一种很强的抗氧化剂,能消除体内的自由基,增强细胞的活力和代谢能力,具有防癌抗衰老的功效。工业上用精炼铜的阳极泥(硒主要以CuSe存在,含有少量Ag、Au)为原料与浓硫酸混合焙烧,将产生的SO2、SeO2混合气体用水吸收即可得Se固体,其工艺流程如图,下列有关说法错误的是


| A.实验室中过滤用到的玻璃仪器为:玻璃棒、烧杯、普通漏斗 |
| B.SeO2既有氧化性又有还原性,其还原性比SO2强 |
C.“焙烧”时的主要反应为:CuSe+4H2SO4(浓) CuSO4+SeO2↑+3SO2↑+4H2O CuSO4+SeO2↑+3SO2↑+4H2O |
| D.生产过程中产生的尾气SeO2可以用NaOH溶液吸收 |
您最近一年使用:0次
2020-12-08更新
|
693次组卷
|
8卷引用:湖南省长郡十五校2021届高三下学期第二次联考化学试题
湖南省长郡十五校2021届高三下学期第二次联考化学试题江西名校2021届高三第二次联考化学试题北京市昌平区新学道临川学校2021届高三12月月考化学试题(已下线)押山东卷第09题 化工生产流程选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)考点50 物质的分离、提纯和检验-备战2023年高考化学一轮复习考点帮(全国通用)山东省青岛市即墨区第一中学2022-2023学年高三上学期10月月考化学试题福建省德化一中、永安一中、漳平一中三校协作2022-2023学年高三上学期12月联考化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
名校
解题方法
10 . 重铬酸钾是一种重要的化工原料,一般由铬铁矿制备。铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
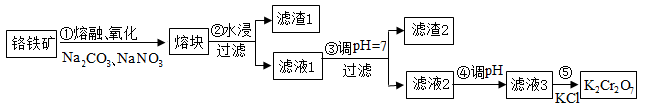
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为____________ 。该步骤不能使用陶瓷容器,原因是________ (用化学方程式表示)。
(2)滤渣1中含量最多的金属元素是____ (填写元素符号),设计实验方案验证滤渣1中经步骤①中反应后的产物_____ 。滤渣2的主要成分是______ (填写化学式)及含硅杂质。
(3)步骤④调滤液2的pH使之变________ (填“大”或“小”),原因是_________ (用离子方程式和适当的文字表述说明)。
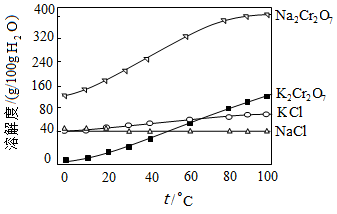
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式____________ 。

回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3
 Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为
Na2CrO4+Fe2O3+CO2+NaNO2。上述反应配平后FeO·Cr2O3与NaNO3的化学计量数比(最简整数比)为(2)滤渣1中含量最多的金属元素是
(3)步骤④调滤液2的pH使之变
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。写出步骤⑤的化学反应方程式

您最近一年使用:0次
2020-11-19更新
|
226次组卷
|
2卷引用:湖南省邵阳市新邵县2021届高三下学期新高考适应性考试化学试题



