名校
解题方法
1 . 某小组利用如图所示装置制备并收集TiCl4(夹持装置略去),并测定由TiCl4制备的纳米xTiO2•yH2O的组成。
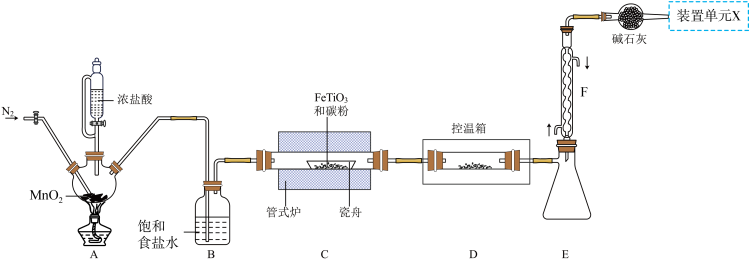
已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是_______ 。
(2)写出A中反应的化学方程式_______ ;上述装置存在一处缺陷,会导致TiCl4产率降低,改进的方法是_______ 。
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为_______ 。
(4)装置E、F的作用为_______ 。
(5)设计实验测定纳米xTiO2•yH2O组成。
已知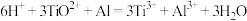 ,
,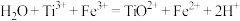
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在_______ 滴定管(填“酸式”、“碱式”),用_______ 做指示剂,平均消耗标准溶液20.00mL,则xTiO2•yH2O的化学式为_______ 。

已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
TiCl4 | FeCl3 | CCl4 | |
熔点/℃ |
| 306 |
|
沸点/℃ | 136.4 | 315 | 76.8 |
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是
(2)写出A中反应的化学方程式
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为
(4)装置E、F的作用为
(5)设计实验测定纳米xTiO2•yH2O组成。
已知
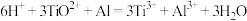 ,
,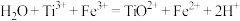
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000
 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000
 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
您最近一年使用:0次
2024-02-19更新
|
911次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题(已下线)2024届广东省华南师范大学附属中学 广雅中学 深圳中学 广东实验中学高三上学期四校联考化学试题广东省云浮市云安区云安中学2023-2024学年高三下学期3月考试化学试题
名校
2 .  是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ,实验开始前应进行的操作为___________ ,装置D的作用为___________ 。
(2)装置A中浓盐酸在反应中表现出来的性质是___________ 。
(3)由实验推知,A中氧化性:
___________ (填“>”、“<”或“=”) ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色,___________ (填“能”或“不能”)根据此现象判断 的氧化性强于
的氧化性强于 。
。
(4)有关高锰酸钾的实验及现象如表所示。
①已知实验Ⅰ中氧化产物为 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为___________ 。
②实验结论:其他条件相同,介质pH越低, 氧化性越
氧化性越___________ (填“强”或“弱”)。
 是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放
 溶液的仪器名称为
溶液的仪器名称为(2)装置A中浓盐酸在反应中表现出来的性质是
(3)由实验推知,A中氧化性:

 ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色, 的氧化性强于
的氧化性强于 。
。(4)有关高锰酸钾的实验及现象如表所示。
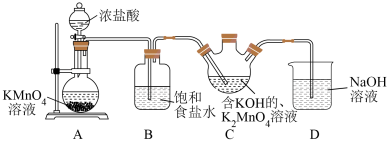
| 实验 | 装置 | 试剂R(5 mL含0.1 mol·L  的溶液) 的溶液) | 现象(通入乙烯的体积相等) |
| Ⅰ |  |  溶液 溶液 | 较快产生黑色沉淀 |
| Ⅱ | KOH和 溶液 溶液 | 紫红色溶液较慢变为绿色溶液 | |
| Ⅲ | 稀硫酸和 溶液 溶液 | 紫红色溶液很快变为无色溶液 |
 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为②实验结论:其他条件相同,介质pH越低,
 氧化性越
氧化性越
您最近一年使用:0次
2023-10-27更新
|
252次组卷
|
5卷引用:湖南省株洲市第一中学2021届高三第一次模拟检测化学试题
名校
解题方法
3 . 四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为−25℃,沸点为136.4℃。某实验小组设计如图装置(部分加热和夹持装置省略),用Cl2与碳粉、TiO2制备TiCl4。下列说法正确的是
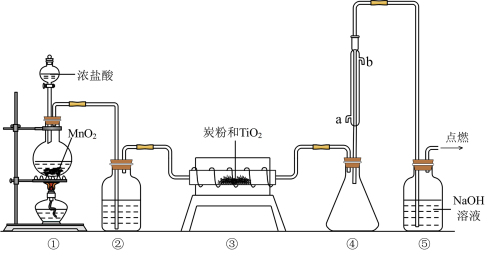

| A.②中应盛装饱和食盐水 |
| B.冷凝管处冷凝水应该由b进a出 |
| C.反应结束时,应先停止①处的加热,后停止③处的加热 |
| D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置 |
您最近一年使用:0次
2023-03-18更新
|
177次组卷
|
2卷引用:湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
名校
4 . 锂、铍等金属广泛应用于航空航天、核能和新能源汽车等高新产业。一种从萤石矿(主要含BeO、Li2O、CaF2及少量CaCO3、SiO2、FeO、Fe2O3、Al2O3)中提取的工艺如图:
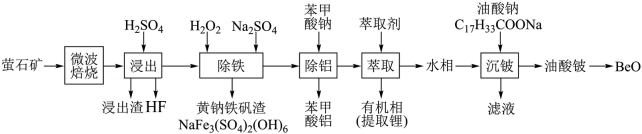
已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,随温度升高,溶解度增大。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,目的是__________ 。
(2)浸出渣的主要成分是__________ ,“除铁”中可替代H2O2的物质是__________ 。
(3)“除铁”中发生反应的离子方程式:__________ 、__________ 。
(4)“除铝”时,溶液的pH越小,铝的去除率__________ (填“越高”、“越低”或“不变”)。利用“除铝”所得苯甲酸铝沉淀再生苯甲酸的方案为:将苯甲酸铝沉淀溶于热的稀硫酸中,__________ 。
(5)由油酸铍制备BeO的方法是高温焙烧,检验焙烧已完全的操作实验为________ 。

已知:苯甲酸是一元弱酸,白色片状晶体,常温下微溶于水,随温度升高,溶解度增大。
回答下列问题:
(1)“微波焙烧”使矿物内部变得疏松多孔,目的是
(2)浸出渣的主要成分是
(3)“除铁”中发生反应的离子方程式:
(4)“除铝”时,溶液的pH越小,铝的去除率
(5)由油酸铍制备BeO的方法是高温焙烧,检验焙烧已完全的操作实验为
您最近一年使用:0次
2022-05-16更新
|
423次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题山东省肥城市2022届高考适应性训练(一)化学试题(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)
名校
解题方法
5 . 利用无机物离子[(L)RuⅢ(H2O)]5-和[CeⅣ(NO3)6]2-(如图简写为CeⅣ),实现了水在催化剂作用下制氧气。用H218O进行同位素标记实验,证明了产物氧气中氧原子完全来自于水。其相关机理如图所示:

下列说法正确的是

下列说法正确的是
| A.[CeⅣ(NO3)6]2-在反应中作催化剂 |
B.催化氧化水的反应为2H2O O2↑+2H2↑ O2↑+2H2↑ |
| C.进行同位素标记实验前需排尽体系中的空气 |
| D.若H218O参与反应,则[(L)RuⅢ(OOH)]6-中不存在18O |
您最近一年使用:0次
2022-03-03更新
|
404次组卷
|
13卷引用:湖南省长沙市第一中学2021届高三第一次模拟考试化学试题
湖南省长沙市第一中学2021届高三第一次模拟考试化学试题广东省深圳市2021届高三下学期第一次调研考试化学试题湖南省永州市第一中学2022届高三第二次月考化学试题重庆市西南大学附中2020-2021学年度高三下学期第五次月考化学试题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)河北省石家庄市第二中学2021-2022学年高三上学期11月第一次考试化学试题(已下线)第18周 周测卷-备战2022年高考化学周测与晚练(新高考专用)湖南省常德市临澧县第一中学2021-2022学年高三第九次阶段性考试化学试题湖北省新高考联考协作体2021-2022学年高三上学期期末考试化学试题江苏省如东高级中学、姜堰中学、沭阳高级中学2022届高三下学期4月份阶段性测试三校联考化学试题江苏省南京市南京第一中学2022-2023学年高三上学期期中考试化学试题河南省南阳市第一中学校2022-2023学年高三上学期12月月考化学试题
名校
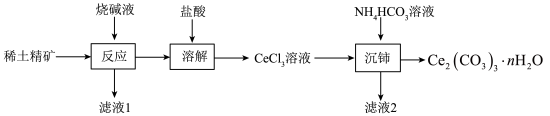
6 . 我国稀土储量世界第一,稀土元素铈是当代高科技新材料的重要组成部分。以稀土精矿(主要成分为CeFCO3、CePO4,还有SiO2、Al2O3)为原料制备Ce2(CO3)3·nH2O(n>3)及CeCl3的工艺流程如下:
回答下列问题:
(1)稀土精矿在分解槽中与烧碱液在140℃时反应,Ce元素均转化为Ce(OH)3,其中CeFCO3发生反应的化学方程式为___________ 。
(2)“反应”不能在陶瓷容器中进行的原因是___________ 。
(3)“沉铈”过程中反应的离子方程式为___________ 。判断Ce3+已经完全沉淀的实验操作是___________ 。
(4)常温下,若Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1时溶液的pH为5,则溶液中c( )=
)=___________ mol·L-1(保留2位小数)。已知常温下Ka1(H2CO3)=4.3×10-7,Ka2(H2CO3)=5.6×10-11,Ksp[Ce2(CO3)3]=1.0×10-28
(5)工业沉铈过程中常选用NH4HCO3溶液作沉淀剂,若用Na2CO3代替NH4HCO3可能产生其他固体杂质,该杂质为___________ 。
(6)CeCl3溶液还可经过一系列操作得到CeCl3·6H2O,将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中NH4Cl固体的作用是___________ 。

回答下列问题:
(1)稀土精矿在分解槽中与烧碱液在140℃时反应,Ce元素均转化为Ce(OH)3,其中CeFCO3发生反应的化学方程式为
(2)“反应”不能在陶瓷容器中进行的原因是
(3)“沉铈”过程中反应的离子方程式为
(4)常温下,若Ce3+恰好沉淀完全[c(Ce3+)为1.0×10-5mol·L-1时溶液的pH为5,则溶液中c(
 )=
)=(5)工业沉铈过程中常选用NH4HCO3溶液作沉淀剂,若用Na2CO3代替NH4HCO3可能产生其他固体杂质,该杂质为
(6)CeCl3溶液还可经过一系列操作得到CeCl3·6H2O,将NH4Cl固体与CeCl3·6H2O混合真空加热可得无水CeCl3,其中NH4Cl固体的作用是
您最近一年使用:0次
2022-02-17更新
|
309次组卷
|
3卷引用:湖南省株洲市第二中学2021届高三下学期第三次模拟考试化学试卷
7 . 氯化亚砜( )是一种无色易挥发的液体,沸点为
)是一种无色易挥发的液体,沸点为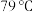 ,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。
,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。 可以作脱水剂,与
可以作脱水剂,与 混合共热制取无水
混合共热制取无水 。某实验小组同学欲用下列装置制取无水
。某实验小组同学欲用下列装置制取无水 ,同时回收剩余的
,同时回收剩余的 并验证生成物中有
并验证生成物中有 。下列说法错误的是
。下列说法错误的是

 )是一种无色易挥发的液体,沸点为
)是一种无色易挥发的液体,沸点为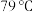 ,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。
,与水剧烈反应时液面上有雾生成,并有刺激性气体逸出。 可以作脱水剂,与
可以作脱水剂,与 混合共热制取无水
混合共热制取无水 。某实验小组同学欲用下列装置制取无水
。某实验小组同学欲用下列装置制取无水 ,同时回收剩余的
,同时回收剩余的 并验证生成物中有
并验证生成物中有 。下列说法错误的是
。下列说法错误的是
A.装置的连接顺序为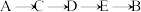 |
| B.B中新增的阴离子可能有3种 |
C.该小组同学认为直接将 置于坩埚中加热也能制得无水 置于坩埚中加热也能制得无水 |
D.若用 作 作 的脱水剂可能会发生氧化还原反应,可以用酸性 的脱水剂可能会发生氧化还原反应,可以用酸性 溶液来检验是否有 溶液来检验是否有 生成 生成 |
您最近一年使用:0次
8 . CuSO4是一种重要的化工原料,有关制备途径及性质如图所示。下列说法错误的是
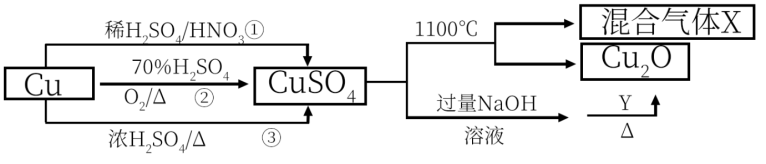

| A.途径①所用混酸中H2SO4与HNO3物质的量之比最好是1:1 |
| B.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②<③ |
C.硫酸铜在1100℃分解反应的方程式可能为2CuSO4 Cu2O+SO2↑+SO3↑+O2↑ Cu2O+SO2↑+SO3↑+O2↑ |
| D.Y为葡萄糖或甲酸甲酯,均可实现这一步的转化 |
您最近一年使用:0次
名校
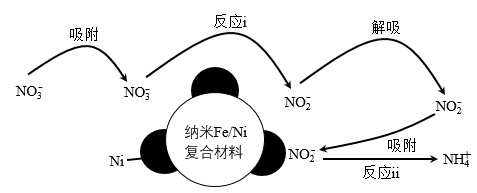
9 . 酸性环境中,纳米Fe/Ni去除NO 过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法
过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法不正确 的是
 过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法
过程中的含氮微粒变化如图所示,溶液中铁以Fe2+形式存在。下列有关说法
A.反应ⅱ的离子方程式为:NO +3Fe+8H+=NH +3Fe+8H+=NH +3Fe2++2H2O +3Fe2++2H2O |
B.增大单位体积水体中纳米Fe/Ni的投入量,可提高NO 的去除效果 的去除效果 |
| C.假设反应过程都能彻底进行,反应ⅰ、ⅱ消耗的铁的物质的量之比为3:1 |
D.a mol NO 完全转化为NH 完全转化为NH 至少需要4a mol的铁 至少需要4a mol的铁 |
您最近一年使用:0次
2022-01-11更新
|
2125次组卷
|
9卷引用:湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题
湖南省邵阳市2021-2022学年高三上学期第一次联考化学试题湖南省长沙市雅礼中学2021-2022学年高三下学期月考(七)化学试题湖南省娄底市双峰县第一中学2023届高三下学期第五次月考化学试题北京市中央民族大学附属中学2021-2022学年高三下学期2月适应性练习化学试题湖北省天门中学、仙桃中学2021-2022学年高一下学期2月联考化学试题湖北省沙市中学2022-2023学年高二上学期第二次月考化学试题江西省南昌市第二中学2022-2023学年高三上学期第三次考试化学试题河南省汝州市第一高级中学2022-2023学年高二上学期11月月考化学试题(已下线)二轮专题强化练 专题8 常见无机物性质的转化
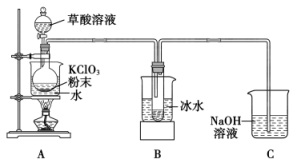
10 . 二氧化氯(ClO2)是目前国际上公认的高效安全消毒剂,其熔点为-59.0℃,沸点为11.0℃。某同学查得工业上制取ClO2的一种方法:在60℃时用潮湿的KClO3与草酸(H2C2O4)反应。该同学设计如图装置,模拟工业制取并收集ClO2。
回答下列问题:
(1)ClO2易溶于水但不与水发生化学反应,从分子结构的角度解释其易溶于水的原因___________ ;ClO2分子中存在离域π键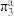 ,则a的数值为
,则a的数值为___________ 。
(2)装置A中的生成物还有K2CO3和ClO2等,写出该反应的化学方程式___________ 。
(3)装置B的作用是___________ 。
(4)该同学设计的装置A中还应安装的玻璃仪器是___________ ;装置C存在安全隐患,改进的方法是___________ 。
(5)将收集的ClO2溶于水得到ClO2溶液。为测定溶液中ClO2的含量,进行下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成50.00mL试样,量取10.00mL试样加入锥形瓶中;
步骤2:调节试样的pH=2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,发生反应2Na2S2O3+I2=Na2S4O6+2NaI。到达滴定终点时消耗Na2S2O3溶液12.00mL。
①步骤1中准确量取ClO2溶液所用的仪器是___________ 。
②步骤2的目的是___________ (用离子方程式表示)。
③原溶液中ClO2的含量为___________ mg·L-1。

回答下列问题:
(1)ClO2易溶于水但不与水发生化学反应,从分子结构的角度解释其易溶于水的原因
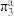 ,则a的数值为
,则a的数值为(2)装置A中的生成物还有K2CO3和ClO2等,写出该反应的化学方程式
(3)装置B的作用是
(4)该同学设计的装置A中还应安装的玻璃仪器是
(5)将收集的ClO2溶于水得到ClO2溶液。为测定溶液中ClO2的含量,进行下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成50.00mL试样,量取10.00mL试样加入锥形瓶中;
步骤2:调节试样的pH=2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用0.1000mol·L-1Na2S2O3溶液滴定,发生反应2Na2S2O3+I2=Na2S4O6+2NaI。到达滴定终点时消耗Na2S2O3溶液12.00mL。
①步骤1中准确量取ClO2溶液所用的仪器是
②步骤2的目的是
③原溶液中ClO2的含量为
您最近一年使用:0次

 23.2
23.2

