1 . 废旧电路板主要含有塑料。Fe、Cu、SnO2、PbO2等,研究人员一种从处理废旧电路板中回收金属锡(Sn)的流程如下。

已知:Sn和Pb位于周期表第IVA族;SnO2,PbO2可与强碱共热反应生成易溶盐和水。
(1)“焙烧”的主要目的是___________ 。
(2)“滤渣”中含有的金属元素有___________ (填元素符号)。
(3)SnO2与NaOH溶液反应的离子方程式为___________ 。
(4)加入Na2S可与"滤液a”中的Na2PbO3反应以达到除铅的目的,写出相关的化学方程式_____ ;可循环利用的物质的化学式为_______ 。
(5)理论上过量的焦炭与SnO2在高温下恰好反应时二者的质量比为___________ 。
(6)测定粗锡中Sn的纯度:在强酸性环境中将1.0g的粗锡样品溶解(此时Sn全部转化成Sn2+),迅速加入过量NH4Fe(SO4)2溶液,以二苯胺磺酸钠为指示剂,用0.1mol·L-1K2Cr2O7标准溶液滴定至终点。平行测定三次消耗的K2Cr2O7溶液的体积平均为25.00mL,计算Sn的纯度。
已知:由Sn2++2Fe3+=Sn4++2Fe2+、 +6Fe2++14H+=2Cr2++6Fe3++7H2O
+6Fe2++14H+=2Cr2++6Fe3++7H2O
①溶解粗锡时不宜选用浓盐酸,理由是___________ ;
②粗锡样品中Sn的纯度为___________ 。

已知:Sn和Pb位于周期表第IVA族;SnO2,PbO2可与强碱共热反应生成易溶盐和水。
(1)“焙烧”的主要目的是
(2)“滤渣”中含有的金属元素有
(3)SnO2与NaOH溶液反应的离子方程式为
(4)加入Na2S可与"滤液a”中的Na2PbO3反应以达到除铅的目的,写出相关的化学方程式
(5)理论上过量的焦炭与SnO2在高温下恰好反应时二者的质量比为
(6)测定粗锡中Sn的纯度:在强酸性环境中将1.0g的粗锡样品溶解(此时Sn全部转化成Sn2+),迅速加入过量NH4Fe(SO4)2溶液,以二苯胺磺酸钠为指示剂,用0.1mol·L-1K2Cr2O7标准溶液滴定至终点。平行测定三次消耗的K2Cr2O7溶液的体积平均为25.00mL,计算Sn的纯度。
已知:由Sn2++2Fe3+=Sn4++2Fe2+、
 +6Fe2++14H+=2Cr2++6Fe3++7H2O
+6Fe2++14H+=2Cr2++6Fe3++7H2O①溶解粗锡时不宜选用浓盐酸,理由是
②粗锡样品中Sn的纯度为
您最近一年使用:0次
2022-01-14更新
|
701次组卷
|
3卷引用:陕西省宝鸡市2021-2022年上学期高考模拟检测(一)理科综合化学试题
名校
解题方法
2 . 五氧化二氮(N2O5)是有机合成中常用的绿色硝化剂。N2O5常温下为白色固体,可溶于CH2Cl2等氯代经溶剂,微溶于水且与水反应生成强酸,高于室温时对热不稳定。
(1)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2。实验装置如图:

回答下列问题:
①装置C的名称__ ,装置E的作用是__ 。
②写出装置A中发生反应的化学方程式__ 。
③实验时,将装置C浸入__ (填“热水”或“冰水”)中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。关闭分液漏斗的活塞,打开活塞K,通过臭氧发生器向装置C中通入含有臭氧的氧气。
(2)判断C中反应已结束的简单方法是__ 。
(3)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。取2.0g粗产品,加入20.00mL0.1250mol·L-1酸性高锰酸钾溶液。充分反应后,用0.1000mol·L-1H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2与HNO3不反应且不考虑其分解)
①产品中N2O4与KMnO4发生反应的离子方程式为__ 。
②判断滴定终点的方法是__ 。
③产品中N2O4的质量分数为__ 。
(1)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2。实验装置如图:

回答下列问题:
①装置C的名称
②写出装置A中发生反应的化学方程式
③实验时,将装置C浸入
(2)判断C中反应已结束的简单方法是
(3)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。取2.0g粗产品,加入20.00mL0.1250mol·L-1酸性高锰酸钾溶液。充分反应后,用0.1000mol·L-1H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液17.50mL。(已知:H2O2与HNO3不反应且不考虑其分解)
①产品中N2O4与KMnO4发生反应的离子方程式为
②判断滴定终点的方法是
③产品中N2O4的质量分数为
您最近一年使用:0次
2021-12-19更新
|
736次组卷
|
7卷引用:陕西省汉中市2021-2022学年高三上学期教学质量第一次检测考试化学试题
陕西省汉中市2021-2022学年高三上学期教学质量第一次检测考试化学试题山东省滨州市2021-2022学年高三上学期第一次检测化学试题(已下线)专题36 物质的制备及实验方案的设计与评价(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练内蒙古包钢第一中学2021-2022学年高三下学期一模检测(B)化学试题(已下线)一轮巩固卷4-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)湖南师范大学附属中学2021-2022学年高三下学期第六次月考化学试题湖南省株洲市第八中学021-2022学年高三下学期5月月考化学试题
名校
3 . 在酸性条件下,黄铁矿(FeS2)催化氧化反应的离子方程式为:2FeS2+7O2+2H2O=2Fe2++4SO +4H+。实现该反应的物质间转化如图,下列说法正确的是
+4H+。实现该反应的物质间转化如图,下列说法正确的是
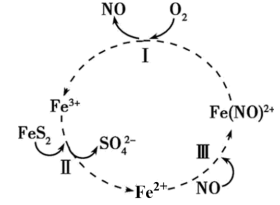
 +4H+。实现该反应的物质间转化如图,下列说法正确的是
+4H+。实现该反应的物质间转化如图,下列说法正确的是
| A.反应Ⅰ中消耗1molO2生成1molNO | B.反应Ⅲ是氧化还原反应 |
| C.该转化过程中NO做催化剂 | D.反应II中1molFeS2被氧化转移16mol电子 |
您最近一年使用:0次
2021-12-19更新
|
442次组卷
|
5卷引用:陕西省汉中市2021-2022学年高三上学期教学质量第一次检测考试化学试题
陕西省汉中市2021-2022学年高三上学期教学质量第一次检测考试化学试题山东省滨州市2021-2022学年高三上学期第一次检测化学试题(已下线)专项05 氧化还原反应-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)浙江省舟山市舟山中学2021-2022学年高一下学期开学考试化学试题山东省潍坊高密市第三中学2022-2023学年高三上学期9月月考化学试题
4 . 孔雀石主要成分是 ,还含少量
,还含少量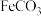 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:

有关物质沉淀的pH数据如下:
(1)步骤Ⅰ加稀硫酸充分反应,过滤得到滤渣的主要成分是_______  填化学式
填化学式 ,该物质进一步提纯后可用于制造
,该物质进一步提纯后可用于制造_______ 。提高步骤Ⅰ反应速率的措施是_______ (写一条即可)。
(2)步骤Ⅱ中试剂①应选用试剂_______  填代号
填代号 。
。
a.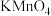 b.稀
b.稀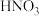 c.双氧水 d.氯水
c.双氧水 d.氯水
相关反应的离子方程式为:_______ 。
(3)步骤Ⅲ加入CuO调节溶液的pH至_______ (填写范围),目的是_______ 。
(4)步骤Ⅳ获得硫酸铜晶体的操作中,必须采取的实验措施是_______ 。
(5)常温下 的
的 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至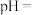
_______ 。
(6)用 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生
可以产生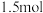 金属铜,则该反应的化学方程式为
金属铜,则该反应的化学方程式为_______ 。
 ,还含少量
,还含少量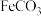 及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
及硅的氧化物,实验室以孔雀石为原料制备硫酸铜晶体的步骤如下:
有关物质沉淀的pH数据如下:
| 物质 |  开始沉淀 开始沉淀 |  完全沉淀 完全沉淀 |
 | 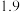 |  |
 | 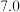 | 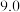 |
 | 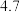 | 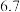 |
 填化学式
填化学式 ,该物质进一步提纯后可用于制造
,该物质进一步提纯后可用于制造(2)步骤Ⅱ中试剂①应选用试剂
 填代号
填代号 。
。a.
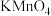 b.稀
b.稀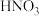 c.双氧水 d.氯水
c.双氧水 d.氯水相关反应的离子方程式为:
(3)步骤Ⅲ加入CuO调节溶液的pH至
(4)步骤Ⅳ获得硫酸铜晶体的操作中,必须采取的实验措施是
(5)常温下
 的
的 ,若要将溶液中的
,若要将溶液中的 转化为
转化为 沉淀,使溶液中
沉淀,使溶液中 降低至
降低至 ,必须将溶液调节至
,必须将溶液调节至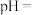
(6)用
 和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的
和孔雀石反应可以制得金属铜,已知1mol氨气通过灼热的 可以产生
可以产生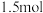 金属铜,则该反应的化学方程式为
金属铜,则该反应的化学方程式为
您最近一年使用:0次
名校
5 . 下列指定反应的离子方程式正确的是
A.双氧水使酸性KMnO4溶液褪色:2MnO +5H2O2=2Mn2++5O2↑+6OH-+2H2O +5H2O2=2Mn2++5O2↑+6OH-+2H2O |
B.过量的铁粉溶于稀硝酸:Fe+4H++NO =Fe3++NO↑+2H2O =Fe3++NO↑+2H2O |
C.用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O +5H2O=10H++2SO +5H2O=10H++2SO +8Cl- +8Cl- |
D.向NaAlO2溶液中通入过量CO2:2AlO +CO2+3H2O=2Al(OH)3↓+CO +CO2+3H2O=2Al(OH)3↓+CO |
您最近一年使用:0次
2021-11-16更新
|
539次组卷
|
3卷引用:陕西省宝鸡市金台区2022届高三第一次模拟检测化学试题
陕西省宝鸡市金台区2022届高三第一次模拟检测化学试题(已下线)专题04 离子方程式正误判断-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)山东省青岛第二中学2023届高三上学期1月期末考试化学试题
名校
解题方法
6 . 某萃铜余液主要含有 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备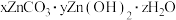 的工艺流程如图甲所示。
的工艺流程如图甲所示。

回答下列问题:
(1)过硫酸钠( )中
)中 的化合价为
的化合价为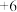 ,
,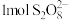 中过氧键的数目为
中过氧键的数目为___________ 。向 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为___________ 。“氧化除锰”过程中,
___________ (填“能”或“不能”)用绿色氧化剂 来代替。
来代替。
(2)向“氧化除锰”后的余液中加入试剂 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为___________ 。
(3)“沉锌”时,应保持溶液 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是___________ 。
(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→___________ →___________ →___________ →___________ →c→关抽气泵。
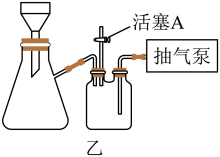
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[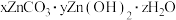 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌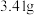 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体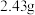 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为___________ 。
 、
、 、
、 、
、 ,
, 等离子,从萃铜余液中回收金属和制备
等离子,从萃铜余液中回收金属和制备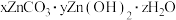 的工艺流程如图甲所示。
的工艺流程如图甲所示。
回答下列问题:
(1)过硫酸钠(
 )中
)中 的化合价为
的化合价为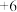 ,
,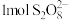 中过氧键的数目为
中过氧键的数目为 的萃铜余液中加入
的萃铜余液中加入 。进行“氧化除锰”,其反应的离子方程式为
。进行“氧化除锰”,其反应的离子方程式为
 来代替。
来代替。(2)向“氧化除锰”后的余液中加入试剂
 调节
调节 使铁元素完全沉淀,试剂
使铁元素完全沉淀,试剂 的化学式为
的化学式为(3)“沉锌”时,应保持溶液
 在6.8~7.0之间,
在6.8~7.0之间, 不能过低的原因是
不能过低的原因是(4)“过滤”时,经常采用抽滤的方式加快过滤的速度。实验室用如图乙所示的装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整(洗涤操作只需考虑一次):开抽气泵→a→b→d→

a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(5)高温煅烧碱式碳酸锌[
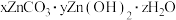 ]得到
]得到 ,取碱式碳酸锌
,取碱式碳酸锌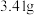 ,在高温下煅烧至恒重,得到固体
,在高温下煅烧至恒重,得到固体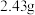 和标准状况下
和标准状况下 ,则该碱式碳酸锌的化学式为
,则该碱式碳酸锌的化学式为
您最近一年使用:0次
2021-09-09更新
|
1567次组卷
|
9卷引用:陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题
陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题全国2022届高三上学期第一次学业质量联合检测化学试题(已下线)备战2022年高考化学精准检测卷【全国卷】07广东省珠海市第二中学2022届高三十月月考化学试题山东省潍坊市第一中学2022届高三10月月考化学试题(已下线)第19周 晚练题-备战2022年高考化学周测与晚练(新高考专用)湖南省吉首市泸溪一中2022届高三第三次联合检测化学试题(已下线)押新高考卷14题 工艺流程综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)2019年高考浙江卷化学试题变式题(实验题)
名校
解题方法
7 . 连二亚硫酸钠( )是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产
)是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产 ,的装置如图甲所示。
,的装置如图甲所示。

在C中按照一定质量比加入甲醇和水,再加入适量甲酸钠和氢氧化钠固体,溶解。回答下列问题:
(1)仪器e的名称为___________ ,装置B的作用为___________ 。
(2)装置A中烧瓶内发生反应的离子方程式为___________ 。
(3) 与稀硫酸作用的离子方程式为
与稀硫酸作用的离子方程式为___________ ,反应过程中应该控制 的通入量,原因是
的通入量,原因是___________ 。
(4) 的制备原理为
的制备原理为 。用单线桥法标注电子转移的方向和数目
。用单线桥法标注电子转移的方向和数目___________ 。
(5)图乙为保险粉含量测定装置。称取样品 加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加
加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加 溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗
溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗 的
的 溶液
溶液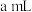 。
。

①图乙中2为 入口,通入
入口,通入 的作用是
的作用是___________ 。
②样品中连二亚硫酸钠的含量为___________ (用含 ,
, 的式子表示)。
的式子表示)。
 )是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产
)是重要的工业产品,在空气中易吸收氧气,具有脱氧、漂白、保鲜功能。俗称保险粉。受热易分解。在酸性条件下易发生歧化反应。同时有固体和气体生成。实验室模拟工业生产 ,的装置如图甲所示。
,的装置如图甲所示。
在C中按照一定质量比加入甲醇和水,再加入适量甲酸钠和氢氧化钠固体,溶解。回答下列问题:
(1)仪器e的名称为
(2)装置A中烧瓶内发生反应的离子方程式为
(3)
 与稀硫酸作用的离子方程式为
与稀硫酸作用的离子方程式为 的通入量,原因是
的通入量,原因是(4)
 的制备原理为
的制备原理为 。用单线桥法标注电子转移的方向和数目
。用单线桥法标注电子转移的方向和数目(5)图乙为保险粉含量测定装置。称取样品
 加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加
加入三口烧瓶。通过滴定仪控制滴定管向三口烧瓶快速滴加 溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗
溶液将连二亚硫酸钠氧化为硫酸钠,记录终点读数,共消耗 的
的 溶液
溶液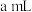 。
。
①图乙中2为
 入口,通入
入口,通入 的作用是
的作用是②样品中连二亚硫酸钠的含量为
 ,
, 的式子表示)。
的式子表示)。
您最近一年使用:0次
2021-09-09更新
|
1020次组卷
|
3卷引用:陕西省西安市长安区第一中学2022届高三第一次模拟考试化学试题
名校
解题方法
8 . 有八种短周期主族元素 ,其中
,其中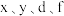 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。
随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为
的最高价氧化物对应水化物溶液(浓度均为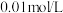 )的
)的 与原子序数的关系如图2所示。
与原子序数的关系如图2所示。

根据上述信息回答下列问题:
(1)g在元素周期表中的位置是___________ 。
(2)比较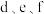 的简单离子半径大小为
的简单离子半径大小为____________________ (用离子符号表示); 的最高价氧化物对应的水化物酸性较强的是
的最高价氧化物对应的水化物酸性较强的是___________ (用化学式表示)。
(3)下列可作为比较e和f金属性强弱的依据是___________ (填字母)。
A.测等浓度相应氯化物水溶液的 B.测两种元素单质的硬度和熔、沸点
B.测两种元素单质的硬度和熔、沸点
C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素 组成的剧毒化合物
组成的剧毒化合物 不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为___________ 。
 ,其中
,其中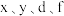 随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。
随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 的最高价氧化物对应水化物溶液(浓度均为
的最高价氧化物对应水化物溶液(浓度均为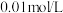 )的
)的 与原子序数的关系如图2所示。
与原子序数的关系如图2所示。
根据上述信息回答下列问题:
(1)g在元素周期表中的位置是
(2)比较
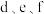 的简单离子半径大小为
的简单离子半径大小为 的最高价氧化物对应的水化物酸性较强的是
的最高价氧化物对应的水化物酸性较强的是(3)下列可作为比较e和f金属性强弱的依据是
A.测等浓度相应氯化物水溶液的
 B.测两种元素单质的硬度和熔、沸点
B.测两种元素单质的硬度和熔、沸点C.比较单质作还原剂时失去的电子数目的多少D.比较单质与同浓度盐酸反应的剧烈程度
(4)由元素
 组成的剧毒化合物
组成的剧毒化合物 不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
不慎泄漏时,通常用过氧化氢溶液处理,以减少污染,反应生成一种酸式盐和一种气体,二者溶于水均呈碱性,该反应的化学方程式为
您最近一年使用:0次
2021-07-25更新
|
210次组卷
|
3卷引用:陕西省咸阳市2021届高三上学期高考模拟检测(一)化学试题
陕西省咸阳市2021届高三上学期高考模拟检测(一)化学试题(已下线)第五章能力提升检测卷(精练)-2022年高考化学一轮复习讲练测河南省濮阳市第一高级中学2022-2023学年高三上学期第三次质量检测考试化学试题
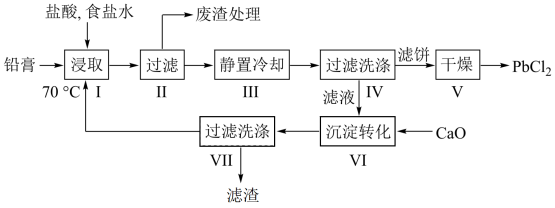
9 . 由废铅蓄电池的铅膏采用氯盐法制备PbCl2的工艺流程如图:
已知:①铅膏的组成如表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
(1)铅膏“浸取”时浓盐酸与水的配比(浓盐酸和水的体积比)及氯化钠的浓度均对铅浸取率有较大影响(如图所示):
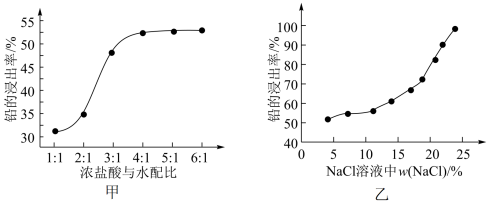
①由图甲确定适宜的配比为_______ 。
②已知70 °C时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是_______ ,工业上采用质量分数约为24%的食盐水,不能采用无限制提高w(NaCl)来提高铅的浸出率,其原因是_______ 。
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有_______ (至少写2种)。
(2)步骤Ⅵ加入CaCl2的目的是_______ .步骤Ⅶ滤液中溶质的主要成分为_______ 。
(3)“浸取”时会发生一系列反应。
①硫酸铅溶于氯化钠生成PbCl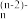 的离子方程式为
的离子方程式为_______ 。
②产生氯气的化学方程式为_______ 。

已知:①铅膏的组成如表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 质量分数/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
(1)铅膏“浸取”时浓盐酸与水的配比(浓盐酸和水的体积比)及氯化钠的浓度均对铅浸取率有较大影响(如图所示):

①由图甲确定适宜的配比为
②已知70 °C时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有
(2)步骤Ⅵ加入CaCl2的目的是
(3)“浸取”时会发生一系列反应。
①硫酸铅溶于氯化钠生成PbCl
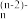 的离子方程式为
的离子方程式为②产生氯气的化学方程式为
您最近一年使用:0次
10 . 三氯化氮(NCl3)是一种强氧化剂,工业上可用于漂白和消毒,实验室可由氯气通入碳酸铵溶液中制得。某化学小组利用此原理进行实验室制备三氯化氮。
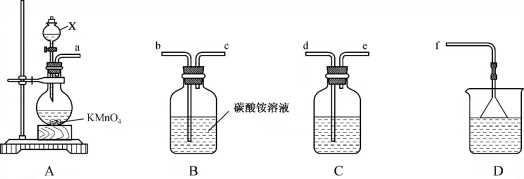
回答下列问题:
(1)装置A中仪器X的名称是_______ ,盛放的试剂是_______ ,装置A中发生反应的离子方程式为_______ 。
(2)整个装置的导管连接顺序为a→_______ →_______ →_______ →_______ →_______ 。
(3)装置B中发生反应的化学方程式为_______ 。
(4)装置C的作用为_______ 。装置D的作用为_______ 。
(5)三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._______ Na2SO3+_______ NCl3 +_______=_______Na2SO4 +_______ HCl+ _______NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:i._______ Na2SO3+_______ NCl3+_______=Na2SO4+_______ HCl+_______ NH4Cl
_______
②装置B反应后的溶液中三氯化氮的浓度为_______ mol·L-1。

回答下列问题:
(1)装置A中仪器X的名称是
(2)整个装置的导管连接顺序为a→
(3)装置B中发生反应的化学方程式为
(4)装置C的作用为
(5)三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._______ Na2SO3+_______ NCl3 +_______=_______Na2SO4 +_______ HCl+ _______NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:i._______ Na2SO3+_______ NCl3+_______=Na2SO4+_______ HCl+_______ NH4Cl
②装置B反应后的溶液中三氯化氮的浓度为
您最近一年使用:0次
2021-06-16更新
|
761次组卷
|
3卷引用:陕西省宝鸡市2021届高三下学期5月大联考理综化学试题



