陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
陕西
高三
模拟预测
2021-06-18
544次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学反应原理、化学实验基础、物质结构与性质
陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
陕西
高三
模拟预测
2021-06-18
544次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学反应原理、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
较易(0.85)
1. 化学与生产、生活及社会发展密切相关。下列说法不正确的是
| A.中国天眼的“眼眶”是钢铁结成的圈梁,属于新型无机非金属材料 |
| B.“84"消毒液不能与洁厕灵混合使用 |
| C.“N95”口罩所使用的熔喷布为聚丙烯,属于合成高分子材料 |
| D.我国提出网络强国战略,光缆线路总长超过三千万公里,光缆的主要成分是SiO2 |
您最近一年使用:0次
2021-06-16更新
|
274次组卷
|
2卷引用:陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
单选题
|
较易(0.85)
2. 设NA表示阿伏加德罗常数的值。下列说法正确的是
| A.14 g聚丙烯中含C-H键总数目为2NA |
| B.氢氧燃料电池正极消耗22. 4 L(标准状况)气体时,电路中通过的电子数目为2NA |
| C.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0. 2NA之间 |
| D.电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA |
【知识点】 阿伏加德罗常数的求算解读 氢氧燃料电池解读 电解原理的理解及判断解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
3. 下列关于2 -环已基丙烯( )和2-苯基丙烯(
)和2-苯基丙烯(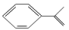 )的说法中正确的是
)的说法中正确的是
 )和2-苯基丙烯(
)和2-苯基丙烯( )的说法中正确的是
)的说法中正确的是| A.2 -苯基丙烯的分子式为C9H16 |
| B.2 -环己基丙烯分子中所有碳原子可能共平面 |
| C.二者均可发生缩聚反应和氧化反应 |
| D.2 -苯基丙烯的一氯代产物只有5种。 |
【知识点】 有机官能团的性质及结构 有机分子中原子共面的判断解读
您最近一年使用:0次
单选题
|
适中(0.65)
名校
4. 某化学兴趣小组用如图所示装置检验Pb(NO3)2受热分解的产物(图中夹持和加热设备略去)。在试管中放入研碎的Pb(NO3)2晶体后,加热;实验结束后,试管中得到黄色粉末(PbO),U形管下部有少量液体X,集气瓶中收集到无色气体Y。下列说法不正确的是
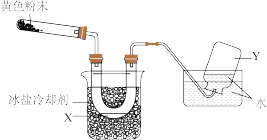

| A.液体X可能是液化的NO2或N2O4, |
| B.在装置中用锡纸将胶塞、胶管与产生的气体隔开,主要是为了防止其被生成的气体腐蚀。 |
| C.气体Y可能是O2,也可能是NO2与水反应后生成的NO |
| D.停止反应,应注意先把导气管移出水面,然后熄灭火焰 |
【知识点】 硝酸盐的不稳定性解读 物质性质实验方案的设计解读
您最近一年使用:0次
2021-06-16更新
|
642次组卷
|
5卷引用:陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
陕西省宝鸡市2021届高三下学期5月大联考理综化学试题吉林省长春外国语学校2022届高三上学期期初考试化学试题(已下线)专题05 化学基础实验—2022年高考化学二轮复习讲练测(全国版)-练习河北省石家庄市第十五中学2022-2023学年高三上学期阶段性考试化学试题(已下线)章末综合评价(四)
单选题
|
适中(0.65)
解题方法
5. 某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X、Y三种简单离子的核外电子排布相同。下列说法正确的是
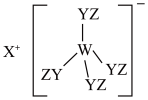

| A.X与Y、Y与Z均可形成X2Y、Z2Y2型化合物 |
| B.离子半径:X>W>Y>Z |
| C.X、Y、Z组成的化合物中只含有离子键 |
| D.常温常压下熔点:X2Y<Z2Y |
【知识点】 根据原子结构进行元素种类推断解读
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 元素钒在溶液中有多种存在形式,比如:V2+(紫色)、V3+(绿色)、VO2+(蓝色)、 (黄色)等。钒液可充电电池的工作原理如图所示。已知充电时,左槽溶液颜色由蓝色逐渐变为黄色,溶液中c(H+)=1.0mol·L-1,阴离子为
(黄色)等。钒液可充电电池的工作原理如图所示。已知充电时,左槽溶液颜色由蓝色逐渐变为黄色,溶液中c(H+)=1.0mol·L-1,阴离子为 。下列说法
。下列说法不正确 的是
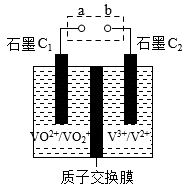
 (黄色)等。钒液可充电电池的工作原理如图所示。已知充电时,左槽溶液颜色由蓝色逐渐变为黄色,溶液中c(H+)=1.0mol·L-1,阴离子为
(黄色)等。钒液可充电电池的工作原理如图所示。已知充电时,左槽溶液颜色由蓝色逐渐变为黄色,溶液中c(H+)=1.0mol·L-1,阴离子为 。下列说法
。下列说法
| A.a极为电池的正极 |
B.充电时,阳极电极反应式为VO2++H2O-e-= +2H+ +2H+ |
| C.放电过程中,右槽溶液颜色由紫色变为绿色 |
| D.放电时,电子由C2极流出经交换膜流向C1极 |
您最近一年使用:0次
2020-11-16更新
|
579次组卷
|
4卷引用:辽宁省辽西联合校2021届高三上学期期中考试化学试题
辽宁省辽西联合校2021届高三上学期期中考试化学试题(已下线)第四章 化学反应与电能(能力提升)-2020-2021学年高二化学单元测试定心卷(人教版2019选择性必修一)黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
单选题
|
较难(0.4)
名校
解题方法
7. 常温下,向20 mL 0.01 mol·L-1的NaOH溶液中逐滴加入0.01 mol·L-1的CH3COOH溶液,溶液中由水电离出的c水(OH-)的对数随加入CH3COOH溶液体积的变化如图所示,下列说法正确的是
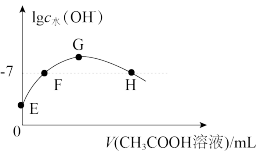

| A.H、F点溶液显中性 |
| B.E点溶液中由水电离的c水(OH—)=1×10-3 mol·L-1 |
| C.H点溶液中离子浓度关系为c(CH3COO—)>c(Na+)>c(H+)>c(OH—) |
| D.G点溶液中各离子浓度关系为c(CH3COO—)=c(Na+)+c(H+)—c(OH—) |
您最近一年使用:0次
2021-06-16更新
|
641次组卷
|
2卷引用:陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
8. 三氯化氮(NCl3)是一种强氧化剂,工业上可用于漂白和消毒,实验室可由氯气通入碳酸铵溶液中制得。某化学小组利用此原理进行实验室制备三氯化氮。
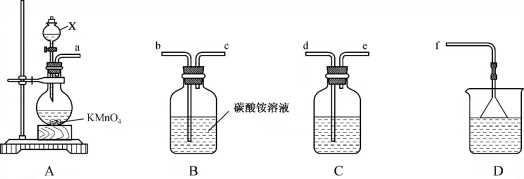
回答下列问题:
(1)装置A中仪器X的名称是_______ ,盛放的试剂是_______ ,装置A中发生反应的离子方程式为_______ 。
(2)整个装置的导管连接顺序为a→_______ →_______ →_______ →_______ →_______ 。
(3)装置B中发生反应的化学方程式为_______ 。
(4)装置C的作用为_______ 。装置D的作用为_______ 。
(5)三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._______ Na2SO3+_______ NCl3 +_______=_______Na2SO4 +_______ HCl+ _______NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:i._______ Na2SO3+_______ NCl3+_______=Na2SO4+_______ HCl+_______ NH4Cl
_______
②装置B反应后的溶液中三氯化氮的浓度为_______ mol·L-1。

回答下列问题:
(1)装置A中仪器X的名称是
(2)整个装置的导管连接顺序为a→
(3)装置B中发生反应的化学方程式为
(4)装置C的作用为
(5)三氯化氮浓度的测定:准确量取20mL装置B中反应后的溶液,置于100mL容量瓶中,用水稀释至刻度,摇匀,吸取25.0mL于烧杯中,加入足量V1mLc1mol·L-1亚硫酸钠溶液,充分反应后,向烧杯中加入足量V2mLc2mol·L-1盐酸酸化的氯化钡溶液,得沉淀mg。
已知:i._______ Na2SO3+_______ NCl3 +_______=_______Na2SO4 +_______ HCl+ _______NH4Cl;
ii. BaCl2 +Na2SO4=BaSO↓+ 2HCl。
①请完成反应i的化学方程式:i._______ Na2SO3+_______ NCl3+_______=Na2SO4+_______ HCl+_______ NH4Cl
②装置B反应后的溶液中三氯化氮的浓度为
您最近一年使用:0次
2021-06-16更新
|
762次组卷
|
3卷引用:陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
解答题-工业流程题
|
适中(0.65)
9. 由废铅蓄电池的铅膏采用氯盐法制备PbCl2的工艺流程如图:
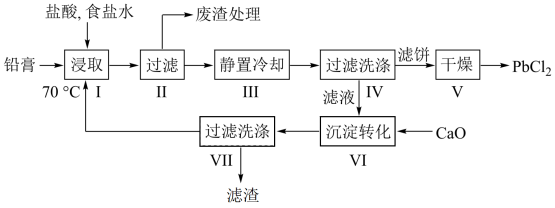
已知:①铅膏的组成如表:
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
(1)铅膏“浸取”时浓盐酸与水的配比(浓盐酸和水的体积比)及氯化钠的浓度均对铅浸取率有较大影响(如图所示):
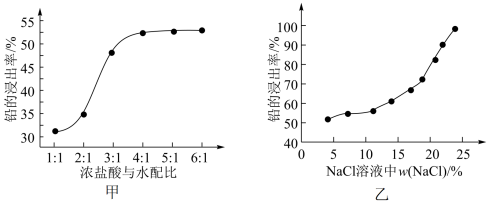
①由图甲确定适宜的配比为_______ 。
②已知70 °C时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是_______ ,工业上采用质量分数约为24%的食盐水,不能采用无限制提高w(NaCl)来提高铅的浸出率,其原因是_______ 。
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有_______ (至少写2种)。
(2)步骤Ⅵ加入CaCl2的目的是_______ .步骤Ⅶ滤液中溶质的主要成分为_______ 。
(3)“浸取”时会发生一系列反应。
①硫酸铅溶于氯化钠生成PbCl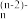 的离子方程式为
的离子方程式为_______ 。
②产生氯气的化学方程式为_______ 。

已知:①铅膏的组成如表:
| 物相 | PbO | PbO2 | PbSO4 | Pb | 总铅 |
| 质量分数/% | 15.89 | 4.86 | 33.74 | 34.03 | 76.05 |
②PbCl2是白色结晶性粉末,微溶于冷水,易溶于热水、浓盐酸和氢氧化钠溶液。
回答下列问题:
(1)铅膏“浸取”时浓盐酸与水的配比(浓盐酸和水的体积比)及氯化钠的浓度均对铅浸取率有较大影响(如图所示):

①由图甲确定适宜的配比为
②已知70 °C时,NaCl的溶解度为37.8 g,由图乙可知铅的浸出率与NaCl质量分数的关系是
③提高铅的浸出率除浓盐酸与水的配比和w(NaC)外,还可采取的措施有
(2)步骤Ⅵ加入CaCl2的目的是
(3)“浸取”时会发生一系列反应。
①硫酸铅溶于氯化钠生成PbCl
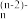 的离子方程式为
的离子方程式为②产生氯气的化学方程式为
您最近一年使用:0次
10. SO2、NO、NO2、CO都是污染大气的有害气体,对其进行回收利用是节能减排的重要课题。
(1)上述四种气体中直接排入空气时会引起酸雨的有_______ (填化学式)。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ∆H=- 196.6 kJ∙mol-1
2SO3(g) ∆H=- 196.6 kJ∙mol-1
2NO(g)+ O2(g) 2NO2(g) ∆H=-113.0 kJ∙mol-1
2NO2(g) ∆H=-113.0 kJ∙mol-1
①反应:NO2(g)+ SO2(g) SO3(g)+ NO(g)的∆H=
SO3(g)+ NO(g)的∆H=_______ kJ∙mol-1。
②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+ SO2(g) SO3(g)+NO(g),下列能说明反应达到平衡状态的是
SO3(g)+NO(g),下列能说明反应达到平衡状态的是_______ (填字母)。
a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1mol NO
③测得②中反应达到平衡时NO与NO2的体积之比为37:13,则在该温度下反应:NO2(g)+ SO2(g) SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K=_______
(3)CO可用于合成甲醇,其反应的化学方程式为CO(g) +2H2(g) CH3OH(g)。 在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(
CH3OH(g)。 在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。下列说法正确的是
)与温度(T)、压强(p)的关系如图所示。下列说法正确的是_______ (填字母)。

A.合成甲醇的反应为吸热反应
B.压强为p1>p2
C. A、B、C三点的平衡常数为KA= KB> KC
D.若达平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积也为10 L
(1)上述四种气体中直接排入空气时会引起酸雨的有
(2)已知:2SO2(g)+O2(g)
 2SO3(g) ∆H=- 196.6 kJ∙mol-1
2SO3(g) ∆H=- 196.6 kJ∙mol-12NO(g)+ O2(g)
 2NO2(g) ∆H=-113.0 kJ∙mol-1
2NO2(g) ∆H=-113.0 kJ∙mol-1①反应:NO2(g)+ SO2(g)
 SO3(g)+ NO(g)的∆H=
SO3(g)+ NO(g)的∆H=②一定条件下,将NO2与SO2以体积比1:1置于恒温恒容的密闭容器中发生反应:NO2(g)+ SO2(g)
 SO3(g)+NO(g),下列能说明反应达到平衡状态的是
SO3(g)+NO(g),下列能说明反应达到平衡状态的是a.混合气体的密度保持不变 b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变 d.每生成1molSO3的同时消耗1mol NO
③测得②中反应达到平衡时NO与NO2的体积之比为37:13,则在该温度下反应:NO2(g)+ SO2(g)
 SO3(g)+NO(g)的平衡常数K=
SO3(g)+NO(g)的平衡常数K=(3)CO可用于合成甲醇,其反应的化学方程式为CO(g) +2H2(g)
 CH3OH(g)。 在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(
CH3OH(g)。 在一容积可变的密闭容器中充有10molCO与20molH2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率( )与温度(T)、压强(p)的关系如图所示。下列说法正确的是
)与温度(T)、压强(p)的关系如图所示。下列说法正确的是
A.合成甲醇的反应为吸热反应
B.压强为p1>p2
C. A、B、C三点的平衡常数为KA= KB> KC
D.若达平衡状态A时,容器的体积为10 L,则在平衡状态B时容器的体积也为10 L
您最近一年使用:0次
2021-06-16更新
|
206次组卷
|
3卷引用:陕西省宝鸡市2021届高三下学期5月大联考理综化学试题
三、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
11. 铁是一种常见的金属,在生产生活中用途广泛。
(1)铁在元素周期表中的位置是_______ , 其基态原子的电子排布式为_______ ;铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用_______ 摄取铁元素的原子光谱。
(2)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁(Fe3N),NH3分子的立体构型为_______ ;1mol Fe(CO)5分子中含有σ键为_______ mol。
(3)把氯气通入黄血盐{K4[Fe(CN)6]}溶液中,得到赤血盐{K3[Fe(CN)6]},该反应的化学方程式为_______ ;CN- 中碳原子的杂化轨道类型为_______ 。C、N、O元素的第一电离能的大小顺序为_______ 。
(4)FeCl3可与KSCN溶液发生显色反应。SCN- 与N2O互为等电子体,则SCN-的电子式为_______ 。
(1)铁在元素周期表中的位置是
(2)Fe(CO)5与NH3在一定条件下可合成一种具有磁性的氮化铁(Fe3N),NH3分子的立体构型为
(3)把氯气通入黄血盐{K4[Fe(CN)6]}溶液中,得到赤血盐{K3[Fe(CN)6]},该反应的化学方程式为
(4)FeCl3可与KSCN溶液发生显色反应。SCN- 与N2O互为等电子体,则SCN-的电子式为
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-有机推断题
|
较难(0.4)
解题方法
12. 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图所示:

请回答下列问题:
(1)A的结构简式为_______
(2)请写出下列反应的化学方程式及反应类型:
反应③:_______ ;反应类型为_______ 。反应④:_______ 。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是_______ 。
(4)G的相对分子质量为_______ 。
(5)E中含有的官能团的名称是_______ 。已知T(C7H7NO2)是E在碱性条件下的水解产物,符合下列条件的T的同分异构体有_______ 种,其中核磁共振氢谱上有4组峰,且峰面积比为1:2:2:2的物质的结构简式为_______ 。
①—NH2直接连在苯环上;
②能与新制氢氧化铜悬浊液共热产生红色固体。
(6)参照上述合成路线,以CH3CH2COCl和 为原料,经三步合成某化工产.品
为原料,经三步合成某化工产.品 的路线为(其他无机试剂任选)。
的路线为(其他无机试剂任选)。_______ 。

请回答下列问题:
(1)A的结构简式为
(2)请写出下列反应的化学方程式及反应类型:
反应③:
(3)已知吡啶是一种有机碱,在反应⑤中的作用是
(4)G的相对分子质量为
(5)E中含有的官能团的名称是
①—NH2直接连在苯环上;
②能与新制氢氧化铜悬浊液共热产生红色固体。
(6)参照上述合成路线,以CH3CH2COCl和
 为原料,经三步合成某化工产.品
为原料,经三步合成某化工产.品 的路线为(其他无机试剂任选)。
的路线为(其他无机试剂任选)。
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、认识化学科学、化学反应原理、化学实验基础、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 漂白粉和漂粉精 加聚反应 新型无机非金属材料 光导纤维与硅芯片 | |
| 2 | 0.85 | 阿伏加德罗常数的求算 氢氧燃料电池 电解原理的理解及判断 | |
| 3 | 0.65 | 有机官能团的性质及结构 有机分子中原子共面的判断 | |
| 4 | 0.65 | 硝酸盐的不稳定性 物质性质实验方案的设计 | |
| 5 | 0.65 | 根据原子结构进行元素种类推断 | |
| 6 | 0.65 | 原电池、电解池综合考查 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.4 | 水溶液中水的电离程度及的计算 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 二、解答题 | |||
| 8 | 0.65 | 化学方程式计算中物质的量的运用 氧化还原反应方程式的配平 氯气的实验室制法 常见无机物的制备 | 实验探究题 |
| 9 | 0.65 | 氧化还原反应方程式的配平 影响化学反应速率的外因 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 10 | 0.65 | 盖斯定律及其有关计算 化学平衡的移动及其影响因素 化学平衡状态的判断方法 化学平衡常数的有关计算 | 原理综合题 |
| 12 | 0.4 | 根据题给物质选择合适合成路线 有机推断综合考查 胺的性质与应用 酰胺的性质与应用 | 有机推断题 |
| 三、填空题 | |||
| 11 | 0.65 | 电离能 等电子原理的应用 杂化轨道理论 配合物的结构与性质 | |



