常温下,向20 mL 0.01 mol·L-1的NaOH溶液中逐滴加入0.01 mol·L-1的CH3COOH溶液,溶液中由水电离出的c水(OH-)的对数随加入CH3COOH溶液体积的变化如图所示,下列说法正确的是
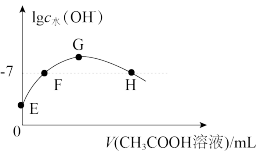

| A.H、F点溶液显中性 |
| B.E点溶液中由水电离的c水(OH—)=1×10-3 mol·L-1 |
| C.H点溶液中离子浓度关系为c(CH3COO—)>c(Na+)>c(H+)>c(OH—) |
| D.G点溶液中各离子浓度关系为c(CH3COO—)=c(Na+)+c(H+)—c(OH—) |
更新时间:2021-06-16 21:38:24
|
相似题推荐
单选题
|
较难
(0.4)
【推荐1】向 二元弱酸溶液中逐滴滴加
二元弱酸溶液中逐滴滴加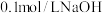 溶液,混合溶液中
溶液,混合溶液中 、
、 和
和 的物质的量分数
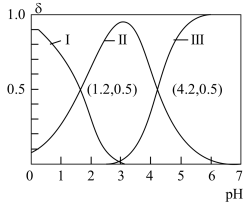
的物质的量分数 随pH变化的关系如图所示。下列叙述正确的是。
随pH变化的关系如图所示。下列叙述正确的是。
 二元弱酸溶液中逐滴滴加
二元弱酸溶液中逐滴滴加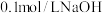 溶液,混合溶液中
溶液,混合溶液中 、
、 和
和 的物质的量分数
的物质的量分数 随pH变化的关系如图所示。下列叙述正确的是。
随pH变化的关系如图所示。下列叙述正确的是。
A.曲线II代表的微粒是 |
B. 的数量级为 的数量级为 |
C.向 的溶液中持续滴加NaOH溶液,水的电离程度持续变大 的溶液中持续滴加NaOH溶液,水的电离程度持续变大 |
D.滴加NaOH溶液的过程中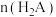 、 、 、 、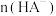 之和不变 之和不变 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列叙述中正确的是
A.锅炉中沉积的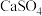 可用 可用 溶液浸泡转化为 溶液浸泡转化为 ,后用酸溶解去除 ,后用酸溶解去除 |
B.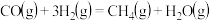 在一定条件下能自发进行,则该反应的 在一定条件下能自发进行,则该反应的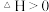 |
C.工业反应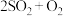 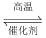 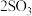 中采用高温既可以加快反应速率,也可以提高原料转化率 中采用高温既可以加快反应速率,也可以提高原料转化率 |
D.常温下,向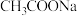 溶液中滴加盐酸,水的电离程度增大 溶液中滴加盐酸,水的电离程度增大 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】下列有关实验现象和解释或结论都正确的组合是
| 选项 | 实验操作 | 现象 | 解释或结论 |
A | 相同条件下,分别测量0.1molL1和0.01molL1醋酸溶液的导电性 | 前者的导电性强 | 醋酸浓度越大,电离程度越大 |
B | 向FeCl3和KSCN的混合溶液中加入KCl固体 | 血红色溶液变浅 | 增大KCl的浓度,使得平衡逆向移动 |
C | 两支试管各盛4mL0.1mol/L酸性高锰酸钾溶液,分别加入2mL0.1mol/L草酸溶液和2mL0.2mol/L草酸溶液 | 加入0.2mol/L草酸溶液的试管中,高锰酸钾溶液褪色更快 | 反应物浓度越大,反应速率越快 |
D | 把充有NO2和N2O4的平衡球装置分别放入热水和冷水中 | 热水中颜色更深 | 其他条件不变时,温度升高,平衡向吸热反应方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐1】室温下,通过下列实验探究 溶液的性质。下列有关说法正确的是
溶液的性质。下列有关说法正确的是
 溶液的性质。下列有关说法正确的是
溶液的性质。下列有关说法正确的是| 实验 | 实验操作和现象 |
| 1 | 用 计测定 计测定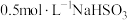 溶液的 溶液的 ,测得 ,测得 约为6.4 约为6.4 |
| 2 | 向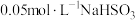 溶液中滴加过量 溶液中滴加过量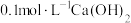 溶液,产生白色沉淀 溶液,产生白色沉淀 |
| 3 | 向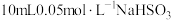 溶液中滴加 溶液中滴加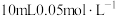 盐酸,反应结束,测得 盐酸,反应结束,测得 约为3.2 约为3.2 |
| 4 | 向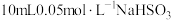 溶液中漓加 溶液中漓加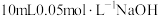 溶液,反应结束,测得 溶液,反应结束,测得 约为9.3 约为9.3 |
A.实验1中: 溶液中满足 溶液中满足 的水解程度大于其电离程度 的水解程度大于其电离程度 |
B.实验2反应静置后的上层清液中: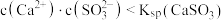 |
C.实验3滴加过程中: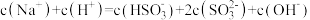 |
D.实验4滴加过程中: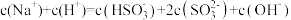 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】下列说法正确的是
A.常温下,用pH计测得0.1mol·L-1NaHC2O4溶液的pH=5.2,则该温度下,草酸的 |
B.常温下,同浓度的强酸和强碱溶液等体积混合后,由水电离出的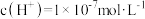 |
| C.常温下,将pH=9的CH3COONa溶液与pH=9的NaOH溶液混合,混合溶液的pH大于9 |
D.100mLpH=2的氯水中, |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】25℃时,下列对于Na2SO3与NaHSO3的混合溶液中微粒浓度关系的说法正确的是
| A.一定存在3c(Na+)=c(HSO3−)+c(SO32−)+c(H2SO3) |
| B.一定存在c(Na+)+c(H+)=c(HSO3−)+c(SO32−)+c(OH-) |
| C.若混合溶液中n(Na2SO3)=2n(NaHSO3)时,溶液呈碱性,则有c(Na+)>c(SO32−)>c(HSO3−)>c(OH−)>c(H+) |
| D.若混合溶液中n(Na2SO3)=n(NaHSO3)时,溶液呈酸性,则有c(Na+)>c(HSO3−)>c(H+)>c(SO32−)>c(OH−) |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】室温下,向 浓度均为
浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 的
的 溶液。已知:
溶液。已知: 的
的 ,
,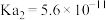 ,
,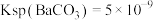 ,
, ,
,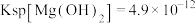 。下列说法
。下列说法不正确 的是
 浓度均为
浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 的
的 溶液。已知:
溶液。已知: 的
的 ,
,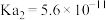 ,
,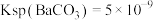 ,
, ,
,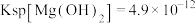 。下列说法
。下列说法A.加入 的 的 溶液后,在上层清液中滴加 溶液后,在上层清液中滴加 溶液无明显现象 溶液无明显现象 |
B. 溶液中存在关系, 溶液中存在关系,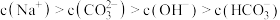 |
C.在 和 和 的混合溶液加几滴稀盐酸, 的混合溶液加几滴稀盐酸, 几乎不变 几乎不变 |
D.向 和 和 混合溶液加入 混合溶液加入 溶液,可能生成碱式碳酸镁 溶液,可能生成碱式碳酸镁 |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】已知:室温下 的电离常数
的电离常数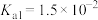 ,
, 。室温下,用
。室温下,用 溶液溶液吸收
溶液溶液吸收 的过程如图所示。
的过程如图所示。
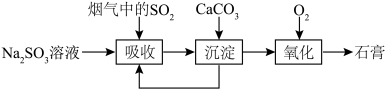
下列说法正确的是
 的电离常数
的电离常数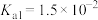 ,
, 。室温下,用
。室温下,用 溶液溶液吸收
溶液溶液吸收 的过程如图所示。
的过程如图所示。
下列说法正确的是
A. 溶液中: 溶液中: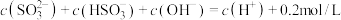 |
B.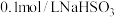 溶液溶液中: 溶液溶液中: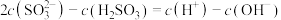 |
C.吸收烟气后的溶液中: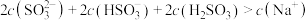 |
D.“沉淀”得到的上层清液中: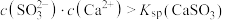 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】25℃时,向20.0mL0.1mol·L-1某二元弱酸H2M的溶液中逐滴滴入等浓度的NaOH溶液,混合溶液中lgY[Y代表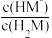 或
或 ]与pH的关系如图所示。下列相关结论正确的是
]与pH的关系如图所示。下列相关结论正确的是
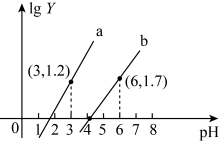
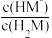 或
或 ]与pH的关系如图所示。下列相关结论正确的是
]与pH的关系如图所示。下列相关结论正确的是
A.曲线b表示pH与lg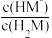 的变化关系 的变化关系 |
B.25°C时,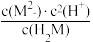 =10-11.9 =10-11.9 |
| C.当溶液的pH=6时,c(Na+)+c(H+)=c(HM-)+c(OH-)+c(M2-) |
| D.当滴入20.00mLNaOH溶液时,c(Na+)>c(H+)>c(M2-)>c(OH-) |
您最近一年使用:0次



