室温下,向 浓度均为
浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 的
的 溶液。已知:
溶液。已知: 的
的 ,
,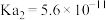 ,
,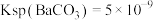 ,
, ,
,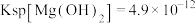 。下列说法
。下列说法不正确 的是
 浓度均为
浓度均为 的
的 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 的
的 溶液。已知:
溶液。已知: 的
的 ,
,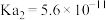 ,
,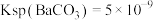 ,
, ,
,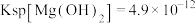 。下列说法
。下列说法A.加入 的 的 溶液后,在上层清液中滴加 溶液后,在上层清液中滴加 溶液无明显现象 溶液无明显现象 |
B. 溶液中存在关系, 溶液中存在关系,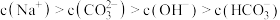 |
C.在 和 和 的混合溶液加几滴稀盐酸, 的混合溶液加几滴稀盐酸, 几乎不变 几乎不变 |
D.向 和 和 混合溶液加入 混合溶液加入 溶液,可能生成碱式碳酸镁 溶液,可能生成碱式碳酸镁 |
更新时间:2024-04-10 08:35:43
|
相似题推荐
单选题
|
较难
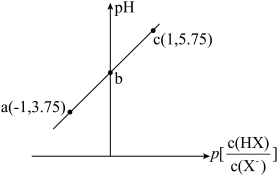
(0.4)
名校
【推荐1】二元有机酸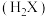 的电离常数
的电离常数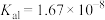 、
、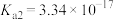 。
。 难溶于水,常温下,将
难溶于水,常温下,将 溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与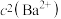 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是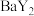 易溶于水。
易溶于水。
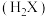 的电离常数
的电离常数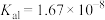 、
、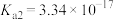 。
。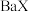 难溶于水,常温下,将
难溶于水,常温下,将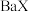 溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中
溶解在一定浓度的HY溶液中,直至不再溶解,测得混合液中 与
与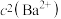 的关系如图所示。下列说法错误的是
的关系如图所示。下列说法错误的是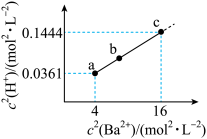
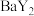 易溶于水。
易溶于水。A.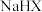 溶液显碱性 溶液显碱性 |
B.溶度积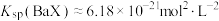 |
C.b点: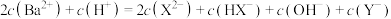 |
D.若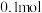 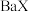 溶于 溶于 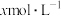 HY溶液中得到氢离子浓度与 HY溶液中得到氢离子浓度与 点相等,则 点相等,则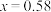 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐2】25℃时,用0.1mol•L-1NaOH溶液滴定20mL 0.1mol•L-1 H2SO3溶液的滴定曲线如图所示.下列说法正确的是

| A.a点:c(H2SO3)+ c(HSO3-)+c(SO32-)=0.1 mol•L-1 |
| B.b点:c(Na+)>c(HSO3-.)> c(H2SO3)> c(SO32-) |
| C.溶液导电性b>c |
| D.a、b、c、d中,d点水的电离度最大 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
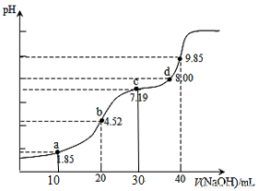
【推荐3】已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol/L的盐酸和醋酸的混合溶液中逐滴加入0.01mol/L的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是

| A.a点溶液中,c(CH3COO-)数量级约为10-5 |
B.b点溶液中,c(Cl-)>c(NH )>c(CH3COOH)>c(H+)>c(OH-) )>c(CH3COOH)>c(H+)>c(OH-) |
C.c点溶液中,c(NH )+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH) )+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH) |
D.d点溶液中,c(NH )=c(CH3COOH)+2c(CH3COO-) )=c(CH3COOH)+2c(CH3COO-) |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
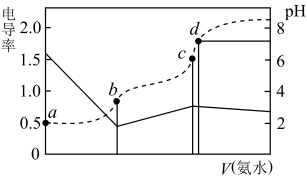
【推荐1】已知: 。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随
。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
 。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随
。室温下,向0.10mol/LHX溶液中滴加0.10mol/LNaOH溶液,溶液pH随 变化关系如图所示。下列说法错误的是
变化关系如图所示。下列说法错误的是
| A.溶液中水的电离程度:a<b<c |
B.b点溶液中: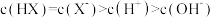 |
C.c点溶液中: |
D.室温下NaX的水解平衡常数为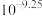 |
您最近半年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】下列各溶液中,离子的物质的量和物质的量浓度关系正确的是
| A.pH=2的醋酸中:n(H+)=0.001 mol |
| B.pH=x的CH3COOH溶液100 mL,稀释10倍后,pH=y,y-x>1 |
| C.饱和NaHS溶液(已知NaHS溶液呈碱性):c(H2S)>c(S2-) |
| D.pH相同的①CH3COONa ②Na2CO3 ③NaClO三种溶液中c(Na+):①>②>③ |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐3】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O )]和-lgc(C2O
)]和-lgc(C2O )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是

 )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O )]和-lgc(C2O
)]和-lgc(C2O )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
A.曲线M表示 和 和 的关系 的关系 |
| B.Ka1的数量级为10-5 |
C.向NaHC2O4溶液中加入少量NaOH至 时,溶液的pH为5 时,溶液的pH为5 |
D.在NaHC2O4溶液中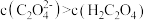 |
您最近半年使用:0次
单选题
|
较难
(0.4)
【推荐1】牙齿表面有一层牙釉质在保护着,存在如下平衡:
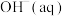
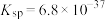 ,已知的
,已知的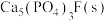 的
的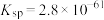 。下列说法错误的是
。下列说法错误的是

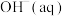
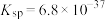 ,已知的
,已知的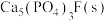 的
的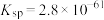 。下列说法错误的是
。下列说法错误的是| A.口腔中残留大量的酸性物质会破坏牙釉质 |
| B.牙膏中添加适量的磷酸盐,可以有效保护牙齿 |
C.若用碳酸氢钠稀溶液进行漱口,会使上述平衡发生移动,此时 变小 变小 |
D.使用含氟(NaF)牙膏,可实现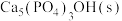 与 与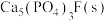 的转化 的转化 |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列方案设计、现象和结论正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究1-溴丁烷的消去反应 | 向圆底烧瓶中加入2.0gNaOH和15mL乙醇,搅拌,微热。将产生的气体通入酸性KMnO4溶液中 | 酸性KMnO4溶液褪色,说明1-溴丁烷发生消去反应生成1-丁烯 |
| B | 证明Ksp(CuS)<Ksp(ZnS) | 在2mL0.01mol/L的Na2S溶液中先滴入几滴0.01mol/LZnSO4溶液,再滴入0.01mol/LCuSO4溶液 | 先有白色沉淀生成,又出现黑色沉淀,说明Ksp(CuS)<Ksp(ZnS) |
| C | 探究Fe2+、Br-的还原性强弱 | 向FeBr2溶液中加入过量氯水,再加CCl4萃取 | 若CCl4层无色,则Fe2+的还原性强于Br- |
| D | 证明溴乙烷中还有溴元素 | 取少量溴乙烷与NaOH溶液共热,一段时间后,向反应液中加入足量硝酸,再滴入几滴AgNO3溶液 | 产生淡黄色沉淀,证明溴乙烷中含有溴元素 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
单选题
|
较难
(0.4)
名校
解题方法
【推荐3】向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中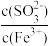 变化的曲线如图所示。
变化的曲线如图所示。

实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
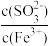 变化的曲线如图所示。
变化的曲线如图所示。
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是
| A.检验a点溶液中反应生成的阴离子所需试剂为:稀硝酸和BaCl2溶液 |
B.c点和d点出现上述现象的主要原因是Fe3+和 发生双水解反应 发生双水解反应 |
C.b点较a点溶液pH升高的主要原因:2Fe3++ +H2O = 2Fe2++ +H2O = 2Fe2++ +2H+ +2H+ |
| D.向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+ |
您最近半年使用:0次



