解题方法
1 . 草酸钻可用于指示剂和催化剂。工业上用水钻矿(主要成分为 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 的工艺流程如图所示:
的工艺流程如图所示:
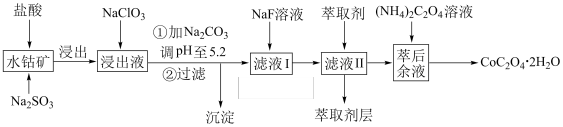
已知:①浸出液含有的阳离子主要有 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;
②酸性条件下, 不会氧化
不会氧化 ,
,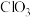 转化为
转化为 ;
;
③部分阳离子的氢氧化物沉淀时溶液的pH如下表:
(1)浸出过程中加入 的主要目的是
的主要目的是_______ , 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)向浸出液中加入 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(3)“加 调pH至5.2”,过滤所得沉淀的成分为
调pH至5.2”,过滤所得沉淀的成分为_______ (填化学式)。
(4)向滤液Ⅰ中加入NaF溶液得到沉淀的主要成分是_______ (填化学式)。
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜pH范围是_______ (填字母)。
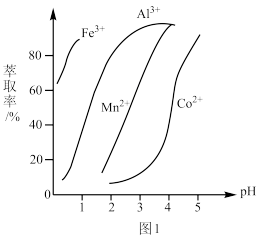
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(6) (
(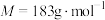 )热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
)热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
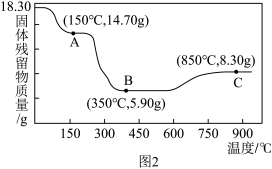
①用化学方程式表示A点到B点的物质变化_______ 。
②C点所示产物的化学式是_______ 。
 ,含少量
,含少量 、
、 、MnO、MgO、CaO、
、MnO、MgO、CaO、 等)制取
等)制取 的工艺流程如图所示:
的工艺流程如图所示:
已知:①浸出液含有的阳离子主要有
 、
、 、
、 、
、 、
、 、
、 、
、 等;
等;②酸性条件下,
 不会氧化
不会氧化 ,
,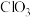 转化为
转化为 ;
;③部分阳离子的氢氧化物沉淀时溶液的pH如下表:
| 沉淀物 |  |  |  |  |  |
| 开始沉淀 | 2.7 | 7.6 | 4.0 | 7.6 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 5.2 | 9.2 | 9.8 |
 的主要目的是
的主要目的是 发生反应的离子方程式为
发生反应的离子方程式为(2)向浸出液中加入
 发生反应的离子方程式为
发生反应的离子方程式为(3)“加
 调pH至5.2”,过滤所得沉淀的成分为
调pH至5.2”,过滤所得沉淀的成分为(4)向滤液Ⅰ中加入NaF溶液得到沉淀的主要成分是
(5)萃取剂对金属离子的萃取率与pH的关系如图1所示,萃取剂的作用是除锰离子,其使用的适宜pH范围是

a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(6)
 (
(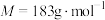 )热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
)热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后在空气中加热。A、B、C均为纯净物。
①用化学方程式表示A点到B点的物质变化
②C点所示产物的化学式是
您最近一年使用:0次
解题方法
2 . 氮化铬(CrN)是一种良好的耐磨材料,难溶于水。某实验小组用无水氯化铬(CrCl3)与氨气在高温下反应制备氮化铬,装置如图所示(夹持装置略)。
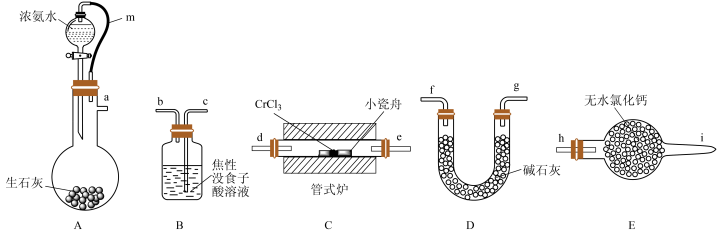
已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:
(1)装置A中橡皮管m的作用是____ ,盛生石灰的仪器名称是____ 。
(2)装置A中CaO可用NaOH固体代替,其原因是____ 。
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为____ 。
(4)制备氮化铬时,装置的接口连接顺序依次为a____ (装置不能重复使用)。
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为_____ 。
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为____ 。

已知:①无水CrCl3易潮解、高温下易被氧气氧化;②焦性没食子酸溶液用于吸收少量氧气。
回答下列问题:
(1)装置A中橡皮管m的作用是
(2)装置A中CaO可用NaOH固体代替,其原因是
(3)若装置C玻璃管中产生大量白烟,则C中发生反应的化学方程式为
(4)制备氮化铬时,装置的接口连接顺序依次为a
(5)制得的CrN中含有Cr2N杂质,取样品14.38g在空气中充分加热,得固体残渣(Cr2O3)的质量为16.72g,则样品中CrN与Cr2N的物质的量之比为
(6)工业上也可用氧化铬与氨气制备CrN,则相关反应的化学方程式为
您最近一年使用:0次
2022-10-29更新
|
360次组卷
|
2卷引用:陕西省渭南市大荔县2023届高三一模化学试题
3 . 元素化合物在化工生产和环境科学中有着重要的用途。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为____ 、____ 、____ 。
(2)自然界中Cr主要以+3价和+6价形式存在。 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:____ 。
(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:____ 。
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+____ Br- (填“>”或“<”)。
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈____ 色,写出该反应的离子方程式____ 。
(1)向NH4Al(SO4)2溶液中逐滴加入稀NaOH溶液至过量,反应的离子方程式依次为
(2)自然界中Cr主要以+3价和+6价形式存在。
 中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将
中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将 还原。写出该反应的离子方程式:
还原。写出该反应的离子方程式:(3)常温下,氰化钠(NaCN)能与过氧化氢溶液反应生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式:
(4)已知:CCl4与水不相溶且密度比水大,Cl2的CCl4溶液呈黄绿色,Br2的CCl4溶液呈橙红色,且Br2易从水溶液中溶入CCl4中。Cl2既能氧化Br-,也能氧化Fe2+。
①取10mL0.1mol/LFeBr2溶液,向其中滴加几滴新制的氯水,振荡后溶液呈黄色。取少量反应后的溶液加入KSCN溶液,溶液变为红色。另取少量反应后的溶液加入CCl4,振荡后,下层为无色液体。以上实验结论表明还原性:Fe2+
②若在400mL0.1mol/LFeBr2溶液中通入标准状况下672mL的Cl2,取少量反应后的溶液加入CCl4,振荡后下层液体呈
您最近一年使用:0次
解题方法
4 . 下列离子方程式中,对事实的表述正确的是
A.NH4HCO3溶液中加入足量的NaOH溶液:HCO +OH-=CO +OH-=CO +H2O +H2O |
| B.氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O |
| C.向沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+ |
D.过量小苏打与澄清石灰水:2HCO +2OH-+Ca2+=CaCO3↓+CO +2OH-+Ca2+=CaCO3↓+CO +2H2O +2H2O |
您最近一年使用:0次
5 . 工业上常通过石煤灰渣(主要成分有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 )回收钒的氧化物,有关工艺流程如图:
)回收钒的氧化物,有关工艺流程如图:

已知:①“焙烧”时,在空气的作用下, 被氧化为
被氧化为 。
。
② 在稀硫酸作用下生成
在稀硫酸作用下生成 。
。
根据所学知识,回答下列问题:
(1)在“焙烧”之前,要先将硫酸铵固体和石煤灰进行混磨处理,其目的是_______ 。
(2) 中
中 的化合价为
的化合价为_______ ,“浸渣”的主要成分除了 ,还有
,还有_______ (填化学式)。
(3)“氧化”时加入的试剂 常用
常用 ,写出反应的离子方程式:
,写出反应的离子方程式:_______ 。 也能氧化
也能氧化 ,工业生产中不选用
,工业生产中不选用 的原因是
的原因是_______ 。
(4)在 灼烧脱氨可制得产品
灼烧脱氨可制得产品 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。在硫酸酸化条件下, 可与草酸(
可与草酸( )溶液反应得到含
)溶液反应得到含 的溶液,写出发生反应的离子方程式:
的溶液,写出发生反应的离子方程式:_______ 。
(5)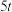 某批次的石煤灰渣中
某批次的石煤灰渣中 的含量为37.5%,工业生产中钒的浸出率为86%,若后续步骤中钒损耗为2%,则理论上制得的
的含量为37.5%,工业生产中钒的浸出率为86%,若后续步骤中钒损耗为2%,则理论上制得的 的质量最多为
的质量最多为_______  (保留三位有效数字)。
(保留三位有效数字)。
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 )回收钒的氧化物,有关工艺流程如图:
)回收钒的氧化物,有关工艺流程如图:
已知:①“焙烧”时,在空气的作用下,
 被氧化为
被氧化为 。
。②
 在稀硫酸作用下生成
在稀硫酸作用下生成 。
。根据所学知识,回答下列问题:
(1)在“焙烧”之前,要先将硫酸铵固体和石煤灰进行混磨处理,其目的是
(2)
 中
中 的化合价为
的化合价为 ,还有
,还有(3)“氧化”时加入的试剂
 常用
常用 ,写出反应的离子方程式:
,写出反应的离子方程式: 也能氧化
也能氧化 ,工业生产中不选用
,工业生产中不选用 的原因是
的原因是(4)在
 灼烧脱氨可制得产品
灼烧脱氨可制得产品 ,写出该反应的化学方程式:
,写出该反应的化学方程式: 可与草酸(
可与草酸( )溶液反应得到含
)溶液反应得到含 的溶液,写出发生反应的离子方程式:
的溶液,写出发生反应的离子方程式:(5)
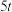 某批次的石煤灰渣中
某批次的石煤灰渣中 的含量为37.5%,工业生产中钒的浸出率为86%,若后续步骤中钒损耗为2%,则理论上制得的
的含量为37.5%,工业生产中钒的浸出率为86%,若后续步骤中钒损耗为2%,则理论上制得的 的质量最多为
的质量最多为 (保留三位有效数字)。
(保留三位有效数字)。
您最近一年使用:0次
解题方法
6 . 利用NaClO氧化尿素制备N2H4•H2O(水合肼)的实验流程如图所示:

已知:①氯气与烧碱溶液的反应是放热反应;
②N2H4•H2O有强还原性,能与NaClO剧烈反应生成N2。下列说法正确的是

已知:①氯气与烧碱溶液的反应是放热反应;
②N2H4•H2O有强还原性,能与NaClO剧烈反应生成N2。下列说法正确的是
| A.步骤I中无需控制反应的温度 |
| B.步骤I制备NaClO溶液时,测得产物中NaClO与NaClO3的物质的量之比为5∶1,则参与反应的氧化剂与还原剂的物质的量之比为3∶5 |
| C.步骤II中可将尿素水溶液逐滴滴入NaClO碱性溶液中 |
D.生成水合肼反应的离子方程式为:ClO-+CO(NH2)2+2OH-=Cl-+N2H4•H2O+CO |
您最近一年使用:0次
2022-09-24更新
|
899次组卷
|
4卷引用:陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题
陕西省西安工业大学附属中学2021-2022学年高三下学期第七次适应性训练理综化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题(已下线)热点情景汇编-专题三 氧化还原中的化学福建省晋江二中、鹏峰中学、广海中学、泉港五中2022-2023学年高三上学期12月联考化学试题
7 . 软锰矿的主要成分是MnO2,其悬浊液可吸收烟气中的SO2,所得酸性浸出液又可用于制备高纯硫酸锰,其一种工艺流程如下图所示。已知金属单质的活动性顺序为Al>Mn>Fe>Ni。回答下列问题:
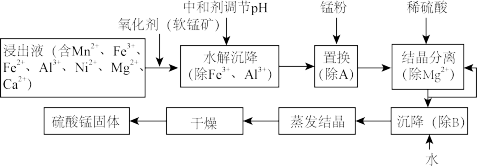
(1)用离子方程式表示加入“氧化剂(软锰矿)”的作用:_______ 。
(2)已知:Ksp[Al(OH)3]=1.0×10-33、Ksp[Ni(OH)2]=1.6×10-15、Ksp[Mn(OH)2]=4.0×10-14、Ksp[Fe(OH)3]=2.6×10-39。 “水解沉降”中:
①“中和剂”可以是_______ (填标号)。
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH应不低于_______ 。(离子浓度小于1×10-6 mol·L-1时,即可认为该离子沉淀完全)
(3)“置换”的目的是_______ (用离子方程式表示)。
(4)“结晶分离”中的部分物质的溶解度曲线如下图所示。结晶与过滤过程中,体系温度均应维持在_______ (填“27”“60”或“70”)℃。

(5)“草酸钠-高锰酸钾返滴法”可测定软锰矿中MnO2的纯度(假设杂质不参与反应):取a g MnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1 mL c1 mol·L-1 Na2C2O4溶液(足量),最后用c2 mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达到终点时消耗V2 mL 标准KMnO4溶液。
①MnO2参与反应的离子方程式为_______ 。
②该样品中MnO2的质量分数为_______ (列出表达式即可)。
(6)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为_______ 。

(1)用离子方程式表示加入“氧化剂(软锰矿)”的作用:
(2)已知:Ksp[Al(OH)3]=1.0×10-33、Ksp[Ni(OH)2]=1.6×10-15、Ksp[Mn(OH)2]=4.0×10-14、Ksp[Fe(OH)3]=2.6×10-39。 “水解沉降”中:
①“中和剂”可以是
A.Al2O3 B.MgO C.H2SO4 D.MnO2
②溶液的pH应不低于
(3)“置换”的目的是
(4)“结晶分离”中的部分物质的溶解度曲线如下图所示。结晶与过滤过程中,体系温度均应维持在

(5)“草酸钠-高锰酸钾返滴法”可测定软锰矿中MnO2的纯度(假设杂质不参与反应):取a g MnO2样品于锥形瓶中,加入适量稀硫酸,再加入V1 mL c1 mol·L-1 Na2C2O4溶液(足量),最后用c2 mol·L-1的KMnO4溶液滴定剩余的Na2C2O4,达到终点时消耗V2 mL 标准KMnO4溶液。
①MnO2参与反应的离子方程式为
②该样品中MnO2的质量分数为
(6)锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为
您最近一年使用:0次
8 . 工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素被氧化 |
| B.相同条件下,每吸收10 m3SO2就会放出2.5 m3CO2 |
| C.每生成1 mol Na2S2O3,转移4 mol电子 |
| D.氧化剂与还原剂的物质的量之比为1∶2 |
您最近一年使用:0次
9 . 工业上将Na2CO3和Na2S以1∶2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
| A.硫元素被氧化 |
| B.相同条件下,每吸收10 m3SO2就会放出2.5 m3CO2 |
| C.每生成1 mol Na2S2O3,转移4 mol电子 |
| D.氧化剂与还原剂的物质的量之比为1∶2 |
您最近一年使用:0次
名校
解题方法
10 . 钴酸锂(LiCoO2)电池是一种应用广泛的新型电源,电池中含有少量的铝、铁、碳等单质。实验室尝试对废旧钴酸锂电池回收再利用。实验过程如图:

已知:①还原性:Cl->Co2+;
②Fe3+和C2O 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
(1)废旧电池初步处理为粉末状的目的____ 。
(2)滤渣的主要成分为____ (填化学式)。
(3)从含铝废液得到Al(OH)3的离子方程式为____ 。
(4)滤液A中的溶质除HCl、LiCl外还有____ (填化学式)。写出LiCoO2和盐酸反应的化学方程式____ 。
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为____ mol·L-1。
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是____ 。

已知:①还原性:Cl->Co2+;
②Fe3+和C2O
 结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:
结合生成较稳定的[Fe(C2O4)3]3-,在强酸性条件下分解重新生成Fe3+。回答下列问题:(1)废旧电池初步处理为粉末状的目的
(2)滤渣的主要成分为
(3)从含铝废液得到Al(OH)3的离子方程式为
(4)滤液A中的溶质除HCl、LiCl外还有
(5)在空气中加热一定质量的CoC2O4·2H2O固体样品时,其固体失重率数据见表,请补充完整表中问题。已知:①CoC2O4在空气中加热时的气体产物为CO2。
②固体失重率=对应温度下样品失重的质量/样品的初始质量。
| 序号 | 温度范围/℃ | 化学方程式 | 固体失重率 |
| I | 120~220 | CoC2O4·2H2O=CoC2O4+2H2O | 19.67% |
| II | 300~350 | 59.02% |
(6)已知Li2CO3的溶度积常数Ksp=8.64×10-4,将浓度为0.02mol·L-1的Li2SO4和浓度为0.02mol·L-1的Na2CO3溶液等体积混合,则溶液中的Li+浓度为
(7)从FeCl3溶液得到FeCl3·6H2O固体的操作关键是
您最近一年使用:0次
2022-05-30更新
|
256次组卷
|
2卷引用:陕西省西安中学2022届高三下学期五月全仿真模拟考试(一)理综化学试题



