名校
解题方法
1 . 以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如图,下列叙述不正确的是

| A.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4 |
| B.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3 |
| C.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5 |
| D.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来 |
您最近一年使用:0次
2021-09-30更新
|
1899次组卷
|
22卷引用:2024届陕西省西安市第一中学高三上学期模拟测试理科综合试题-高中化学
2024届陕西省西安市第一中学高三上学期模拟测试理科综合试题-高中化学四川省成都市龙泉中学2021届高三上学期开学考试化学试题(已下线)易错21 化学工艺流程类选择题-备战2021年高考化学一轮复习易错题河南省信阳市2021届高三上学期第二次教学质量检测化学试题辽宁省部分重点中学协作体2024届高三下学期高考模拟考试化学试题江苏省苏州中学2020-2021学年度第二学期期中考试(已下线)难点1 化工流程微设计-2021年高考化学【热点·重点·难点】专练(新高考)(苏教版2019)必修第二册专题9 金属与人类文明 B 素养拓展区江苏省常熟市2021-2022学年高二学生暑期自主学习调查化学试题(已下线)第1周 周测卷-备战2022年高考化学周测与晚练(新高考专用)河北省石家庄市第二中学2022届高三上学期11月第三次考试化学试题(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)专题14物质的反应和转化-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题13物质的反应和转化-2022年高考真题+模拟题汇编(全国卷)(已下线)专题14物质的反应和转化-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题八工艺流程图(讲)广东省广州市中山大学附属中学2021届高三下学期3月月考化学试题河北省部分重点高中2023-2024学年高三上学期第一次综合素养测评化学试题广东省河源中学2023-2024学年上学期高三年级一调考试化学试题河北省衡水中学2023-2024学年高三上学期一调考试化学试题河北省石家庄市部分名校2024届高三上学期一调考试化学试题宁夏回族自治区银川一中2023-2024学年高三上学期第五次月考理科综合试题
名校
解题方法
2 . 已知NH4CuSO3与足量的10mol·L-1硫酸混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1molNH4CuSO3完全反应转移0.5mol电子 |
您最近一年使用:0次
2021-09-14更新
|
408次组卷
|
93卷引用:陕西省西藏民族学院附属中学2017届高三考前冲刺(一)理科综合化学试题
陕西省西藏民族学院附属中学2017届高三考前冲刺(一)理科综合化学试题(已下线)江西省重点中学协作体2010届高三第二次联考(化学)(已下线)2014高考名师推荐化学氧化还原反应的概念2016届吉林省东北师大附属中学高三上四次模拟化学卷2016届内蒙古赤峰市宁城县高三下学期第三次统一模拟考试化学试卷2016届内蒙古赤峰二中高三第四次模拟理综化学试卷2017届吉林省长春实验中学高三第五次模拟化学卷陕西省西安市长安区第一中学2017-2018学年高一下学期第一次教学质量检测化学试题【全国百强校】陕西省陕西师大附属中学2019届高三上学期月考化学试题新疆乌鲁木齐县柴窝堡林场中学2019届高三第三次模拟考试理科综合化学试题陕西省汉中市龙岗学校2019-2020学年高一上学期期中考试化学试题(已下线)2011届河南省豫南九校高三上学期第二次联考化学试卷(已下线)2012届黑龙江省牡丹江一中高三上学期期中考试化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次质量检测化学试卷2014届河北衡水中学高三上学期期中考试化学试卷(已下线)2014届黑龙江省佳木斯市第一中学高三第三次调研化学试卷(已下线)2014届河北冀州中学高三上学期期中考试往届化学试卷2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2016届河北省衡水中学高三上学期二调化学试卷2016届重庆市万州二中高三上学期9月月考化学试卷2016届山东省潍坊第一中学高三上学期10月月考化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2016届山东省青岛市高三上学期期中测试化学试卷2016届江苏省淮安市四星级高中高三上学期10月阶段测化学试卷2016届黑龙江省双鸭山一中高三上学期12月月考化学试卷2015-2016学年湖北省枣阳市第七中学高一上学期期中考试化学试卷2015-2016学年浙江省杭州市五校联盟高三12月月考化学试卷2015-2016学年河南省信阳高级中学高一下开学测化学试卷2016-2017学年河北正定中学高二上开学考试化学卷2017届吉林省松原油田高中高三上第一次阶段测化学卷2017届福建省仙游一中高三上第一次月考化学试卷2017届江西省南昌二中高三上第二次考试化学试卷2017届河北省石家庄辛集中学高三上期中化学试卷2017届河南省周口市淮阳中学高三上10月月考化学试卷2017届内蒙古赤峰市宁城县高三上统一考试化学试卷2017届江西省兴国中学、兴国三中等四校高三上第一次联考化学卷2016-2017学年河北省冀州中学高一上11月月考化学卷2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷2017届江西省兴国中学等四校高三上联考一化学试卷2016-2017学年湖北省鄂东南省级示范高中高一下学期期中联考化学试卷辽宁省瓦房店市高级中学2016-2017学年高二下学期期末考试化学试题黑龙江省大庆实验中学2017-2018学年高二上学期开学考试化学试题2018届高三一轮复习化学:微考点11-氧化还原反应的概念江西省临川区第二中学2018届高三上学期第三次月考化学试题湖南省永州市祁阳县第一中学2018届高三10月月考化学试题广西陆川县中学2017-2018学年高一下学期3月月考化学试题【全国百强校】山东师范大学附属中学2017-2018学年高二下学期第八次学分认定(期末)考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期开学阶段性考试(8月)化学试题湖南省湖南师范大学附属中学2019届高三上学期月考(一)化学试题【全国百强校】湖南省师范大学附属中学2019届高三上学期月考化学试题江西省赣州市会昌中学2019届高三上学期第一次月考(10月)化学试题河北省承德市第一中学2019届高三上学期第三次月考理科综合化学试题山东省商河市第一中学2019届高三上学期11月月考理科综合化学试题山东省滨州市北镇中学2019届高三上学期12月份质量检测化学试题江西省九江市同文中学2019届高三上学期期中考试化学试题山东省济宁市微山县亚马逊中学2019届高三上学期11月月考化学试题江西省上饶市横峰中学2018-2019学年高一下学期开学考试化学试题吉林省东辽五中2020届高三上学期9月月考化学试题江西省临川第二中学2020届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题甘肃省兰州市第一中学2020届高三上学期9月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题吉林省长春市东北师范大学附中2020届高三上学期第一次摸底考试化学试题山东省肥城市泰西中学2019-2020学年高三上学期第一次月考化学试题福建省厦门市湖滨中学2020届高三上学期期中考试化学试题四川省宜宾市叙州区第二中学校2019-2020学年高一下学期第一次在线月考化学试题(已下线)【南昌新东方】2018-2019莲塘一中 高三12月 014山东省济宁市汶上圣泽中学2019-2020学年高二下学期第二次检测化学试题(已下线)专题3.4 金属材料及金属矿物的开发利用(练)——2020年高考化学一轮复习讲练测安徽省安庆市2019-2020学年高一下学期期末测试化学试卷吉林省长春外国语学校2020-2021学年高三上学期期初考试化学试题河南省郑州市第一中学2021届高三上学期开学测试化学试题福建省永安市第三中学2021届高三9月月考化学试题吉林省大安市第一中学校2021届高三上学期第二次月考化学试题(已下线)第二章 元素与物质世界(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)四川省乐山沫若中学2021届高三上学期第二次理综化学试题江西省高安中学2020-2021学年高一上学期期中考试化学试题四川省射洪中学2019-2020学年高一上期期末英才班能力素质监测化学试题湖南省/(常德市芷兰实验中学2020-2021学年高一上学期第二次月考化学试题福建省莆田第十五中学2020届高三9月月考化学试题云南省昭通市昭阳区第一中学2020-2021学年高一上学期第三次月考化学试题广东省中山纪念中学2021届高三上学期第一次月考化学试题河南省信阳高级中学2020-2021学年高一上学期1月月考化学试题(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)【一飞冲天】名家原创卷1河北省廊坊市河北省三河市第一中学2020-2021学年高一下学期第二次阶段考化学试题吉林省大安市第一中学校2021-2022学年高二上学期期初考试化学试题吉林省辉南县第六中学2022届高三上学期第一次月考化学试题 山东省济南市章丘区第四中2022-2023学年高一上学期1月期末线上测试化学试题内蒙古自治区科尔沁左翼中旗实验高级中学2023-2024学年高三上学期11月月考化学试题
名校
3 . 关于如图所示的转化过程的分析错误的是
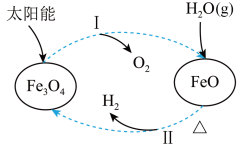
| A.Fe3O4中铁元素的化合价为+2、+3 |
| B.过程Ⅰ中每消耗58g Fe3O4转移1mol电子 |
C.过程Ⅱ中化学方程式为3FeO+H2O(g) Fe3O4+H2 Fe3O4+H2 |
| D.该过程总反应为2H2O(g)=O2+2H2 |
您最近一年使用:0次
2020-10-10更新
|
602次组卷
|
16卷引用:2019年陕西省汉中市高考第一次模拟化学试题
2019年陕西省汉中市高考第一次模拟化学试题山东济宁市兖州区2020届高三网络模拟考试化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(一)菏泽一中2020届高三3月份化学质量检测肥城一中2020届高三3月份在线检测化学试题上海市建平中学2021届高三上学期9月月考化学试题山东省济钢高级中学2021届高三10月质量检测化学试题高一必修第一册(苏教2019)专题4 专题综合检测卷福建省长泰县第一中学2021届高三上学期11月考试化学试题(已下线)第12周 晚练题-备战2022年高考化学周测与晚练(新高考专用)河北师范大学田家炳中学2020-2021学年高一上学期第3次月考化学试题甘肃省嘉峪关市第一中学2021届高三上学期二模考试化学试题江苏省镇江市句容市南京人民中学等三市四校联考2022-2023学年高一下学期4月月考化学试题江苏省无锡市辅仁高级中学2023-2024学年高一上学期期末复习化学模块综合试卷(一)11.2024年苏州木渎高级中学高一3月月考江苏省苏州第十中学校2023-2024学年高一下学期3月月考化学试题
解题方法
4 . 高纯MnCO3在电子工业中有重要的应用,工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如图所示:
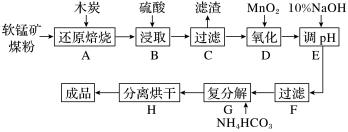
已知:还原焙烧主反应为2MnO2+C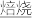 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
根据要求回答下列问题:
(1)在实验室进行步骤A,混合物应放在__________ 中加热。
(2)步骤E中调节pH的范围为____________ ,其目的是______________________________ 。
(3)步骤G,温度控制在35℃以下的原因是____________________________________ ,若Mn2+恰好沉淀完全(当离子浓度≦10-5mol/L认为该离子沉淀完全)时测得溶液中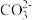 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=____________ 。
(4)步骤D中氧化剂与还原剂的物质的量之比为__________ ;步骤C中的滤渣为__________ 。
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是_____________________ 。
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中 完全转化为
完全转化为 );加入稍过量的硫酸铵,发生反应NO2-+
);加入稍过量的硫酸铵,发生反应NO2-+ =N2↑+2H2O以除去
=N2↑+2H2O以除去 ;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2 ;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为_____________________________________ 。
②试样中锰元素的质量分数为____________ 。

已知:还原焙烧主反应为2MnO2+C
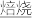 2MnO+CO2↑。
2MnO+CO2↑。可能用到的数据如下:
| 氢氧化物 | Fe(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.1 |
| 沉淀完全pH | 3.7 | 9.7 | 7.4 | 10.1 |
(1)在实验室进行步骤A,混合物应放在
(2)步骤E中调节pH的范围为
(3)步骤G,温度控制在35℃以下的原因是
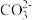 的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=
的浓度为2.2×10-6mol/L,则Ksp(MnCO3)=(4)步骤D中氧化剂与还原剂的物质的量之比为
(5)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否干净的方法是
(6)现用滴定法测定产品中锰元素的含量。实验步骤:称取3.300 g试样,向其中加入稍过量的磷酸和硝酸,加热使产品中MnCO3完全转化为[Mn(PO4)2]3-(其中
 完全转化为
完全转化为 );加入稍过量的硫酸铵,发生反应NO2-+
);加入稍过量的硫酸铵,发生反应NO2-+ =N2↑+2H2O以除去
=N2↑+2H2O以除去 ;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2
;加入稀硫酸酸化,再加入60.00 mL 0.500 mol·L-1硫酸亚铁铵溶液,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2 ;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。
;用5.00 mL 0.500 mol·L-1酸性K2Cr2O7溶液恰好除去过量的Fe2+。①酸性K2Cr2O7溶液与Fe2+反应的离子方程式为
②试样中锰元素的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如下:

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为 。
。
ⅱ.
回答下列问题:
(1)Fe在元素周期表中的位置______________________________ ,反应之前先将矿石粉碎的目的是__________________ 。
(2)步骤③加的试剂为_____________ ,此时溶液pH要调到5的目的______________ 。
(3)写出反应④的离子反应方程式______________________ 。
(4)⑤中酸化是使 转化为
转化为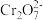 ,写出该反应的离子方程式
,写出该反应的离子方程式_________________ 。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是__________________ (填操作名称)。

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为
 。
。ⅱ.
| 金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
| 开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
| 沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)Fe在元素周期表中的位置
(2)步骤③加的试剂为
(3)写出反应④的离子反应方程式
(4)⑤中酸化是使
 转化为
转化为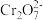 ,写出该反应的离子方程式
,写出该反应的离子方程式(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是
您最近一年使用:0次
名校
解题方法
6 . 铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:

已知:①稀土离子易和SO 形成复盐沉淀:
形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O==== Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为 ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有________________________________________
(2)CeFCO3中Ce元素的化合价为___________ ,滤渣A的主要成分是_____________
(3)焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为___________ ,硫酸浓度过大时,浸出率减小的原因是__________ 。

(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为_________ 。
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为_________ 。
(6)步骤④的离子方程式为________________________ 。
(7)取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+==== Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为____________ 。

已知:①稀土离子易和SO
 形成复盐沉淀:
形成复盐沉淀:Ce2(SO4)3+Na2SO4+nH2O==== Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为
 ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有
(2)CeFCO3中Ce元素的化合价为
(3)焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为

(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为
(6)步骤④的离子方程式为
(7)取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+==== Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为
您最近一年使用:0次
2020-06-24更新
|
276次组卷
|
2卷引用:陕西省咸阳市2021届高考五月检测三模理综化学试题
7 . 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是
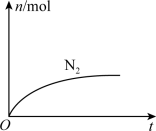

| A.该反应的还原剂是Cl- |
| B.消耗1 mol还原剂,转移6 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
您最近一年使用:0次
2020-06-16更新
|
652次组卷
|
36卷引用:【市级联考】陕西省咸阳市2019届高三下学期第一次模拟考试化学试题
【市级联考】陕西省咸阳市2019届高三下学期第一次模拟考试化学试题2016届陕西西安第一中学高三上学期期中考试化学试卷陕西省西安市长安区第五中学2019届高三上学期期中考试化学试题陕西省榆林市绥德县绥德中学2019-2020学年高二下学期第二次阶段性测试化学试题(已下线)湖南省湘潭县一中、双峰一中、邵东一中、永州四中2018-2019学年高一下学期优生联考化学试题(已下线)2014届北京市朝阳区高三上学期期末考试化学试卷(已下线)2015届黑龙江省双鸭山市第一中学高三9月月考化学试卷(已下线)2015届黑龙江省双鸭山一中高三9月月考化学试卷2016届湖北省天门中学高三普通班8月月考化学试卷2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷2016届河南省三门峡市灵宝三中高三上第四次质检化学试卷2017届河北武邑中学高三上学期周考(8.14)化学试题2017届河北省石家庄市辛集中学高三上第一次阶段考试化学卷2017届甘肃省兰州一中高三上12月月考化学试卷福建省永安一中、德化一中、漳平一中2017-2018学年高一上学期第二次联考化学试题湖北省来风县实验中学2018届高三上学期11月月考试化学试题(已下线)二轮复习 专题3 氧化还原反应 押题专练【全国百强校】甘肃省会宁县第一中学2019届高三上学期第一次月考理科综合化学试题甘肃省武威市第十八中学2019届高三第一次月考化学试题四川省德阳市第五中学2018-2019学年高二上学期10月月考化学试题河北省衡水市衡水中学2019届高三上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(押题专练)福建省三明第一中学2020届高三上学期第二次月考化学试题2020届高三化学大二轮增分强化练——氧化还原反应夯基提能2020届高三化学选择题对题专练——氧化还原反应(强化练习)2020届高三化学总复习考点强化练习:物质及其变化(已下线)考点03 氧化还原反应-2020年高考化学命题预测与模拟试题分类精编高一必修第一册(鲁科2019)第2章第3节 氧化还原反应江苏省宜兴第一中学2020-2021学年高一上学期期中考化学试题黑龙江省七台河市勃利县高级中学2021届高三上学期期中考试化学试题陕西省榆林市绥德中学2022-2023学年高二上学期第二次阶段性考试化学试题黑龙江省佳木斯市第一中学2021-2022学年高一上学期期中考试化学试题宁夏固原市第一中学2023届高三上学期第一次月考化学试题新疆实验中学2023-2024学年高一上学期10月月考化学试题浙江省瑞安中学2023-2024学年高一上学期12月月考化学试卷浙江省杭州学军中学2023-2024学年高一上学期期末模拟考试化学试卷
名校
解题方法
8 . 为了测定含氰废水中CN-的含量,某化学小组利用如图所示装置进行实验。关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸,然后关闭活塞b。
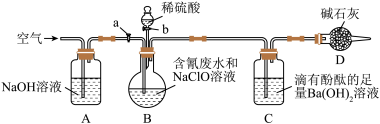
已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-、2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
(1)B中盛装稀硫酸的仪器的名称是_____________ 。
(2)装置D的作用是_________________ ,装置C中的实验现象为______________ 。
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为_________ mg·L−1。
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN−的含量__________ (选填“偏大”、“偏小”、“不变”)。
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为_________________ 。
(5)除去废水中CN−的一种方法是在碱性条件下,用H2O2将CN−氧化生成N2,反应的离子方程式为_____________________________ 。

已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-、2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
(1)B中盛装稀硫酸的仪器的名称是
(2)装置D的作用是
(3)待装置B中反应结束后,打开活塞a,经过A装置缓慢通入一段时间的空气
①若测得装置C中生成59.1mg沉淀,则废水中CN-的含量为
②若撤去装置A,直接向装置B中缓慢通入一段时间的空气,则测得含氰废水中CN−的含量
(4)向B中滴入稀硫酸后会发生某个副反应而生成一种有毒的黄绿色气体单质,该副反应的离子方程式为
(5)除去废水中CN−的一种方法是在碱性条件下,用H2O2将CN−氧化生成N2,反应的离子方程式为
您最近一年使用:0次
2020-06-03更新
|
480次组卷
|
5卷引用:陕西省渭南市渭南中学2020届高三第二次模拟考试化学试题
9 . 工业上可用铁盐溶液溶解黄铁矿(主要成分为FeS2),发生如下过程。下列说法错误的是


| A.过程I每溶解120 g FeS2,理论上消耗6 mol Fe3+ |
| B.过程Ⅱ每生成1 mol SO42-转移8 mol e- |
| C.总反应为FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+ |
| D.反应过程中鼓入大量的空气有利于反应的进行 |
您最近一年使用:0次
2020-05-27更新
|
166次组卷
|
2卷引用:陕西省西安市莲湖区庆安高级中学2020届高三二模化学试题
解题方法
10 . ZnSO4∙7H2O可用于测定钢铁及炉渣的含硫量。某工厂下脚料中含锌、镉(Cd)、铜、铁等金属,以该下脚料为原料制备ZnSO4∙7H2O并回收Cu、Cd的工艺流程如图所示:

已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1mol∙L-1计算):
请回答下列问题:
(1)滤渣1中含有_______ (填化学式)。
(2)试剂X是双氧水时,写出氧化过程中发生反应的离子方程式_______ 。
(3)pH的调控范围是_______ ,试剂Y可选用_______ (填字母)
A. NaOH B. ZnO C. ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在_______ (填“阴”或“阳”)极析出,阳极的电极反应式为_______ 。
(5)操作I包括的操作是_______ 及过滤等,过滤后得到的滤液可以加入_______ (填“酸浸”或“氧化”)步骤循环利用。

已知部分氢氧化物开始及完全沉淀的pH如表所示(起始时金属离子浓度按0.1mol∙L-1计算):
| 氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.9 | 7.4 | 6.2 |
| 完全沉淀的pH | 3.2 | 9.5 | 8.2 |
请回答下列问题:
(1)滤渣1中含有
(2)试剂X是双氧水时,写出氧化过程中发生反应的离子方程式
(3)pH的调控范围是
A. NaOH B. ZnO C. ZnCO3
(4)电解时以汞(Hg)作电极可以将镉与锌完全分离,镉单质在
(5)操作I包括的操作是
您最近一年使用:0次



