名校
解题方法
1 . 四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为−25℃,沸点为136.4℃。某实验小组设计如图装置(部分加热和夹持装置省略),用Cl2与碳粉、TiO2制备TiCl4。下列说法正确的是
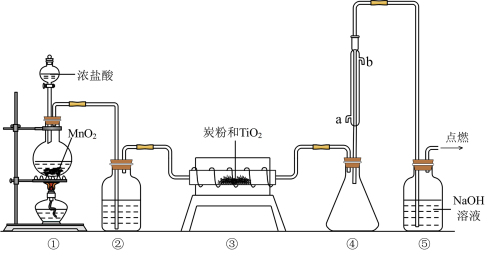

| A.②中应盛装饱和食盐水 |
| B.冷凝管处冷凝水应该由b进a出 |
| C.反应结束时,应先停止①处的加热,后停止③处的加热 |
| D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置 |
您最近一年使用:0次
2023-03-18更新
|
177次组卷
|
2卷引用:湖南省宁乡市第一高级中学2021届高三第二次模拟考试化学试卷
2 . 从一种阳极泥(主要成分为Cu、Ag、Pt、Au、Ag2Se、Cu2S)中回收重金属的工艺流程如图所示:
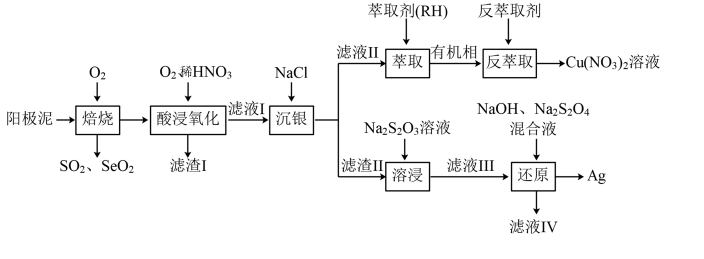
已知: 在碱性条件下很稳定。回答下列问题:
在碱性条件下很稳定。回答下列问题:
(1)Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为_______ 。
(2)“滤渣I”的主要成分是_______ (填化学式);加快“酸浸氧化”速率的措施有_______ (填写一条即可)。
(3)萃取与反萃取的原理为:2RH+Cu2+ R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是
R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是_______ (填名称);该流程中的“反萃取剂”最好选用_______ (填标号)。
A.乙醇 B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)已知:Ag++2
 [Ag(S2O3)2]3− K=2.80×1013
[Ag(S2O3)2]3− K=2.80×1013
AgCl(s) Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2
 [Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为
[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为_______ ;
②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:_______ 。
(5)请从环保角度对该工艺流程提出合理的优化建议:_______ (写出一条即可)。

已知:
 在碱性条件下很稳定。回答下列问题:
在碱性条件下很稳定。回答下列问题:(1)Cu2S焙烧为CuO,该过程中还原剂与氧化剂的物质的量之比为
(2)“滤渣I”的主要成分是
(3)萃取与反萃取的原理为:2RH+Cu2+
 R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是
R2Cu+2H+。实验室进行萃取操作的专用玻璃仪器是A.乙醇 B.HNO3溶液 C.盐酸 D.NaOH 溶液
(4)已知:Ag++2

 [Ag(S2O3)2]3− K=2.80×1013
[Ag(S2O3)2]3− K=2.80×1013AgCl(s)
 Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10
Ag+(aq)+Cl-(aq) Ksp(AgCl)=1.80×10−10①“溶浸”过程中,滤渣II被Na2S2O3溶液溶解的反应为:AgCl+2

 [Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为
[Ag(S2O3)2]3−+Cl-。则该反应的平衡常数为②“滤液IV”可返回溶浸工序循环使用,循环多次后,即使调控Na2S2O3溶液浓度,银的浸出率仍会降低。试从化学平衡的角度解释可能的原因:
(5)请从环保角度对该工艺流程提出合理的优化建议:
您最近一年使用:0次
2023-03-12更新
|
1194次组卷
|
5卷引用:湖南省衡阳县2023届高三3月教学质量诊断性检测考试化学试题
湖南省衡阳县2023届高三3月教学质量诊断性检测考试化学试题四川省成都市蓉城名校联盟2023届高三下学期第二次联考理综化学试题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)2023年北京卷高考真题变式题(工业流程题)(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)
名校
3 . 下列化学用语对事实的表述正确的是
A.用碳酸钠溶液处理水垢中的硫酸钙: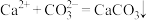 |
B.向碘化亚铁溶液中滴加少量稀硝酸: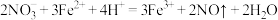 |
C.用白醋除铁锈: |
D.用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠: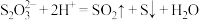 |
您最近一年使用:0次
2022-06-01更新
|
361次组卷
|
2卷引用:湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题
名校
4 . 已知二氯异氰尿酸钠是氧化性杀菌剂中杀菌最为广谱、高效、安全的消毒剂,难溶于冷水。它的结构可表示为 ,可用DCCNa表示。常用次氯酸钠氧化氰尿酸而得。氰尿酸的结构为
,可用DCCNa表示。常用次氯酸钠氧化氰尿酸而得。氰尿酸的结构为 ,用C3H3N3O3表示。据此,回答下列问题:
,用C3H3N3O3表示。据此,回答下列问题:

(1)仪器a的名称为_______ ,装置A中的药品为KMnO4,装置C的作用是_______ 。
(2)已知次氯酸钠与氰尿酸按照物质的量2:1反应,正好能制得目标产物二氯异氰尿酸钠。则装置B中发生反应的化学方程式是_______ 。实验发现装置B中NaOH溶液的利用率较低,改进方法是_______ 。反应过程中仍不断通入Cl2,原因是_______ 。
(3)实验过程中B的温度必须保持为17~20℃,pH值控制在6.5~8.5的范围,则该实验的受热方式是_______ ,若温度过高,pH过低,会生成NCl3,写出 被Cl2氧化生成NCl3的化学方程式:
被Cl2氧化生成NCl3的化学方程式:_______ 。
(4)二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的有效氯(样品中能转化为HClO的氯元素的质量分数)。已知实验检测原理为:
C3N3O3Cl +H++2H2O=C3H3N3O3+2HClO
+H++2H2O=C3H3N3O3+2HClO
HClO+2I-+H+=I2+Cl-+H2O
I2+2S2O =S4O
=S4O +2I-
+2I-
准确称取ag样品,用容量瓶配成250mL溶液:取25.00mL。上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min:用0.1000 mol∙L−1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。该样品的有效氯测定值为_______ %。(用含a、V的代数式表示)
 ,可用DCCNa表示。常用次氯酸钠氧化氰尿酸而得。氰尿酸的结构为
,可用DCCNa表示。常用次氯酸钠氧化氰尿酸而得。氰尿酸的结构为 ,用C3H3N3O3表示。据此,回答下列问题:
,用C3H3N3O3表示。据此,回答下列问题:
(1)仪器a的名称为
(2)已知次氯酸钠与氰尿酸按照物质的量2:1反应,正好能制得目标产物二氯异氰尿酸钠。则装置B中发生反应的化学方程式是
(3)实验过程中B的温度必须保持为17~20℃,pH值控制在6.5~8.5的范围,则该实验的受热方式是
 被Cl2氧化生成NCl3的化学方程式:
被Cl2氧化生成NCl3的化学方程式:(4)二氯异氰尿酸钠缓慢水解产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的有效氯(样品中能转化为HClO的氯元素的质量分数)。已知实验检测原理为:
C3N3O3Cl
 +H++2H2O=C3H3N3O3+2HClO
+H++2H2O=C3H3N3O3+2HClOHClO+2I-+H+=I2+Cl-+H2O
I2+2S2O
 =S4O
=S4O +2I-
+2I-准确称取ag样品,用容量瓶配成250mL溶液:取25.00mL。上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min:用0.1000 mol∙L−1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗Na2S2O3溶液VmL。该样品的有效氯测定值为
您最近一年使用:0次
5 . 某种制备H2O2的反应机理如图。下列说法不正确的是


| A.总反应可表示为H2+O2=H2O2 |
| B.该过程中Pd的化合价有0和+2两种 |
| C.①、②、③均为氧化还原反应 |
| D.HCl和Cl-可循环利用 |
您最近一年使用:0次
6 . 已知NH4CuSO3与足量的1mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法合理的是
| A.NH4CuSO3中硫元素被还原 |
| B.刺激性气味的气体是二氧化硫或氨气 |
| C.该反应中硫酸既体现了酸性又体现了氧化性 |
| D.反应中每消耗1molNH4CuSO3,转移的电子数约为3.01×1023 |
您最近一年使用:0次
7 . 工业上用发烟HClO4把潮湿的CrCl3氧化为棕色的烟[CrO2(ClO4)2]来除去Cr(III),HClO4中部分氯元素转化为最低价态。下列说法错误的
| A.HClO4属于强酸,该反应也生成了另一种强酸 |
| B.CrO2(ClO4)2中Cr元素显+6价 |
| C.该反应每生成1 mol氧化产物,便有0.375 mol HClO4被还原. |
D.该反应的离子方程式为19 +8Cr3+=8CrO2(ClO4)2+3Cl- +8Cr3+=8CrO2(ClO4)2+3Cl- |
您最近一年使用:0次
解题方法
8 . 亚硝酸钠(NaNO2)是一种肉制品生产中常见的食品添加剂,使用时必须严格控制其用量。在漂白、电镀等方面应用也很广泛。某兴趣小组设计了如下图所示的装置制备NaNO2(A中加热装置已略去)。
已知:室温下,①2NO+Na2O2===2NaNO2
②酸性条件下,NO 或NO2-都能与MnO4-反应生成NO3-和Mn2+

(1)A中发生反应的化学方程式为_________________________________ 。
(2)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N 2的作用是______________ 。
(3)装置B中观察到的主要现象为_________________
(4)①为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是___________ (填字母序号)。
A.P2O5 B.无水CaCl2 C.碱石灰 D.浓硫酸
②如果取消C装置,D中固体产物除NaNO2外,可能含有的副产物有________ 写化学式)。
(5)E中发生反应的离子方程式为____________ 。
(6)将1.56g Na2O2完全转化为NaNO2,理论上至少需要木炭__________ g。
已知:室温下,①2NO+Na2O2===2NaNO2
②酸性条件下,NO 或NO2-都能与MnO4-反应生成NO3-和Mn2+

(1)A中发生反应的化学方程式为
(2)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N 2的作用是
(3)装置B中观察到的主要现象为
(4)①为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是
A.P2O5 B.无水CaCl2 C.碱石灰 D.浓硫酸
②如果取消C装置,D中固体产物除NaNO2外,可能含有的副产物有
(5)E中发生反应的离子方程式为
(6)将1.56g Na2O2完全转化为NaNO2,理论上至少需要木炭
您最近一年使用:0次
2010·湖南·一模
9 . 浓盐酸中SnCl2与Na2FeO4反应的离子方程式为:SnCl2+Cl-+FeO42-+H+→SnCl62-+Fe2++M(未配平),由此可得
| A.SnCl62-是还原产物 | B.还原性:Cl->Fe2+ |
| C.M是OH- | D.每生成1mol Fe2+,转移4mol电子 |
您最近一年使用:0次



