1 . 唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式_______ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是_______ (用文字表述,任写一条合理途径)。
(3)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为_______ 。
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和_______ ;
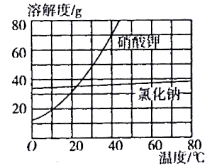
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液_______ 、过滤洗涤、干燥等步骤。
(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油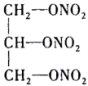 (
(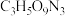 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为_______ ;
②实验室制备硝化甘油的化学方程式为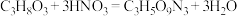 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
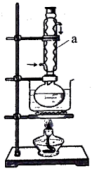
该装置中仪器a名称为_______ ,采用水浴加热而不用酒精灯直接加热的原因是_______ ,从反应后混合溶液中分离硝化甘油的简单方法是_______ 。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
(3)古代曾用硝土[含有
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(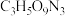 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
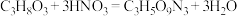 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
该装置中仪器a名称为
您最近一年使用:0次
解题方法
2 . 下列各组澄清溶液中离子能大量共存,且滴入X试剂后发生的离子方程式书写正确的是
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A |  、 、 、 、 、 、 | 过量 | 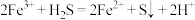 |
| B |  、 、 、 、 、 、 | 少量HI | 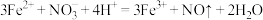 |
| C |  、 、 、 、 、 、 | 过量铜粉 |  |
| D |  、 、 、 、 、 、 | 少量HCl | 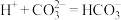 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
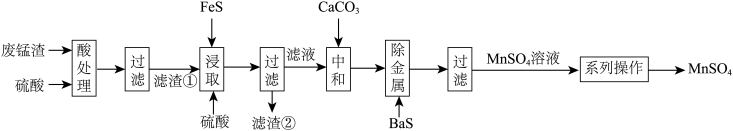
3 . 高锰酸钾生产过程中会产生较多的废锰渣,工业上将废锰渣再利用,以它为原料来制备硫酸锰。回答下列问题:
已知:废锰渣主要成分为 、
、 、
、 、
、 、MgO。
、MgO。
(1)基态锰原子的核外电子排布式为_______ 。
(2)“酸处理”时,为提高浸取率可采取的措施为_______ (填一条)。“滤渣①”的主要成分为_______ (填化学式)。
(3)“浸取”过程中主要发生的化学方程式为_______ 。“浸取”时,随着反应的进行,反应物的浓度减小,化学反应速率应该减慢,但实际上浸取时化学反应速率加快,原因是_______ 。
(4)“中和”时,碳酸钙的作用是_______ 。
(5)“系列操作”包括_______ 。
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程中阳极的电极反应式为_______ 。
(7)某工厂用10t该废锰渣(含34.8% )制备
)制备 ,若整个流程中Mn的损耗率为25%,最终可以制得
,若整个流程中Mn的损耗率为25%,最终可以制得 的质量为
的质量为_______ t。
已知:废锰渣主要成分为
 、
、 、
、 、
、 、MgO。
、MgO。
(1)基态锰原子的核外电子排布式为
(2)“酸处理”时,为提高浸取率可采取的措施为
(3)“浸取”过程中主要发生的化学方程式为
(4)“中和”时,碳酸钙的作用是
(5)“系列操作”包括
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程中阳极的电极反应式为
(7)某工厂用10t该废锰渣(含34.8%
 )制备
)制备 ,若整个流程中Mn的损耗率为25%,最终可以制得
,若整个流程中Mn的损耗率为25%,最终可以制得 的质量为
的质量为
您最近一年使用:0次
2023-01-11更新
|
300次组卷
|
2卷引用:湖南省衡阳市2023届高三上学期第一次统一考试(一模)化学试题
4 . 正高碘酸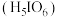 是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由
是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由 制取
制取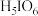 的实验流程如图所示:
的实验流程如图所示:
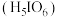 是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由
是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由 制取
制取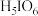 的实验流程如图所示:
的实验流程如图所示: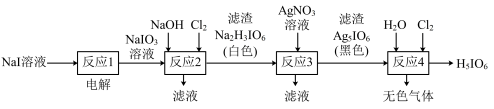
A.“反应1”是为了将 转化为 转化为 |
B.“反应2”中发生的反应是 |
C.“反应3”的滤液中含有大量的 等 等 |
| D.“反应4”得到的无色气体可能是氧气 |
您最近一年使用:0次
2023-01-11更新
|
746次组卷
|
3卷引用:湖南省永州市2023届高三第二次适应性考试(二模)化学试题
名校
解题方法
5 . 大力推广锂电池新能源汽车对实现“碳达峰”和“碳中和”具有重要意义。 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
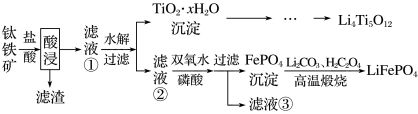
已知:“酸浸”后,钛主要以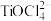 形式存在,
形式存在, 。下列说法不正确的是。
。下列说法不正确的是。
 与
与 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为
都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 ,还有少量MgO、
,还有少量MgO、 等杂质)来制备,工艺流程如下:
等杂质)来制备,工艺流程如下:
已知:“酸浸”后,钛主要以
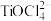 形式存在,
形式存在, 。下列说法不正确的是。
。下列说法不正确的是。A.在制备 时需要加入水,同时加热,促使水解反应趋于完全 时需要加入水,同时加热,促使水解反应趋于完全 |
B.在制备 的过程中会生成 的过程中会生成 (Ti为 (Ti为 价),则 价),则 中过氧键的数目为8 中过氧键的数目为8 |
C.滤液②中的阳离子有 、 、 、 、 |
| D.高温煅烧反应中氧化剂与还原剂物质的量之比为2∶1 |
您最近一年使用:0次
2022-12-16更新
|
747次组卷
|
4卷引用:湖南省九校联盟2023届高三上学期第一次联考化学试题
名校
解题方法
6 . 下列离子方程式正确的是。
A.向硫代硫酸钠溶液中滴加浓盐酸: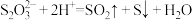 |
B.氢氧化镁固体溶解于氯化铵溶液: |
C.酸性KMnO4溶液滴定双氧水: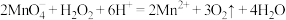 |
D.将少量溴水滴入过量Na2SO3溶液中: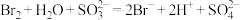 |
您最近一年使用:0次
2022-12-16更新
|
501次组卷
|
4卷引用:湖南省九校联盟2023届高三上学期第一次联考化学试题
湖南省九校联盟2023届高三上学期第一次联考化学试题湖南省九校联盟2023届高三上学期第一次联考化学试题(已下线)专题04 突破离子共存、离子推断、离子方程式正误判断(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)(已下线)专题04 离子反应
名校
7 . 金属钴是一种重要战略资源。利用草酸钴(CoC2O4)废料协同浸出水钴矿中钴的工艺流程如下。

已知:I.水钴矿的主要成分为 ,含MnS及Fe、Al、Ca、Si等元素的氧化物;
,含MnS及Fe、Al、Ca、Si等元素的氧化物;
II.该流程中一些金属氢氧化物沉淀时的pH如表:
(1)研磨的目的是_______ 。
(2)滤渣1的主要成分是 、
、_______ (写化学式)。
(3)“浸出”时, 转化成了
转化成了 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
(4)“氧化”时, 只将
只将 氧化成
氧化成 ,则反应的氧化剂与还原剂的物质的量之比为
,则反应的氧化剂与还原剂的物质的量之比为_______ 。
(5)“沉淀”时,应将pH调至_______ 。
(6)已知 能被有机萃取剂(HA)萃取,其原理可表示为:
能被有机萃取剂(HA)萃取,其原理可表示为: 。反萃取的目的是将有机层中的
。反萃取的目的是将有机层中的 转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、
转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、_______ ,反萃取适宜选择的试剂是_______ (填序号)。
A.70% B.饱和食盐水 C.稀NaOH D.饱和
B.饱和食盐水 C.稀NaOH D.饱和 溶液
溶液

已知:I.水钴矿的主要成分为
 ,含MnS及Fe、Al、Ca、Si等元素的氧化物;
,含MnS及Fe、Al、Ca、Si等元素的氧化物;II.该流程中一些金属氢氧化物沉淀时的pH如表:
| 离子 |  |  |  |  |  |
| 开始沉淀时pH | 3.6 | 1.8 | 6.5 | 7.2 | 8.1 |
| 沉淀完全时pH | 4.7 | 3.2 | 8.3 | 9.4 | 12.7 |
(1)研磨的目的是
(2)滤渣1的主要成分是
 、
、(3)“浸出”时,
 转化成了
转化成了 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)“氧化”时,
 只将
只将 氧化成
氧化成 ,则反应的氧化剂与还原剂的物质的量之比为
,则反应的氧化剂与还原剂的物质的量之比为(5)“沉淀”时,应将pH调至
(6)已知
 能被有机萃取剂(HA)萃取,其原理可表示为:
能被有机萃取剂(HA)萃取,其原理可表示为: 。反萃取的目的是将有机层中的
。反萃取的目的是将有机层中的 转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、
转移到水层。实验室模拟萃取用到的主要玻璃仪器有烧杯、A.70%
 B.饱和食盐水 C.稀NaOH D.饱和
B.饱和食盐水 C.稀NaOH D.饱和 溶液
溶液
您最近一年使用:0次
2022-11-03更新
|
1240次组卷
|
4卷引用:湖南省益阳市第一中学2022-2023学年高三下学期模拟考试化学试题
名校
8 . 磷酸钒锂/碳复合材料 是常用的电极材料,其制备流程如下:
是常用的电极材料,其制备流程如下:

已知: ,
, 的电离常数
的电离常数 ,
,
下列说法不正确 的是
 是常用的电极材料,其制备流程如下:
是常用的电极材料,其制备流程如下:
已知:
 ,
, 的电离常数
的电离常数 ,
,下列说法
A. 溶液显酸性 溶液显酸性 |
| B.碳的作用是增强复合材料的导电性 |
| C.“洗涤”时用乙醇而不用水的目的是减少产品损耗 |
D.“混合I”时发生反应的化学方程式为 |
您最近一年使用:0次
2022-10-27更新
|
715次组卷
|
6卷引用:湖南省郴州市2022-2023学年高三上学期第一次教学质量监测化学试题
9 . 在特定碱性条件下,过量H2O2可将Cr(Ⅲ)完全氧化成Cr(Ⅵ),其反应为H2O2+CrO +W→CrO
+W→CrO +Y(未配平),下列有关说法正确的是
+Y(未配平),下列有关说法正确的是
 +W→CrO
+W→CrO +Y(未配平),下列有关说法正确的是
+Y(未配平),下列有关说法正确的是| A.Y为OH- |
| B.上述反应中氧化剂和还原剂的物质的量之比为3∶2 |
| C.1 mol H2O2参加反应时,转移电子的物质的量为6 mol |
D.在酸性条件下CrO 可以转化为Cr2O 可以转化为Cr2O |
您最近一年使用:0次
2022-10-04更新
|
142次组卷
|
2卷引用:湖南省邵阳市新宁县崀山培英学校2022届高三下学期第三次模拟考试化学试题
解题方法
10 . 2019年诺贝尔化学奖颁给了日本化学家吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。工业中利用锂辉石(主要成分为LiAl(SiO3)2,还含有Fe2O3、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
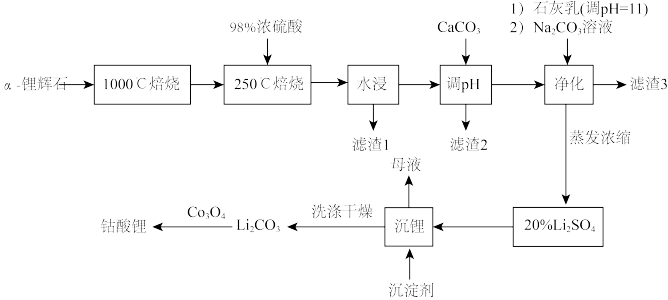
已知:
①α-锂辉石化学惰性较大,除HF外,几乎不与任何酸碱反应,α—锂辉石在高温下可转化为β-锂辉石,β—锂辉石具有更高的化学活性;
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2 + H2SO4→Li2SO4 +Al2O3·4SiO2·H2O;
③部分金属氢氧化物pKsp(pKsp=—lgKsp)的柱状图。

回答下列问题:
(1)1000℃焙烧α—锂辉石的目的为_______ ;锂辉石的主要成分为LiAl(SiO3)2,其氧化物的形式为_______ 。
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ (保留小数点后一位有效数字,已知:完全沉淀后离子浓度低于1×l0-5mol/L);“滤渣3”的主要成分为 _______ 。
(3)“沉锂”过程中加入的沉淀剂为饱和的Na2CO3溶液,判断该过程中所获得的沉淀是否洗涤干净的操作为:_______ 。
(4)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为_______ 。
(5)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池总反应为LiCoO2+C6 LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:_______ 。

已知:
①α-锂辉石化学惰性较大,除HF外,几乎不与任何酸碱反应,α—锂辉石在高温下可转化为β-锂辉石,β—锂辉石具有更高的化学活性;
②β-锂辉石可与浓硫酸发生反应:2β-LiAl(SiO3)2 + H2SO4→Li2SO4 +Al2O3·4SiO2·H2O;
③部分金属氢氧化物pKsp(pKsp=—lgKsp)的柱状图。

回答下列问题:
(1)1000℃焙烧α—锂辉石的目的为
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为
(3)“沉锂”过程中加入的沉淀剂为饱和的Na2CO3溶液,判断该过程中所获得的沉淀是否洗涤干净的操作为:
(4)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
(5)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池总反应为LiCoO2+C6
 LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
LixC6 + Li1-xCoO2,充电时,阳极发生的电极反应为:
您最近一年使用:0次



