名校
解题方法
1 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,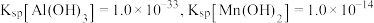 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为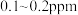 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧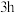 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到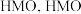 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的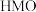 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成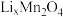 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使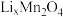 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入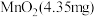 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在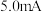 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。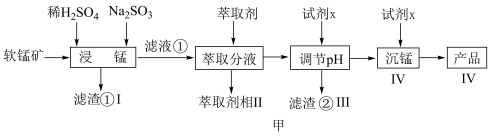
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为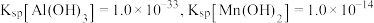 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
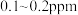 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧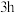 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到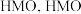 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是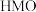 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成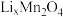 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
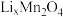 中的
中的 脱出进入腔室2。
脱出进入腔室2。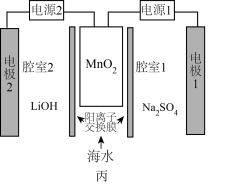
 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入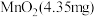 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在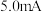 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近一年使用:0次
2024-05-14更新
|
176次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题
解题方法
2 . 钛在医疗领域的应用非常广泛,如:制人造关节、主动心瓣等。实验室利用四氯化钛气相氧化法制备二氧化钛,装置如图(夹持装置已略去)。
已知:
① ;
;
② 为无色或淡黄色液体,熔点为
为无色或淡黄色液体,熔点为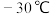 ,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
③ 的盐酸溶液可吸收CO而生成黑色颗粒Pd;
的盐酸溶液可吸收CO而生成黑色颗粒Pd;
④ 在盐酸溶液中的存在形式为
在盐酸溶液中的存在形式为 。
。
a.制备
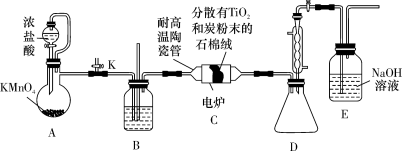
(1)对于实验过程的控制,开始的操作和实验结束的操作分别为______(填标号)。
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
(2)装置B中盛放的试剂是______ (写名称)。
(3)该实验设计存在的缺陷是:______ 。
(4)吸收CO的离子方程式:______ 。
(5)所得的 可用Mg制Ti,该过程可在
可用Mg制Ti,该过程可在______ 氛围保护下进行(填序号)。
①氮气 ②氧气 ③水蒸气 ④氩气
b.制备

(6)装置C中仪器a的名称为______ 。
(7)实验装置按从左到右的连接顺序为______ 。
(8)写出装置的B三颈烧瓶内发生反应的化学方程式:______ 。
已知:
①
 ;
;②
 为无色或淡黄色液体,熔点为
为无色或淡黄色液体,熔点为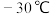 ,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;③
 的盐酸溶液可吸收CO而生成黑色颗粒Pd;
的盐酸溶液可吸收CO而生成黑色颗粒Pd;④
 在盐酸溶液中的存在形式为
在盐酸溶液中的存在形式为 。
。a.制备


(1)对于实验过程的控制,开始的操作和实验结束的操作分别为______(填标号)。
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
| A.①③ | B.①④ | C.②③ | D.②④ |
(2)装置B中盛放的试剂是
(3)该实验设计存在的缺陷是:
(4)吸收CO的离子方程式:
(5)所得的
 可用Mg制Ti,该过程可在
可用Mg制Ti,该过程可在①氮气 ②氧气 ③水蒸气 ④氩气
b.制备


(6)装置C中仪器a的名称为
(7)实验装置按从左到右的连接顺序为
(8)写出装置的B三颈烧瓶内发生反应的化学方程式:
您最近一年使用:0次
名校
解题方法
3 . 过氧化尿素[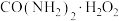 ,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和
,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和 ,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下:
,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下: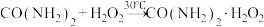 ,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
(1)仪器A的名称是___________ 。
(2)过氧化尿素是过氧化氢和尿素的加合产物,二者之间通过___________ (填“配位键”或“氢键”)相结合。
(3)从抽滤后的母液中分离出 和尿素,可采用的操作是___________(填字母)。
和尿素,可采用的操作是___________(填字母)。
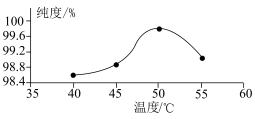
(4)过氧化尿素的纯度与干燥温度的关系如图所示:___________ 。
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 6.0 mol⋅L-1硫酸,然后用0.1000 mol⋅L-1的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:___________ 。
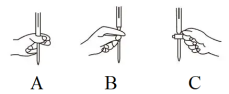
②本实验KMnO4溶液滴定过程中操作滴定管的图示正确的是___________ (填字母)。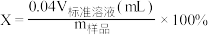 ,根据滴定结果,可确定产品中活性氧的含量为
,根据滴定结果,可确定产品中活性氧的含量为___________ %。
④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量___________ (填“偏高”“偏低”或“不变”)。
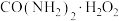 ,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和
,无毒无味的白色粉末,易溶于水,水溶液离解为尿素和 ,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下:
,45℃以上能分解]是一种新型精细化工产品,也是一种新型的固体消毒剂和氧化剂,其合成原理如下: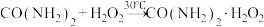 ,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。
,实验过程:在三口烧瓶(实验装置如图所示)中加入一定比例的双氧水、尿素和稳定剂,搅拌,固体溶解后,升温至30℃,反应40min,加入包膜剂,继续搅拌10min。然后降温至0℃,结晶3h后,抽滤,将滤饼置于烘箱中,50℃下烘干2h,得到最终的过氧化尿素产品。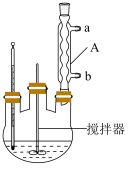
(1)仪器A的名称是
(2)过氧化尿素是过氧化氢和尿素的加合产物,二者之间通过
(3)从抽滤后的母液中分离出
 和尿素,可采用的操作是___________(填字母)。
和尿素,可采用的操作是___________(填字母)。| A.盐析、过滤 | B.减压蒸馏、结晶 | C.分液、过滤 | D.减压蒸馏、萃取 |
(4)过氧化尿素的纯度与干燥温度的关系如图所示:
(5)为测定产品中活性氧的含量,称取干燥样品4.000 g,溶解,在250 mL容量瓶中定容,准确量取25 mL于锥形瓶中,加入2 mL 6.0 mol⋅L-1硫酸,然后用0.1000 mol⋅L-1的KMnO4标准溶液滴定,滴定终点时,消耗KMnO4溶液16.00mL(已知KMnO4溶液与尿素不反应)。
①写出用KMnO4标准溶液滴定时反应的离子方程式:
②本实验KMnO4溶液滴定过程中操作滴定管的图示正确的是
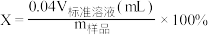 ,根据滴定结果,可确定产品中活性氧的含量为
,根据滴定结果,可确定产品中活性氧的含量为④若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的活性氧含量
您最近一年使用:0次
2024-02-01更新
|
301次组卷
|
3卷引用:2024届湖南省衡阳市第八中学高三下学期模拟预测化学试题
名校
解题方法
4 . 三氯化钌( )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从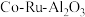 催化剂废料中分离制各
催化剂废料中分离制各 和
和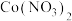 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“焙烧”后所得固体主要成分为 、
、 、
、 和
和___________ 。
(3)“还原”过程会产生 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为______________________ 。
(4)“酸溶”过程中,先加入盐酸溶解 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为___________ 。
(5)“蒸发结晶”在真空度为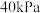 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是___________ 。
(6)若维持 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于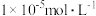 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于___________ 。[已知: ,
,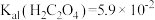 ,
, 结果保留三位小数]
结果保留三位小数]
(7)“沉钴”时,若得到的是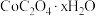 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为______________________ 。
(8)该流程中,还有一种重要成分 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:___________ 。
 )是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从
)是重要的化工原料,广泛应用于催化、电镀、电解阳极、电子工业等。从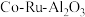 催化剂废料中分离制各
催化剂废料中分离制各 和
和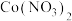 的一种工艺流程如图所示。
的一种工艺流程如图所示。
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)“焙烧”后所得固体主要成分为
 、
、 、
、 和
和(3)“还原”过程会产生
 和
和 沉淀,该反应的化学方程式为
沉淀,该反应的化学方程式为(4)“酸溶”过程中,先加入盐酸溶解
 ,然后加入盐酸羟胺(
,然后加入盐酸羟胺( )得到
)得到 和
和 。则该两种产物的物质的量之比为
。则该两种产物的物质的量之比为(5)“蒸发结晶”在真空度为
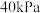 时进行(此时水的沸点是
时进行(此时水的沸点是 ),其目的是
),其目的是(6)若维持
 不变,让
不变,让 沉淀完全(
沉淀完全( 浓度不高于
浓度不高于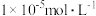 ),则混合体系中
),则混合体系中 的浓度不低于
的浓度不低于 ,
,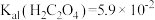 ,
, 结果保留三位小数]
结果保留三位小数](7)“沉钴”时,若得到的是
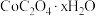 晶体,该反应的离子方程式为
晶体,该反应的离子方程式为(8)该流程中,还有一种重要成分
 未提取,你认为在哪一步骤后进行最合适:
未提取,你认为在哪一步骤后进行最合适:
您最近一年使用:0次
2024-01-09更新
|
1223次组卷
|
5卷引用:湖南省株洲市2024届高三上学期教学质量统一检测化学试题
湖南省株洲市2024届高三上学期教学质量统一检测化学试题2024届湖南省长沙市雅礼中学高三下学期3月综合测试(一)化学试题湖南省株洲市2023-2024学年高三上学期教学质量统一检测化学试卷(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
解题方法
5 . ZnS常用于制造白色颜料、发光粉和发光油漆等。以火法炼铜的废料(主要含ZnO、CuO,含少量PbO、As2O3、SiO2等)为原料制备粗锌和硫化锌的流程如下:
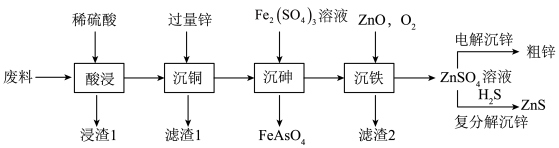
回答下列问题:
(1)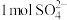 中含
中含 键
键___________ mol。
(2)从“滤渣1”中提取粗铜的操作是将“滤渣1”___________ 、过滤、洗涤、干燥,得到粗铜。
(3)“沉铁”中 的作用是
的作用是___________ (用离子方程式表示),可用绿色氧化剂___________ (填化学式)替换 。
。
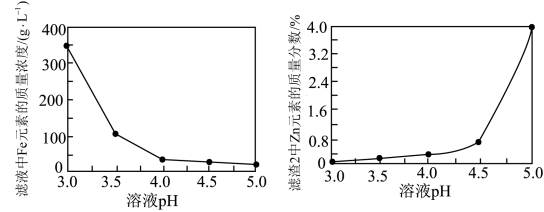
(4)加入ZnO调节溶液pH,滤液中Fe元素的质量浓度、“滤渣2”中Zn元素的质量分数与pH关系如图所示。最适宜的pH为___________ 。
(5)工业上常用电解法精炼锌,阴极材料是___________ 。
(6)“复分解沉锌”中,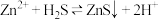 的平衡常数
的平衡常数
___________ 。[已知:常温下, ,
, 的电离常数
的电离常数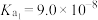 ,
, ]
]

回答下列问题:
(1)
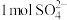 中含
中含 键
键(2)从“滤渣1”中提取粗铜的操作是将“滤渣1”
(3)“沉铁”中
 的作用是
的作用是 。
。(4)加入ZnO调节溶液pH,滤液中Fe元素的质量浓度、“滤渣2”中Zn元素的质量分数与pH关系如图所示。最适宜的pH为

(5)工业上常用电解法精炼锌,阴极材料是
(6)“复分解沉锌”中,
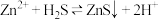 的平衡常数
的平衡常数
 ,
, 的电离常数
的电离常数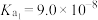 ,
, ]
]
您最近一年使用:0次
解题方法
6 . 铼(Re)被称为“类锰元素”,与锰的价电子排布相同,可以与氧气反应。一种对废氧化铝载体铂铼催化剂中金属元素综合回收利用的工艺如图:
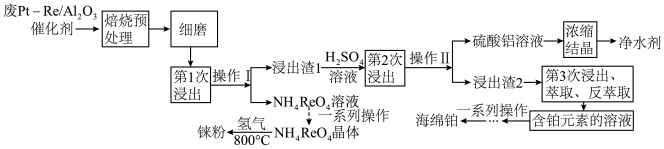
下列说法正确的是

下列说法正确的是
| A.“第1次浸出”中可以用氢氧化钠溶液代替氨水,浸出渣1成分不变 |
| B.铼元素的最高价氧化物Re2O7为碱性氧化物 |
| C.制备铼粉过程中,氢气只体现还原作用 |
D.“第3次浸出”中若用HC1-NaClO3作浸出液,反应离子方程式可能为:3Pt+16Cl-+2C1O +12H+=3[PtCl6]2-+6H2O +12H+=3[PtCl6]2-+6H2O |
您最近一年使用:0次
2023-03-10更新
|
1025次组卷
|
4卷引用:湖南省郴州市2023届高三下学期第三次教学质量监测化学试题
湖南省郴州市2023届高三下学期第三次教学质量监测化学试题湖北省七市(州)2023届高三3月联合统一调研测试化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题11-15)(已下线)专题10 物质的反应及转化
解题方法
7 . 碘酸钙为白色固体,微溶于水,是一种无机精细与专用化学品。一种制备并测定六水合碘酸钙含量的实验设计如下。
步骤I:碘酸氢钾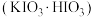 的制备
的制备
在三颈烧瓶中加入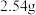 碘、
碘、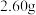 氯酸钾和
氯酸钾和 水,滴加
水,滴加 的盐酸至
的盐酸至 ,控制温度85℃左右,装置如图。
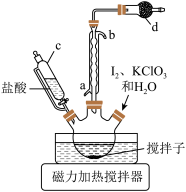
,控制温度85℃左右,装置如图。
步骤II:碘酸钙晶体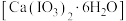 的制备
的制备
将步骤I反应后的溶液转入烧杯中,加入X溶液调节 ;继续滴加
;继续滴加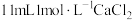 溶液,充分反应后用冰水冷却,抽滤、洗涤、干燥,得粗产品碘酸钙晶体
溶液,充分反应后用冰水冷却,抽滤、洗涤、干燥,得粗产品碘酸钙晶体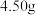 。
。
步骤III:产品中碘酸钙晶体含量测定
①准确称取 粗产品,置于烧杯中,加入
粗产品,置于烧杯中,加入 溶解样品,转移到
溶解样品,转移到 容量瓶中定容。量取
容量瓶中定容。量取 溶液于碘量瓶中,加入稍过量的
溶液于碘量瓶中,加入稍过量的 ,然后用
,然后用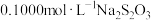 标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去
标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 标准溶液。
标准溶液。
②空白实验:不取产品,其余试剂用量和步骤相同,消耗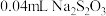 标准溶液。
标准溶液。
已知: ,
, ,
,
请回答下列问题:
(1)仪器c的名称为_______ ,步骤I中有黄绿色气体产生,则制备 反应的化学方程式为
反应的化学方程式为_______ ,干燥管d中的试剂是_______ 。
(2)步骤I中温度不宜过高的原因是_______ ,判断反应结束的实验现象是_______ 。
(3)步骤II中X溶液是_______ ,反应后用冰水冷却的目的是_______ 。
(4)步骤III中空白实验的主要目的是_______ 。
(5)碘酸钙晶体中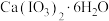 的纯度为
的纯度为_______ (计算结果保留两位小数)。
步骤I:碘酸氢钾
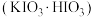 的制备
的制备在三颈烧瓶中加入
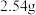 碘、
碘、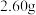 氯酸钾和
氯酸钾和 水,滴加
水,滴加 的盐酸至
的盐酸至 ,控制温度85℃左右,装置如图。
,控制温度85℃左右,装置如图。
步骤II:碘酸钙晶体
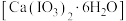 的制备
的制备将步骤I反应后的溶液转入烧杯中,加入X溶液调节
 ;继续滴加
;继续滴加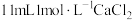 溶液,充分反应后用冰水冷却,抽滤、洗涤、干燥,得粗产品碘酸钙晶体
溶液,充分反应后用冰水冷却,抽滤、洗涤、干燥,得粗产品碘酸钙晶体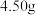 。
。步骤III:产品中碘酸钙晶体含量测定
①准确称取
 粗产品,置于烧杯中,加入
粗产品,置于烧杯中,加入 溶解样品,转移到
溶解样品,转移到 容量瓶中定容。量取
容量瓶中定容。量取 溶液于碘量瓶中,加入稍过量的
溶液于碘量瓶中,加入稍过量的 ,然后用
,然后用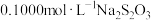 标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去
标准溶液滴定至浅黄色,加入2滴淀粉溶液,继续滴定至终点,平行测定三次后取平均值,用去 标准溶液。
标准溶液。②空白实验:不取产品,其余试剂用量和步骤相同,消耗
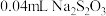 标准溶液。
标准溶液。已知:
 ,
, ,
,
请回答下列问题:
(1)仪器c的名称为
 反应的化学方程式为
反应的化学方程式为(2)步骤I中温度不宜过高的原因是
(3)步骤II中X溶液是
(4)步骤III中空白实验的主要目的是
(5)碘酸钙晶体中
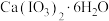 的纯度为
的纯度为
您最近一年使用:0次
2023-02-18更新
|
911次组卷
|
5卷引用:湖南省百校2023届高三开年摸底联考化学试题
湖南省百校2023届高三开年摸底联考化学试题山东省蒙阴第一中学等5校2023届高三开学摸底联考化学试题(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试变式题(实验探究题)(已下线)安徽省、云南省、吉林省、黑龙江省2023届高三2月适应性测试举一反三(实验探究题)广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题
解题方法
8 . 新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。

I.查阅资料:
①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
II.制备与分离:
(1)实验加药品前应进行的实验操作是___________ 。
(2)盛放NaClO3和Na2SO3固体的仪器名称是___________ ,该装置中发生反应的化学方程式___________ 。
(3)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②内容。
①减压,55℃蒸发结晶; ②___________ ;
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(4)装置D是处理尾气,反应的化学方程式___________ 。
III.测量与计算:
利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品2.890g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。
(5)①下列滴定操作会导致测量结果偏低的是___________ (填字母)。
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
②样品中NaClO2·3H2O的纯度为___________ %(用含c、v的代数式表示)。

I.查阅资料:
①NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
②ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
II.制备与分离:
(1)实验加药品前应进行的实验操作是
(2)盛放NaClO3和Na2SO3固体的仪器名称是
(3)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②内容。
①减压,55℃蒸发结晶; ②
③用38℃~60℃热水洗涤; ④在38℃~60℃间进行干燥,得到成品。
(4)装置D是处理尾气,反应的化学方程式
III.测量与计算:
利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I-不发生反应)的纯度,过程如下:取样品2.890g配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O
+4I-+4H+=2H2O+2I2+Cl-),然后用cmol·L-1 Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL(已知:I2+2S2O =S4O
=S4O +2I-)。
+2I-)。(5)①下列滴定操作会导致测量结果偏低的是
a 锥形瓶洗涤后没有干燥 b 滴定时锥形瓶中有液体溅出
c 滴定终点时俯视读数 d 滴定管滴定前有气泡,滴定后气泡消失
②样品中NaClO2·3H2O的纯度为
您最近一年使用:0次
解题方法
9 . 黄铜矿[主要成分为 ,含少量氯磷灰石
,含少量氯磷灰石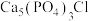 ]为原料的火法炼铜主要流程如下:
]为原料的火法炼铜主要流程如下:
已知:氯磷灰石高温下易被氧化为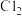 。某研究小组以黄铜矿为原料进行如下实验。
。某研究小组以黄铜矿为原料进行如下实验。
(1)燃烧碘量法测定黄铜矿中硫元素的含量。
将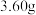 矿样与足量
矿样与足量 混合,以氨气为载气,在1250℃左右高温炉中加热,将产生的
混合,以氨气为载气,在1250℃左右高温炉中加热,将产生的 气体用含淀粉的溶液吸收,同时用
气体用含淀粉的溶液吸收,同时用 的
的 标准溶液缓慢滴定(还原产物为碘离子)。装置如图所示(Sn的+4价化合物比+2价稳定)。
标准溶液缓慢滴定(还原产物为碘离子)。装置如图所示(Sn的+4价化合物比+2价稳定)。
①通入氮气的作用是_______ 。
②写出滴定过程中生成遇淀粉溶液变蓝色的物质的离子方程式_______ ;滴定终点现象为_______ 。
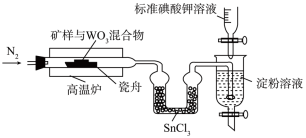
③若滴定至终点时,消耗标准液体积为 ,则矿样中硫元素的质量分数为
,则矿样中硫元素的质量分数为_______ 。
④ 的作用是
的作用是_______ 。
(2)利用下图装置制取粗铜。
实验操作依次为_______ (填写字母序号)。
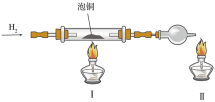
a.加装药品 b.通入H2 c.点燃酒精灯II至产生稳定火焰
d.组装仪器 e.点燃酒精灯I f.检查装置的气密性
(3)由熔渣制绿矾 的流程如下(已知
的流程如下(已知 难溶于水):
难溶于水):
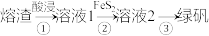
步骤②加入 的目的是将
的目的是将 还原(硫元素被氧化为
还原(硫元素被氧化为 ),则对应反应的离子方程式为
),则对应反应的离子方程式为_______ 。
 ,含少量氯磷灰石
,含少量氯磷灰石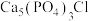 ]为原料的火法炼铜主要流程如下:
]为原料的火法炼铜主要流程如下:已知:氯磷灰石高温下易被氧化为
 。某研究小组以黄铜矿为原料进行如下实验。
。某研究小组以黄铜矿为原料进行如下实验。
(1)燃烧碘量法测定黄铜矿中硫元素的含量。
将
 矿样与足量
矿样与足量 混合,以氨气为载气,在1250℃左右高温炉中加热,将产生的
混合,以氨气为载气,在1250℃左右高温炉中加热,将产生的 气体用含淀粉的溶液吸收,同时用
气体用含淀粉的溶液吸收,同时用 的
的 标准溶液缓慢滴定(还原产物为碘离子)。装置如图所示(Sn的+4价化合物比+2价稳定)。
标准溶液缓慢滴定(还原产物为碘离子)。装置如图所示(Sn的+4价化合物比+2价稳定)。①通入氮气的作用是
②写出滴定过程中生成遇淀粉溶液变蓝色的物质的离子方程式

③若滴定至终点时,消耗标准液体积为
 ,则矿样中硫元素的质量分数为
,则矿样中硫元素的质量分数为④
 的作用是
的作用是(2)利用下图装置制取粗铜。
实验操作依次为

a.加装药品 b.通入H2 c.点燃酒精灯II至产生稳定火焰
d.组装仪器 e.点燃酒精灯I f.检查装置的气密性
(3)由熔渣制绿矾
 的流程如下(已知
的流程如下(已知 难溶于水):
难溶于水):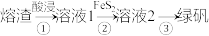
步骤②加入
 的目的是将
的目的是将 还原(硫元素被氧化为
还原(硫元素被氧化为 ),则对应反应的离子方程式为
),则对应反应的离子方程式为
您最近一年使用:0次
解题方法
10 . 《环境科学》刊发了我国科研部门采用零价铁活化过二硫酸钠(Na2S2O8) 去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。下列叙述不正确的是
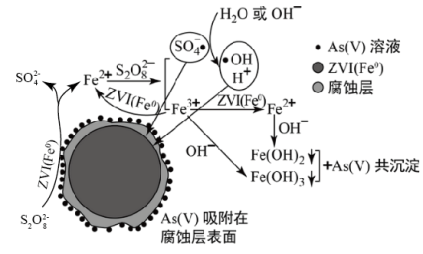

A.56gFe参加反应,消耗的S2O 大于1 mol 大于1 mol |
| B.过二硫酸钠(Na2S2O8) 中S的化合价为+6 |
| C.pH越大,越有利于去除废水中的正五价砷 |
D.碱性条件下,硫酸根自由基发生反应的方程式为:  +H2O= SO +H2O= SO + + +H+ +H+ |
您最近一年使用:0次



