1 . [Cu(NH3)4]SO4•H2O是铜的重要配合物,其制备原料之一CuSO4可用废铜屑制备,其实验方案如下:
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
| A.方案1使用的玻璃仪器有烧杯、分液漏斗、玻璃棒和酒精灯 |
| B.方案2中参与反应的硫酸利用率为50%,且产生大气污染物 |
| C.方案3的离子方程式为Cu+H2O2+2H+=Cu2++2H2O |
D.方案4的化学方程式为2Cu+H2SO4+O2 2CuSO4+2H2O 2CuSO4+2H2O |
您最近一年使用:0次
2 . (NH4)2Fe(SO4)2(摩尔盐)是一种重要试剂。下列有关离子方程式错误的是
| A.在(NH4)2Fe(SO4)2溶液中滴加足量澄清石灰水:Fe2++2OH-=Fe(OH)2↓ |
| B.在(NH4)2Fe(SO4)2溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
C.在(NH4)2Fe(SO4)2溶液中滴加酸性KMnO4溶液:5Fe2++8H++MnO =Mn2++5Fe3++4H2O =Mn2++5Fe3++4H2O |
D.在(NH4)2Fe(SO4)2溶液中加入过量NaHCO3生成FeCO3:Fe2++2HCO =FeCO3↓+CO2↑+H2O =FeCO3↓+CO2↑+H2O |
您最近一年使用:0次
名校
3 . 红树林沉积物中微生物驱动的硫循环过程原理如图所示,在有氧层中有机物通过微生物有氧呼吸来分解,在无氧层中有机物通过微生物驱动硫酸盐还原来分解,下列说法错误的是
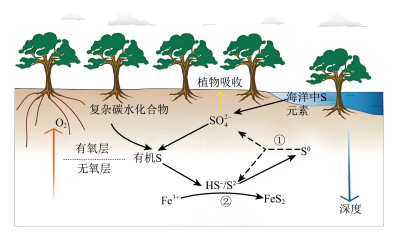
A.随着沉积物深度的增加, 主要做氧化剂将有机物氧化分解 主要做氧化剂将有机物氧化分解 |
B.反应①中氧化剂与还原剂的物质的量之比为 |
C.反应②中 与 与 的反应为 的反应为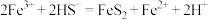 |
D.红树林沉积物中 元素主要以 元素主要以 形式存在 形式存在 |
您最近一年使用:0次
名校
4 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以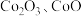 的形式存在,还含有
的形式存在,还含有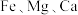 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②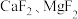 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“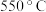 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知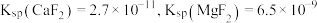 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中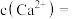
_________ (保留3位有效数字)。
(6)钴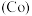 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以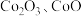 的形式存在,还含有
的形式存在,还含有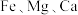 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: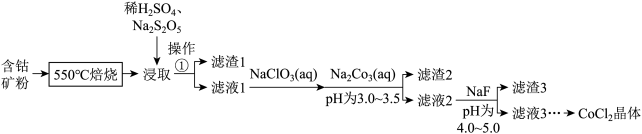
 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
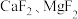 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
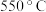 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
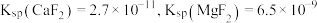 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中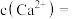
(6)钴
 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。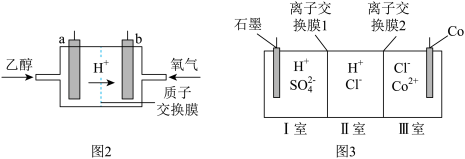
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
名校
5 . 利用高分子吸附树脂吸附 来提取卤水中的碘(以
来提取卤水中的碘(以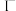 形式存在)的工艺流程如下:
形式存在)的工艺流程如下:
 来提取卤水中的碘(以
来提取卤水中的碘(以 形式存在)的工艺流程如下:
形式存在)的工艺流程如下: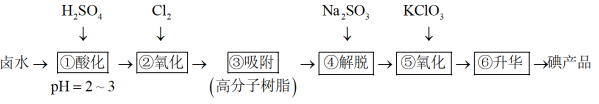
A.流程中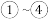 的目的是富集碘 的目的是富集碘 |
B.步骤②中 不宜过量太多,以防止 不宜过量太多,以防止 进一步氧化 进一步氧化 |
| C.步骤④的作用是将吸附的碘还原而脱离高分子树脂 |
D.步骤⑤的离子方程式为: |
您最近一年使用:0次
名校
解题方法
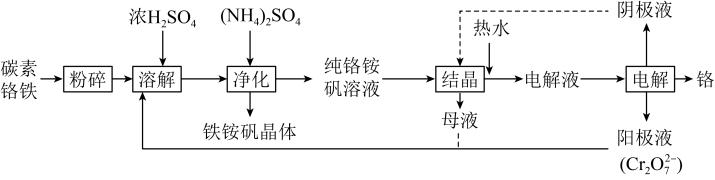
6 . 铬广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。工业上以碳素铬铁(铁铬合金)为原料,利用电解法制取金属铬的工艺流程如图所示: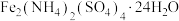 。
。
回答下列问题:
(1)“溶解”前,粉碎碳素铬铁的目的是___________ 。
(2)“溶解”步骤中,需加热到105℃,写出铬与浓硫酸反应的化学方程式:___________ ;碳素铬铁过量时会产生 ,阳极液(
,阳极液(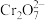 )进入到“溶解”步骤中,与
)进入到“溶解”步骤中,与 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)若铬铵矾晶体为二十四水结晶水合物,属于复盐,其中铬的化合价为+3价,则铬铵矾晶体的化学式为___________ 。
(4)若以惰性电极进行“电解”,Cr3+在阳极放电的电极反应式为___________ ,当外电路有0.6mol电子转移,则在阴极上生成铬的质量为___________ g。
(5)Cr单质的晶胞结构如图所示。已知晶体密度为 ,
, 为阿伏加德罗常数的值,则Cr原子的半径为
为阿伏加德罗常数的值,则Cr原子的半径为___________ nm(用含有 、
、 的代数式表示)。
的代数式表示)。
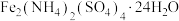 。
。回答下列问题:
(1)“溶解”前,粉碎碳素铬铁的目的是
(2)“溶解”步骤中,需加热到105℃,写出铬与浓硫酸反应的化学方程式:
 ,阳极液(
,阳极液(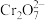 )进入到“溶解”步骤中,与
)进入到“溶解”步骤中,与 发生反应的离子方程式为
发生反应的离子方程式为(3)若铬铵矾晶体为二十四水结晶水合物,属于复盐,其中铬的化合价为+3价,则铬铵矾晶体的化学式为
(4)若以惰性电极进行“电解”,Cr3+在阳极放电的电极反应式为
(5)Cr单质的晶胞结构如图所示。已知晶体密度为
 ,
, 为阿伏加德罗常数的值,则Cr原子的半径为
为阿伏加德罗常数的值,则Cr原子的半径为 、
、 的代数式表示)。
的代数式表示)。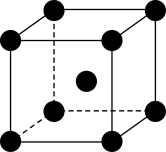
您最近一年使用:0次
名校
7 . 工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、 等)回收Se。
等)回收Se。 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。
②Se难溶于水,沸点684.9℃,易与 反应。
反应。
③反应的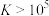 ,代表可完全转化。室温下
,代表可完全转化。室温下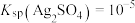 ,
,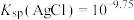 。
。
下列说法正确的是
 等)回收Se。
等)回收Se。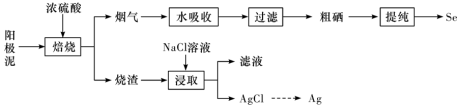
 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。②Se难溶于水,沸点684.9℃,易与
 反应。
反应。③反应的
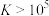 ,代表可完全转化。室温下
,代表可完全转化。室温下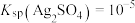 ,
,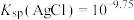 。
。下列说法正确的是
A.理论上,发生反应的 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.在真空中可进行粗硒提纯,可降低体系中硒的沸点 |
C.“滤液”为 溶液 溶液 |
D.加入NaCl溶液浸取时发生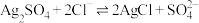 ,该反应过程不可完全转化 ,该反应过程不可完全转化 |
您最近一年使用:0次
名校
8 . 下列方程式与所给事实不相符的是
A.饱和 溶液呈绿色是因为存在平衡: 溶液呈绿色是因为存在平衡: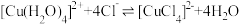 |
B.黑火药爆炸时发生反应: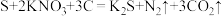 |
C.氯气通入冷的石灰乳中制漂白粉: |
D. 制备 制备 |
您最近一年使用:0次
解题方法
9 . 硫酸铈铵[ ,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含
,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含 等)为原料制备硫酸铈铵的工艺流程如图所示。
等)为原料制备硫酸铈铵的工艺流程如图所示。
 在空气中易被氧化为
在空气中易被氧化为 ;
; ;
;
回答下列问题:
(1)“滤渣A”的成分除 外,还有
外,还有_____________ (填化学式);
(2)“焙烧”时,下列采取的措施正确的是_____________(填标号);
(3)在另一种工艺中,在氟碳铈矿粉中加入碳酸氢钠固体同时通入氧气焙烧,得到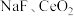 两种固体以及两种高温下的气态物质,该反应的化学方程式为
两种固体以及两种高温下的气态物质,该反应的化学方程式为____________________________ ;
(4)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是_____________(填标号)。
(5) 分子中
分子中 键角
键角_________ (填“大于”“小于”或“等于”)硫脲分子中 键角;
键角;
(6)“溶解”时加入稀盐酸后,还需加入另一种化学试剂X,根据题中信息推测,加入X的作用是__________ ;
(7)含 溶液与足量
溶液与足量 溶液反应生成
溶液反应生成 沉淀的离子方程式为
沉淀的离子方程式为________________ ;
(8)利用硫化锌锂电池电解含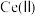 的溶液,可将
的溶液,可将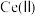 转化为
转化为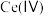 .该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示;
.该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示; 中,
中,
________ ;
②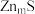 晶胞中,
晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间最近的核间距为
之间最近的核间距为 ,则
,则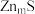 晶体的密度为
晶体的密度为__________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含
,相对分子质量为596]微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。以氟碳铈矿(含 等)为原料制备硫酸铈铵的工艺流程如图所示。
等)为原料制备硫酸铈铵的工艺流程如图所示。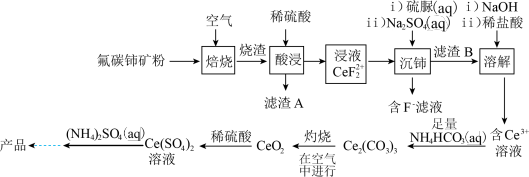
 在空气中易被氧化为
在空气中易被氧化为 ;
;②硫脲的结构简式为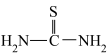 ,具有还原性;
,具有还原性;
 ;
;回答下列问题:
(1)“滤渣A”的成分除
 外,还有
外,还有(2)“焙烧”时,下列采取的措施正确的是_____________(填标号);
| A.采用高压空气,使矿粉呈“沸腾”状 |
| B.空气从焙烧炉上部通入,矿粉从焙烧炉下部加入 |
| C.空气从焙烧炉下部通入,矿粉从焙烧炉上部加入 |
| D.空气、矿粉均从焙烧炉上部通入或加入 |
(3)在另一种工艺中,在氟碳铈矿粉中加入碳酸氢钠固体同时通入氧气焙烧,得到
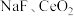 两种固体以及两种高温下的气态物质,该反应的化学方程式为
两种固体以及两种高温下的气态物质,该反应的化学方程式为(4)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是_____________(填标号)。

A. | B.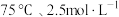 | C. | D. |
(5)
 分子中
分子中 键角
键角 键角;
键角;(6)“溶解”时加入稀盐酸后,还需加入另一种化学试剂X,根据题中信息推测,加入X的作用是
(7)含
 溶液与足量
溶液与足量 溶液反应生成
溶液反应生成 沉淀的离子方程式为
沉淀的离子方程式为(8)利用硫化锌锂电池电解含
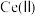 的溶液,可将
的溶液,可将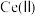 转化为
转化为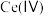 .该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示;
.该硫化锌锂电池放电时,负极材料的立方晶胞组成变化如图所示;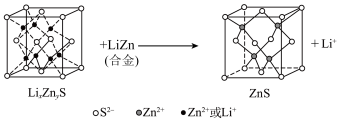
 中,
中,
②
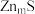 晶胞中,
晶胞中, 填充在
填充在 构成的部分正四面体空隙中,
构成的部分正四面体空隙中, 和
和 之间最近的核间距为
之间最近的核间距为 ,则
,则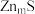 晶体的密度为
晶体的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
2024-05-14更新
|
110次组卷
|
2卷引用:湖南省高中联盟2024届高三下学期5月适应性考试化学试卷
名校
解题方法
10 . 新能源汽车工业飞速发展依赖于锂离子电池的新型电极材料的研究取得的重大成果。 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。
(1)“浸锰”时, 生成
生成 的离子方程式为
的离子方程式为___________ 。
(2)步骤Ⅱ中, 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是___________ 。 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为___________ {已知该条件下,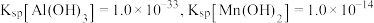 }。
}。
(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为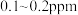 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。
①以 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧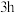 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到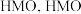 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为___________ ;
②用酸处理 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是___________ 。这一副反应对再生后的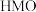 的锂富集性能的影响是
的锂富集性能的影响是___________ 。
(5)利用高纯 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
步骤1:向 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成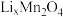 ;
;
步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使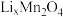 中的
中的 脱出进入腔室2。
脱出进入腔室2。 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入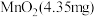 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在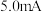 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
___________ (已知 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。
②电源2工作时, 电极上发生的电极反应为
电极上发生的电极反应为___________ 。
 可以实现海水中
可以实现海水中 的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含
的富集,对锂离子电池的研究作出重要贡献。以软锰矿(含 及少量
及少量 和
和 )为原料生产高纯
)为原料生产高纯 的工艺流程如图甲。
的工艺流程如图甲。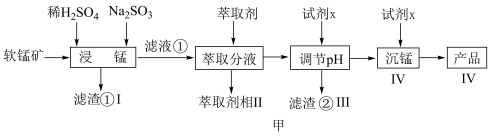
(1)“浸锰”时,
 生成
生成 的离子方程式为
的离子方程式为(2)步骤Ⅱ中,
 的萃取率与
的萃取率与 的关系如图乙,当
的关系如图乙,当 后,随
后,随 增大,
增大, 萃取率下降的原因是
萃取率下降的原因是
 ,若
,若 ,常温下调节
,常温下调节 范围应为
范围应为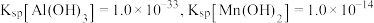 }。
}。(4)海水中锂的总含量为陆地总含量的5000倍以上,但海水中锂的质量浓度仅为
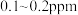 ,从海水中提取锂首先需要对低浓度的
,从海水中提取锂首先需要对低浓度的 进行选择性富集,而
进行选择性富集,而 能够嵌入高纯
能够嵌入高纯 并在一定条件下脱出,据此可以进行
并在一定条件下脱出,据此可以进行 的富集。
的富集。①以
 和高纯
和高纯 为原料,充分混合后在720℃下煅烧
为原料,充分混合后在720℃下煅烧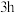 ,冷却至室温后即可得到复合氧化物
,冷却至室温后即可得到复合氧化物 。用
。用 的盐酸在60℃下处理
的盐酸在60℃下处理 ,将其中所有
,将其中所有 置换后得到
置换后得到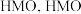 可以和
可以和 反应再生成
反应再生成 ,然后
,然后 与酸作用脱出
与酸作用脱出 从而实现
从而实现 的富集。如此循环处理。合成
的富集。如此循环处理。合成 的化学方程式为
的化学方程式为②用酸处理
 时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含
时,除离子交换反应之外,也会发生一个副反应,该副反应导致固体中M的平均化合价有所提高,则副反应的生成物中含 元素的微粒是
元素的微粒是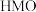 的锂富集性能的影响是
的锂富集性能的影响是(5)利用高纯
 实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:
实施电化学富集锂是行之有效的方法。电化学系统(如图丙所示)的工作步骤如下:步骤1:向
 所在的腔室通入海水,启动电源1,使海水中的
所在的腔室通入海水,启动电源1,使海水中的 进入
进入 结构而形成
结构而形成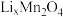 ;
;步骤2:关闭电源1和海水通道,启动电源2,同时向电极2上通入空气,使
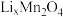 中的
中的 脱出进入腔室2。
脱出进入腔室2。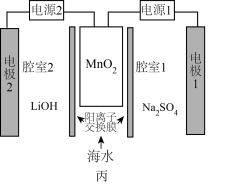
 对
对 的富集效果,将
的富集效果,将 的
的 溶液通入
溶液通入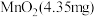 所在腔室,启动电源1,使电流恒定在
所在腔室,启动电源1,使电流恒定在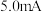 ,累计工作
,累计工作 后发现
后发现 的电极电势快速下降,则
的电极电势快速下降,则 中的
中的
 电子的电量为
电子的电量为 。电流效率为
。电流效率为 )。
)。②电源2工作时,
 电极上发生的电极反应为
电极上发生的电极反应为
您最近一年使用:0次
2024-05-14更新
|
185次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题





