名校
1 . 某研究小组利用下图所示装置探究卤素的性质。___________ (填“氧化性”或“还原性”)。
(2)①中溶液有I2生成,发生反应的化学方程式是___________ 。
(3)②中NaOH溶液的作用是吸收多余的氯气,发生反应的离子方程式是___________ 。
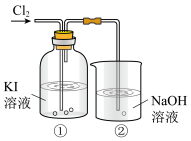
(2)①中溶液有I2生成,发生反应的化学方程式是
(3)②中NaOH溶液的作用是吸收多余的氯气,发生反应的离子方程式是
您最近半年使用:0次
2 . Ⅰ.某无色透明溶液中可能大量存在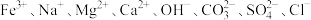 中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
③向第三份溶液中先加入 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
已知: 可与水作用,产生较多的
可与水作用,产生较多的 ,使溶液呈碱性;
,使溶液呈碱性; 溶于稀硝酸。
溶于稀硝酸。
(1)根据上述实验现象可知,原溶液中一定存在的离子是_______ ,一定不存在的离子是_______ ,不能确定是否存在的离子是_______ 。
Ⅱ.次磷酸 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的 还原为银单质,从而用于化学镀银。
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与
的工业制法是将白磷与 溶液反应生成
溶液反应生成 气体和
气体和 ,后者再与
,后者再与 反应生成
反应生成 。
。
(2)写出白磷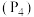 与
与 溶液反应的化学方程式:
溶液反应的化学方程式:_______ ,反应中每消耗 ,转移的电子数为
,转移的电子数为_______ 。
(3)写出 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:_______ 。
(4)工业上利用 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中
进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中 元素的化合价为
元素的化合价为_______ 。
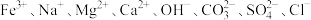 中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:
中的几种,为确定溶液中的离子组成,取三份少量溶液于试管中,进行了如下实验:①向第一份溶液中滴入几滴酚酞试液,溶液变红;
②向第二份溶液中加入过量
 溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;
溶液,生成白色沉淀,然后再滴加足量盐酸,沉淀部分溶解并有气泡冒出;③向第三份溶液中先加入
 溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。
溶液,生成白色沉淀,再加入稀硝酸,沉淀完全溶解。已知:
 可与水作用,产生较多的
可与水作用,产生较多的 ,使溶液呈碱性;
,使溶液呈碱性; 溶于稀硝酸。
溶于稀硝酸。(1)根据上述实验现象可知,原溶液中一定存在的离子是
Ⅱ.次磷酸
 是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的
是一种精细的磷化工产品,它是一元弱酸,具有较强的还原性,可将溶液中的 还原为银单质,从而用于化学镀银。
还原为银单质,从而用于化学镀银。 的工业制法是将白磷与
的工业制法是将白磷与 溶液反应生成
溶液反应生成 气体和
气体和 ,后者再与
,后者再与 反应生成
反应生成 。
。(2)写出白磷
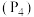 与
与 溶液反应的化学方程式:
溶液反应的化学方程式: ,转移的电子数为
,转移的电子数为(3)写出
 与足量
与足量 溶液反应的离子方程式:
溶液反应的离子方程式:(4)工业上利用
 进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中
进行化学镀银的反应中,当氧化剂与还原剂物质的量之比为4∶1时,则氧化产物中 元素的化合价为
元素的化合价为
您最近半年使用:0次
名校
解题方法
3 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。河南焦作的山药富含硒( ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。
(1) 的原子结构示意图为
的原子结构示意图为______________ ,其在周期表中的位置为______________ 。
(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是______________ (填标号)。
A.还原性: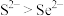
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性: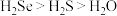
D.氧化性: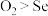
② 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为______________ ; 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为______________ 。
(3)某混合物中硒主要以 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将该混合物与浓硫酸混合焙烧,产生 、
、 的烟气
的烟气
ⅱ.用水吸收ⅰ中烟气,可得 固体
固体
已知: 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。
①可用足量 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为__________ 。
② 中
中 的化合价为
的化合价为_________ 价;焙烧时, 与浓
与浓 反应的化学方程式为
反应的化学方程式为_________________ ,理论上该反应每转移1 电子,得到的
电子,得到的 的质量为
的质量为_________ g。
 ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。(1)
 的原子结构示意图为
的原子结构示意图为(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是
A.还原性:
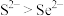
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性:
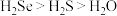
D.氧化性:
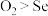
②
 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为(3)某混合物中硒主要以
 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将该混合物与浓硫酸混合焙烧,产生
 、
、 的烟气
的烟气ⅱ.用水吸收ⅰ中烟气,可得
 固体
固体已知:
 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。①可用足量
 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为②
 中
中 的化合价为
的化合价为 与浓
与浓 反应的化学方程式为
反应的化学方程式为 电子,得到的
电子,得到的 的质量为
的质量为
您最近半年使用:0次
2024-04-21更新
|
210次组卷
|
3卷引用:湖南省衡阳市衡阳县三校2023-2024学年高一下学期三月联考化学试题
4 . 现有下列六种物质:①液态氯化氢;②二氧化碳;③硫酸铜溶液;④熔融氯化钠;⑤ 固体;⑥铁丝.
固体;⑥铁丝.
(1)上述六种物质中,属于非电解质的是__________ ,能导电的电解质是__________ (填序号)。
(2)③和⑥反应的基本反应类型为__________ ,其离子方程式为__________ 。
(3)氯化氢在水溶液中的电离方程式为__________ 。
(4)向③中加入⑤的水溶液的现象为__________ 。
(5) 与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失
与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失______ 。
__________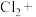 __________
__________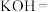 __________
__________ __________
__________ __________
__________
 固体;⑥铁丝.
固体;⑥铁丝.(1)上述六种物质中,属于非电解质的是
(2)③和⑥反应的基本反应类型为
(3)氯化氢在水溶液中的电离方程式为
(4)向③中加入⑤的水溶液的现象为
(5)
 与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失
与⑤可能会发生如下反应,配平该方程式,并用双线桥标出电子得失__________
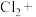 __________
__________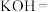 __________
__________ __________
__________ __________
__________
您最近半年使用:0次
名校
5 . 汽车尾气(含 、
、 、CO、
、CO、 、
、 等)是城市空气的污染源之一、
等)是城市空气的污染源之一、
(1)汽车尾气对环境的危害主要有温室效应、雾霾、_______ 等。
(2)在三元催化装置的作用下,汽车尾气可转化为无污染的物质。写出CO与 在此条件下反应的化学方程式:
在此条件下反应的化学方程式:_______ ,消耗14gCO时,转移电子的物质的量是_______ mol。
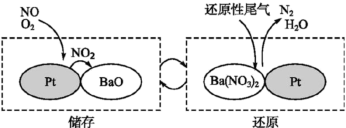
(3) 储存还原技术可有效降低柴油发动机在空气过量条件下
储存还原技术可有效降低柴油发动机在空气过量条件下 的排放。如图所示,
的排放。如图所示, 的储存和还原在不同时段交替进行,通过BaO和
的储存和还原在不同时段交替进行,通过BaO和 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是_______ 。
(4) 也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备
也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备 的反应方程式
的反应方程式_______ 。
(5)若将 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有_______ (填离子符号)。
 、
、 、CO、
、CO、 、
、 等)是城市空气的污染源之一、
等)是城市空气的污染源之一、(1)汽车尾气对环境的危害主要有温室效应、雾霾、
(2)在三元催化装置的作用下,汽车尾气可转化为无污染的物质。写出CO与
 在此条件下反应的化学方程式:
在此条件下反应的化学方程式:(3)
 储存还原技术可有效降低柴油发动机在空气过量条件下
储存还原技术可有效降低柴油发动机在空气过量条件下 的排放。如图所示,
的排放。如图所示, 的储存和还原在不同时段交替进行,通过BaO和
的储存和还原在不同时段交替进行,通过BaO和 的相互转化实现
的相互转化实现 的储存和还原。储存
的储存和还原。储存 的物质是
的物质是
(4)
 也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备
也可以用于催化转化NOx,减少空气污染。请写出实验室用铵盐制备 的反应方程式
的反应方程式(5)若将
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,反应完毕后,溶液中上述离子数目几乎不变的有
,反应完毕后,溶液中上述离子数目几乎不变的有
您最近半年使用:0次
名校
解题方法
6 . NOx是污染性气体,其性质的掌握及防污处理很重要。回答下列问题:
(1)写出NO2与水反应的离子方程式:___________ ,该反应中氧化剂与还原剂的质量比为____________ 。
(2)相同条件下,将10mL装满NO2与O2的试管倒扣在水槽中,充分反应。若试管中还剩余2mL无色气体,则原试管中NO2的体积可能为___________ mL(答出所有可能)。
(3)NaOH溶液可吸收硝酸工业尾气(含NO、NO2),并获得副产品。
已知: 、
、 。要使硝酸的工业尾气完全被吸收,
。要使硝酸的工业尾气完全被吸收, 的比值应满足
的比值应满足__________ 。
(4)尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

①尿素[CO(NH2)2]中氮元素的化合价为_______________ 。
②写出“催化反应”过程中NH3还原NOx的化学方程式:__________ 。
③“催化反应”过程中需控制温度在250~380℃之间,温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和_____________________ 。
(1)写出NO2与水反应的离子方程式:
(2)相同条件下,将10mL装满NO2与O2的试管倒扣在水槽中,充分反应。若试管中还剩余2mL无色气体,则原试管中NO2的体积可能为
(3)NaOH溶液可吸收硝酸工业尾气(含NO、NO2),并获得副产品。
已知:
 、
、 。要使硝酸的工业尾气完全被吸收,
。要使硝酸的工业尾气完全被吸收, 的比值应满足
的比值应满足(4)尿素水溶液热解产生的NH3可去除汽车尾气中的NOx,流程如下:

①尿素[CO(NH2)2]中氮元素的化合价为
②写出“催化反应”过程中NH3还原NOx的化学方程式:
③“催化反应”过程中需控制温度在250~380℃之间,温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
您最近半年使用:0次
名校
解题方法
7 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应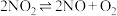 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
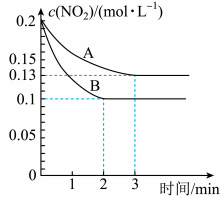
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,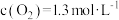 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
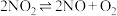 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,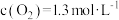 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近半年使用:0次
2024-04-05更新
|
65次组卷
|
2卷引用:湖南省常德市汉寿县第一中学2023-2024学年高三下学期3月月考化学试题
名校
8 . 无机化合物可根据其组成和性质进行分类,分类比较是研究物质性质常用的一类方法。
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要分离提取 出砷元素,有同学建议用NaOH溶液,理由是_______ 。
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①_______ ;②2AsH3=2As+3H2
(1)砷有多种化合物,其中As2O5溶于水缓慢化合生成一种三元酸(H3AsO4)。某工业废渣中含有As2O5、Fe2O3和MgO三种物质。现要
(2)As2O3俗称砒霜,是宫廷剧中“鹤顶红”的有效成分,可以用马氏试砷法来检测砒霜。具体方法是:用Zn、盐酸和试样混在一起,将生成的气体导入热玻璃管,若试样中有砒霜,就会在热玻璃管中产生As,As积集而成亮黑色的“砷镜”。生成“砷镜”过程中共发生两个反应,①
您最近半年使用:0次
9 . 改善大气质量、进行污水处理和将垃圾资源化等要靠化学等科学的发展。
(1)为了保护环境,防治酸雨的方法是减少________ 的排放(填“ ”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用
”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用________ 。(填“ ”或“氟氯代烷”)
”或“氟氯代烷”)
(2)垃圾是放错地方的资源。下列垃圾处理方式正确的是________ (填字母代号)。
a.回收利用易拉罐 b.焚烧废旧报纸 c.随意丢弃废旧电池
我国“十四五”规划中已明确提到“碳达峰”、“碳中和”的目标,请回答下列问题:
(3)写出碳元素的两种同素异形体名称________ 。(任写两种)
(4)“碳达峰”、“碳中和”的“碳”主要指的具体物质是________ ,其所属物质类别为________ 。(填写下列正确的选项代号)
A.电解质 B.非电解质 C.酸性氧化物
(5)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程为:________ ,该反应中还原剂是________ 。
(6)某化学兴趣小组同学将燃烧的镁条插入盛满 的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为
的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为 ,试用双线桥分析该反应电子的得失及数目:
,试用双线桥分析该反应电子的得失及数目:________ 。
(1)为了保护环境,防治酸雨的方法是减少
 ”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用
”或“氟氯代烷”);减缓臭氧层受损的方法是减少使用 ”或“氟氯代烷”)
”或“氟氯代烷”)(2)垃圾是放错地方的资源。下列垃圾处理方式正确的是
a.回收利用易拉罐 b.焚烧废旧报纸 c.随意丢弃废旧电池
我国“十四五”规划中已明确提到“碳达峰”、“碳中和”的目标,请回答下列问题:

(3)写出碳元素的两种同素异形体名称
(4)“碳达峰”、“碳中和”的“碳”主要指的具体物质是
A.电解质 B.非电解质 C.酸性氧化物
(5)我国科学家合成一种新型催化剂,将二氧化碳和水反应生成甲烷和氧气,该反应的化学方程为:
(6)某化学兴趣小组同学将燃烧的镁条插入盛满
 的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为
的集气瓶内,发现镁条继续燃烧,生成白色固体,并有黑色物质附着在集气瓶内壁,反应的化学方程式为 ,试用双线桥分析该反应电子的得失及数目:
,试用双线桥分析该反应电子的得失及数目:
您最近半年使用:0次
名校
解题方法
10 . 氮、硫的氧化物都会引起环境问题,越来越引起人们的重视。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:
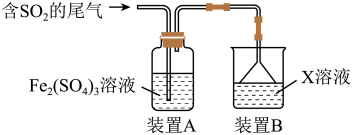
(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:___________ 。
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为___________ ;若要检验SO2是否过量,可用试剂为___________ 。
(3)装置B中所用X溶液常为碱溶液,其作用是___________ 。
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为___________ 。
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷___________ 。
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:___________ 。
Ⅰ.某兴趣小组用Fe2(SO4)3溶液吸收含SO2的尾气(SO2的体积分数约为10%,其余为空气),实验装置如图所示:

(1)装置A中SO2与Fe2(SO4)3溶液反应生成FeSO4,写出该反应的化学方程式:
(2)反应后,若要检验装置A中Fe3+是否过量,可用试剂为
(3)装置B中所用X溶液常为碱溶液,其作用是
(4)若实验测得反应后的装置A中不含有SO2,为测定其中所含FeSO4的物质的量浓度,现进行如下实验:取20.00 mL装置A中溶液,向其中逐滴加入0.100 0 mol/L Ce(SO4)2溶液,发生反应Fe2++Ce4+= Ce3++Fe3+,当反应恰好完全时,共消耗Ce(SO4)2溶液18.00 mL。则FeSO4的物质的量浓度为
Ⅱ.工业制硝酸时尾气中含有NO、NO2,可用以下方法吸收:
(5)水吸收法。结合化学方程式说明用水吸收NO2的缺陷
(6)工厂里常采用NaOH溶液吸收NO、NO2的混合气体,使其转化为化工产品NaNO2,试写出其化学方程式:
您最近半年使用:0次



