名校
解题方法
1 . Ⅰ.氧化还原反应是一类重要的化学反应,广泛存在于生产和生活中。请结合相关化学知识回答下列问题:
(1)黑火药由硫黄、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C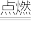 K2S+N2↑+3CO2↑,反应中被还原的物质是
K2S+N2↑+3CO2↑,反应中被还原的物质是___________ (填化学式)。
(2)NaH可在野外作生氢剂,NaH+H2O=NaOH+H2↑,该反应中氧化产物和还原产物的质量比为___________ 。
(3)在汽车的排气管上装一个催化转化器,可有效降低氮氧化物的排放,其中一个反应为2CO+2NO N2+2CO2.用单线桥法表示出电子转移的方向和数目:
N2+2CO2.用单线桥法表示出电子转移的方向和数目:___________ 。
(4)工业废水中的 有毒,常在酸性条件下用Fe2+做处理剂,将
有毒,常在酸性条件下用Fe2+做处理剂,将 还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为___________ 。
II.配制200mL1.0mol/LH2SO4溶液。
(5)计算:现有500mL密度为1.84g/cm3,质量分数为98%的浓硫酸,若换算成物质的量浓度为___________ mol/L。若配制200mL1.0mol/L稀H2SO4溶液。需要取上述这种浓H2SO4溶液___________ mL来(计算结果精确到小数点后一位)。
(6)配制过程中的正确操作顺序是:b、d、___________ 、e(填“字母”)。
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的18mol/LH2SO4溶液注入盛有约50mL蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f.将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g.往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是___________ (填“字母”)。
a.移液过程有H2SO4溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线 d.加水超过刻度线,用胶头滴管吸出多余液体
(1)黑火药由硫黄、硝酸钾和木炭按一定比例混合而成,爆炸时的反应为S+2KNO3+3C
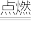 K2S+N2↑+3CO2↑,反应中被还原的物质是
K2S+N2↑+3CO2↑,反应中被还原的物质是(2)NaH可在野外作生氢剂,NaH+H2O=NaOH+H2↑,该反应中氧化产物和还原产物的质量比为
(3)在汽车的排气管上装一个催化转化器,可有效降低氮氧化物的排放,其中一个反应为2CO+2NO
 N2+2CO2.用单线桥法表示出电子转移的方向和数目:
N2+2CO2.用单线桥法表示出电子转移的方向和数目:(4)工业废水中的
 有毒,常在酸性条件下用Fe2+做处理剂,将
有毒,常在酸性条件下用Fe2+做处理剂,将 还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为
还原为Cr3+,Fe2+被氧化成Fe3+。反应的离子方程式为II.配制200mL1.0mol/LH2SO4溶液。
(5)计算:现有500mL密度为1.84g/cm3,质量分数为98%的浓硫酸,若换算成物质的量浓度为
(6)配制过程中的正确操作顺序是:b、d、
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的18mol/LH2SO4溶液注入盛有约50mL蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f.将稀释后的H2SO4溶液沿玻璃棒注入250mL容量瓶。
g.往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
(7)下列操作将导致所配制的H2SO4溶液浓度偏大的是
a.移液过程有H2SO4溶液溅出瓶外 b.移液后未洗涤烧杯和玻璃棒
c.定容时俯视容量瓶刻度线 d.加水超过刻度线,用胶头滴管吸出多余液体
您最近一年使用:0次
2023-12-30更新
|
99次组卷
|
2卷引用: 湖南省怀化市第一中学2023-2024学年高一上学期12月月考化学试题
解题方法
2 . 回答下列问题
(1)在xR2++yH++O2=mR3++nH2O的离子方程式中,下列判断正确的是_______。
(2)用含有3个Na2SO3的Na2SO3溶液恰好将2个的XO 还原,则元素X在还原产物中的化合价是
还原,则元素X在还原产物中的化合价是_______ 。
(3)+6价铬的毒性很强,具有一定的致癌作用,需要转化为低毒的Cr3+,再转化为不溶物除去,废水中含有的 可以用绿矾(
可以用绿矾( )除去。测得反应后的溶液中含Cr3+、Fe3+、H+等阳离子。写出该反应的离子方程式:
)除去。测得反应后的溶液中含Cr3+、Fe3+、H+等阳离子。写出该反应的离子方程式:_______ 。
(4)配平下列氧化还原反应方程式,并标出单线桥:_____
 H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O + S↓+
S↓+ NO↑
NO↑
(5)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式_______ 。
(1)在xR2++yH++O2=mR3++nH2O的离子方程式中,下列判断正确的是_______。
| A.m=y,R3+是还原剂 | B.m=2y,R2+被氧化 |
| C.m=2,R3+是氧化剂 | D.m=4,R2+是还原剂 |
 还原,则元素X在还原产物中的化合价是
还原,则元素X在还原产物中的化合价是(3)+6价铬的毒性很强,具有一定的致癌作用,需要转化为低毒的Cr3+,再转化为不溶物除去,废水中含有的
 可以用绿矾(
可以用绿矾( )除去。测得反应后的溶液中含Cr3+、Fe3+、H+等阳离子。写出该反应的离子方程式:
)除去。测得反应后的溶液中含Cr3+、Fe3+、H+等阳离子。写出该反应的离子方程式:(4)配平下列氧化还原反应方程式,并标出单线桥:
 H2S +
H2S +  HNO3(稀) =
HNO3(稀) =  H2O +
H2O + S↓+
S↓+ NO↑
NO↑(5)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式
您最近一年使用:0次
2022-10-30更新
|
186次组卷
|
3卷引用:湖南省怀化市中方县第一中学2022-2023学年高一上学期9月份月考化学试题
3 . 按要求填空。
(1)下列物质中:①稀硫酸②液氯③熔融氯化钠④Fe⑤二氧化碳⑥乙醇⑦BaSO4,属于电解质的是______ (填序号,下同);能直接导电的是______ 。
(2)请写出下列反应的离子方程式。
①盐酸除去铁锈(主要成分为氧化铁)______ 。
②溴水与NaI溶液反应______ 。
③FeCl2溶液与新制氯水反应______ 。
(3)1.204×1024个H2SO4分子的质量为______ g,共含______ 个氢原子。
(4)工业废水中含有有毒的重铬酸根离子( ),必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)还原
),必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)还原 得Cr3+和Fe3+,再通过沉淀处理法来处理该污水。写出该过程中Fe2+还原
得Cr3+和Fe3+,再通过沉淀处理法来处理该污水。写出该过程中Fe2+还原 的离子方程式
的离子方程式______ 。
(1)下列物质中:①稀硫酸②液氯③熔融氯化钠④Fe⑤二氧化碳⑥乙醇⑦BaSO4,属于电解质的是
(2)请写出下列反应的离子方程式。
①盐酸除去铁锈(主要成分为氧化铁)
②溴水与NaI溶液反应
③FeCl2溶液与新制氯水反应
(3)1.204×1024个H2SO4分子的质量为
(4)工业废水中含有有毒的重铬酸根离子(
 ),必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)还原
),必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)还原 得Cr3+和Fe3+,再通过沉淀处理法来处理该污水。写出该过程中Fe2+还原
得Cr3+和Fe3+,再通过沉淀处理法来处理该污水。写出该过程中Fe2+还原 的离子方程式
的离子方程式
您最近一年使用:0次
名校
4 . 现有①KMnO4;②H2;③O2;④Cl2;⑤CO;⑥Al六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲: 中,常用的还原剂放入乙:
中,常用的还原剂放入乙: 中,则:
中,则:
(1)甲中有__________ ;乙中有__________ 。(填序号)
(2)由Fe Fe3O4,Fe2O3
Fe3O4,Fe2O3 Fe可知,欲实现Ⅰ反应过程应从
Fe可知,欲实现Ⅰ反应过程应从__________ (填“甲”或“乙”,下同)中找物质,欲实现Ⅱ反应过程应从__________ 中找物质。
(3)请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并用双线桥法标出电子转移的方向和数目。__________ +__________ =__________ +__________ ,____________________________ 。
 中,常用的还原剂放入乙:
中,常用的还原剂放入乙: 中,则:
中,则:(1)甲中有
(2)由Fe
 Fe3O4,Fe2O3
Fe3O4,Fe2O3 Fe可知,欲实现Ⅰ反应过程应从
Fe可知,欲实现Ⅰ反应过程应从(3)请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并用双线桥法标出电子转移的方向和数目。
您最近一年使用:0次
2020-10-17更新
|
49次组卷
|
2卷引用:湖南省中方县第一中学2020-2021学年高一上学期12月月考化学试题
名校
5 . 饮用水中的NO3−对人类健康会产生危害,为了降低饮用水中NO3−的浓度,可以在碱性条件下用铝粉将NO3−还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素_________ ,还原产物是________ 。
(2)用“双线桥法”表示反应中电子转移的方向和数目:_______________ 。
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移_______ mol电子。
(4)请配平下列离子方程式。
____ Fe2++____ H+ +____ NO3−=____ Fe3+ +____ N2O↑+____ H2O
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
(1)上述反应中,被氧化的元素
(2)用“双线桥法”表示反应中电子转移的方向和数目:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
(3)反应中每生成标况下22.4L N2,转移
(4)请配平下列离子方程式。
您最近一年使用:0次
2018-11-12更新
|
739次组卷
|
6卷引用:湖南省怀化市中方县第二中学2018-2019学年高一上学期期中考试化学试题
6 . 硫及许多化合物有很多重要的应用。
(1)古代四大发明之一的黑火药是由硫磺、木炭粉和__________ 按一定比例混合而成。
(2)黄铁矿的主要成分是FeS2,用于工业制取硫酸。生产硫酸经历三个生产阶段:
①第一阶段将黄铁矿粉末投入沸腾炉里与空气燃烧生成氧化铁等,其反应的化学方程式为__________________ ,氧化产物是_______________ 。
②第二阶段是在氧化炉中将S进行催化氧化。已知6.4g SO2气体完全氧化为SO3气体放出14.8kJ的热量。写出该反应的热化学方程式为________________________ 。工业上采用常压生产,则提高SO3产率的措施还有______________________ (写2种即可)
(3)亚硫酸钠(Na2SO3)可用于生产饮用水作去氯剂,写出去氯(Cl2)的离子方程式:_____________ 。
(4)五水硫代硫酸钠(Na2S2O3·5H2O)是一种重要的化工原料。工业上的一种生产方法是将SO2通入由Na2S与Na2CO3按特定比例配成的混合液中并在合适温度下进行反应,然后经一系列工艺结晶获得。写出SO2通入Na2S与Na2CO3混合液发生反应的化学方程式为_________________________ 。
(1)古代四大发明之一的黑火药是由硫磺、木炭粉和
(2)黄铁矿的主要成分是FeS2,用于工业制取硫酸。生产硫酸经历三个生产阶段:
①第一阶段将黄铁矿粉末投入沸腾炉里与空气燃烧生成氧化铁等,其反应的化学方程式为
②第二阶段是在氧化炉中将S进行催化氧化。已知6.4g SO2气体完全氧化为SO3气体放出14.8kJ的热量。写出该反应的热化学方程式为
(3)亚硫酸钠(Na2SO3)可用于生产饮用水作去氯剂,写出去氯(Cl2)的离子方程式:
(4)五水硫代硫酸钠(Na2S2O3·5H2O)是一种重要的化工原料。工业上的一种生产方法是将SO2通入由Na2S与Na2CO3按特定比例配成的混合液中并在合适温度下进行反应,然后经一系列工艺结晶获得。写出SO2通入Na2S与Na2CO3混合液发生反应的化学方程式为
您最近一年使用:0次



