解题方法
1 . 过氧化氢(H2O2,俗名为双氧水)、过氧化银(Ag2O2)广泛应用于抗菌消毒和化学能源等领域。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为_____ 。
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为_____ 。
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:_____ 。
(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为_____ ,Ag2O2中O的化合价为_____ 。
②写出上述反应的化学方程式:_____ 。


(1)根据下列三个反应回答问题:
反应Ⅰ.Ag2O+H2O2=2Ag+O2↑+H2O
反应Ⅱ.2H2O2=2H2O+O2↑
反应Ⅲ.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
①从氧化还原反应角度分析,反应Ⅰ中H2O2表现的性质为
②上述反应说明H2O2、Ag2O、K2CrO4的氧化性由强到弱的顺序为
③某强酸反应体系中发生一个氧化还原的离子反应,反应物和生成物共六种微粒:O2、Mn
 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2.写出该反应的离子方程式:(2)过氧化银(Ag2O2)为活性物质,可用作新型电池材料。用NaClO-NaOH溶液氧化AgNO3,能制得高纯度的纳米级Ag2O2.
①NaClO中Cl的化合价为
②写出上述反应的化学方程式:
您最近半年使用:0次
2024-03-23更新
|
49次组卷
|
2卷引用:甘肃省白银市靖远县第二中学2023-2024学年高一上学期12月期末化学试题
2 . 对于反应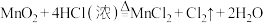
(1)MnO2在反应中电子____________ (填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(2)HCl在反应中____________ 电子(填“得到”或“失去”),所含元素化合价____________ (填“升高”或“降低”),发生____________ 反应(填“氧化”或“还原”)。
(3)配平下列化学方程式:
________ 
________ 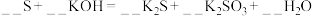
(4)用双线桥表示下列氧化还原反应。
①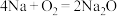
____________
②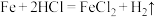
____________
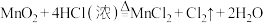
(1)MnO2在反应中电子
(2)HCl在反应中
(3)配平下列化学方程式:

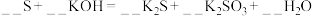
(4)用双线桥表示下列氧化还原反应。
①
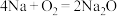
②
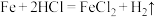
您最近半年使用:0次
3 . H2O2是重要的化学试剂,在实验室和实际生产中应用广泛。
(1)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:______________ 。
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在___________ (填“酸式”或“碱式”)滴定管中,判断到达滴定终点的现象是___________ 。
(2)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:___________ 。
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是___________ 。
③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:
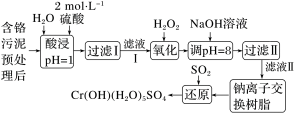
已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为 ,写出此反应的离子方程式:
,写出此反应的离子方程式: ___________ 。
(3)H2O2是一种二元弱酸,写出其第一步电离的方程式:___________ ,它与过量的Ba(OH)2反应的化学方程式为________________ 。
(1)H2O2有一定的还原性,能使酸性KMnO4溶液褪色。
①写出反应的离子方程式:
②实验室常用酸性KMnO4标准液测定溶液中H2O2的浓度,酸性KMnO4溶液应盛放在
(2)①我们知道,稀硫酸不与铜反应,但在稀硫酸中加入H2O2后,则可使铜顺利溶解,写出该反应的离子方程式:
②在“海带提碘”的实验中,利用酸性H2O2得到碘单质的离子方程式是
③利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥Cr(Ⅲ)的处理工艺流程如图:

已知:硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。H2O2的作用是将滤液Ⅰ中的Cr3+转化为
 ,写出此反应的离子方程式:
,写出此反应的离子方程式: (3)H2O2是一种二元弱酸,写出其第一步电离的方程式:
您最近半年使用:0次
名校
4 . 写出下列反应的方程式:
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式___________ 。
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式___________ 。
(3)漂白粉在空气中生效的化学方程式___________ 。
(4)请写出次氯酸光照分解的离子方程式___________ 。
(5) 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式______ 。
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式
(3)漂白粉在空气中生效的化学方程式
(4)请写出次氯酸光照分解的离子方程式
(5)
 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式
您最近半年使用:0次
5 . 化学源于生活,下列物质为生活中常见的日用品,括号内为对应物品的主要成分或有效成分。
①食盐(NaCl) ②食醋( ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是________ (填序号)。
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用________ (填序号)来鉴别,若白色固体是结晶苏打,观察到的现象是________ 。
(3)酸性 和
和 会发生如下反应:
会发生如下反应:______
________ ________
________ ________
________ ________
________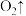 (配平上述方程式)。
(配平上述方程式)。
(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:________ 。
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:________ 。
①食盐(NaCl) ②食醋(
 ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用
(3)酸性
 和
和 会发生如下反应:
会发生如下反应:________
 ________
________ ________
________ ________
________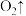 (配平上述方程式)。
(配平上述方程式)。(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:
您最近半年使用:0次
名校
6 . I.过氧化氢H2O2俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_______ (填字母代号)。
(2)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是_______ 。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。已知该反应H2O2只发生如下过程:H2O2→O2。写出该氧化还原反应的离子方程式:_______ 。
II.在H2O2的参与下,S2O (硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。
(硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。
(4)若S2O 与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:_______ 。
_______Fe2++_______S2O +_______H2O2+_______OH-=_______Fe2O3+_______S2O
+_______H2O2+_______OH-=_______Fe2O3+_______S2O +_______H2O
+_______H2O
(5)下列关于该反应的说法中正确的是_______ (填序号)。
(6)每生成16gFe2O3纳米颗粒转移电子的物质的量为_______ mol。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是
(2)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。已知该反应H2O2只发生如下过程:H2O2→O2。写出该氧化还原反应的离子方程式:
II.在H2O2的参与下,S2O
 (硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。
(硫代硫酸根)可以与Fe2+反应制备Fe2O3纳米颗粒。(4)若S2O
 与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:
与Fe2+的物质的量之比为1∶2,配平该反应的离子方程式:_______Fe2++_______S2O
 +_______H2O2+_______OH-=_______Fe2O3+_______S2O
+_______H2O2+_______OH-=_______Fe2O3+_______S2O +_______H2O
+_______H2O(5)下列关于该反应的说法中正确的是
A.该反应中的还原剂只有S2O |
| B.已知生成的Fe2O3纳米颗粒直径为10纳米,则Fe2O3纳米颗粒为胶体 |
| C.该反应中H2O2只作氧化剂 |
| D.该反应需要在碱性条件下进行 |
您最近半年使用:0次
解题方法
7 .  在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。
(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:___________ 。
___________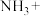 ___________
___________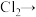 ___________
___________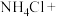 ___________
___________
(2)上述反应中的氧化产物为___________ (填化学式),氧化剂与还原剂的物质的量之比为___________ 。
(3)当生成1mol氮气时,被氧化的物质的质量为___________ ,反应中转移电子数为___________  。
。
(4)下列说法中正确的是___________(填字母)。
(5)已知:CuO能够和 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:___________ 。
 在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:
___________
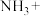 ___________
___________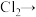 ___________
___________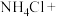 ___________
___________
(2)上述反应中的氧化产物为
(3)当生成1mol氮气时,被氧化的物质的质量为
 。
。(4)下列说法中正确的是___________(填字母)。
| A.上述反应中能观察到有白烟产生 |
| B.上述反应中生成的气体有刺激性气味 |
C. 不含金属阳离子,不属于盐类 不含金属阳离子,不属于盐类 |
| D.可用浓氨水来检验氯气管道是否泄漏 |
 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:
您最近半年使用:0次
名校
解题方法
8 . 回答下列问题:
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目_______ 。
(2)请将上述反应改写成离子方程式________ 。
(3)浓盐酸在反应中体现出来的性质有______ (填序号)。
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为______ g。
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是______ 。(填化学式)
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O。
、Cl-、H2O。
①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:________ 。
②每生成1个FeO 转移
转移______ 个电子。
I.KClO3和浓盐酸在一定温度下反应会生成黄绿色的有毒气体氯气。其变化可表示为:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。
(1)请用“双线桥”表示上述反应电子转移的方向和数目
(2)请将上述反应改写成离子方程式
(3)浓盐酸在反应中体现出来的性质有
①还原性 ②酸性 ③氧化性 ④碱性
(4)若反应生成21.3g氯气,则消耗还原剂的质量为
II.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(5)干法制备高铁酸钠的主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应中还原剂是
(6)湿法制备高铁酸钾(K2FeO4)是在碱性环境中进行,反应体系中有六种反应微粒:Fe(OH)3、ClO-、OH-、FeO
 、Cl-、H2O。
、Cl-、H2O。①请依据上述信息,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1个FeO
 转移
转移
您最近半年使用:0次
名校
解题方法
9 . 亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: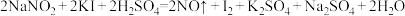
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:______

(2)从物质分类角度来看, 是
是___________ (填字母代号)。
a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理 并不是最佳方法,其原因是
并不是最佳方法,其原因是___________ 。从环保角度来讲,要将 转化为氮气,所用物质的
转化为氮气,所用物质的___________ (填“氧化性”或“还原性”)应该比KI更___________ (填“强”或“弱”)。
(4)下列方法不能用来区分固体 和NaCl的是
和NaCl的是___________ (填序号)。
A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。
(6)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式:___________ ,产生氮气分子和转移电子数目比为:___________ 。
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生 、
、 和
和 ,其水溶液呈碱性。由于
,其水溶液呈碱性。由于 有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下: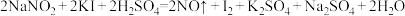
(1)在下面方框中写出氧化剂和还原剂的化学式及其系数,并用单线桥法标出电子转移的方向和数目:

(2)从物质分类角度来看,
 是
是a.酸 b.盐 c.碱 d.非电解质 e.电解质
(3)用上述反应来处理
 并不是最佳方法,其原因是
并不是最佳方法,其原因是 转化为氮气,所用物质的
转化为氮气,所用物质的(4)下列方法不能用来区分固体
 和NaCl的是
和NaCl的是A.分别溶于水,并滴加几滴酚酞溶液
B.分别加强热并收集气体检验
C.用筷子分别蘸取固体品尝味道
(5)误食
 会导致人体血红蛋白中的
会导致人体血红蛋白中的 转化为
转化为 而中毒,该过程中
而中毒,该过程中 表现出的性质与下列___________(填序号)反应中
表现出的性质与下列___________(填序号)反应中 表现出的性质相同。
表现出的性质相同。A. |
B. |
C. |
D.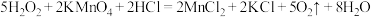 |
您最近半年使用:0次
名校
10 . 根据所学知识,回答下列问题:
(1)现有下列物质:①熔融的 ②液态
②液态 ③蔗糖 ④银 ⑤
③蔗糖 ④银 ⑤ 溶液 ⑥稀硫酸 ⑦
溶液 ⑥稀硫酸 ⑦ ⑧
⑧ 晶体
晶体
其中属于电解质的是___________ ;属于非电解质的是___________ ;能导电的有___________ ;
(2)按要求填空。
① 溶液(写出电离方程式)
溶液(写出电离方程式)___________ 。
②纯碱和澄清石灰水反应(写出离子方程式)___________ 。
(3)配平下列氧化还原方程式:
①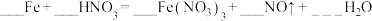
________ ;
②
________ 。
(1)现有下列物质:①熔融的
 ②液态
②液态 ③蔗糖 ④银 ⑤
③蔗糖 ④银 ⑤ 溶液 ⑥稀硫酸 ⑦
溶液 ⑥稀硫酸 ⑦ ⑧
⑧ 晶体
晶体其中属于电解质的是
(2)按要求填空。
①
 溶液(写出电离方程式)
溶液(写出电离方程式)②纯碱和澄清石灰水反应(写出离子方程式)
(3)配平下列氧化还原方程式:
①
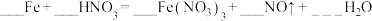
②

您最近半年使用:0次



