名校
1 . 人类农业生产离不开氮肥,科学合理使用氰肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:
(1)某小组在实验室模拟以 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。
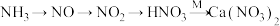
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式___________ 。
②写出实验室用NH4Cl和消石灰共热制备氨气的化学反应方程式_________________ 。
③写出NH3发生催化氧化反应生成NO的化学方程式____________________________ 。
向装置中通入4molNH3和2molO2,转移的电子数___________ (大于/小于/等于)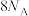 。
。
④工业上为了提高NO的转化率,可以适当增加O2的量,理论上在一定的温度和压强下将2LNO完全转化成HNO3,至少应该通入空气的体积为___________ 。
⑤将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M___________ (写化学式)。
(2)下列关于氮肥的使用说法正确的是___________。
(1)某小组在实验室模拟以
 为原料,制备少量硝态氮肥
为原料,制备少量硝态氮肥 ,转化途径如下(转化所需试剂及条件已略去)。
,转化途径如下(转化所需试剂及条件已略去)。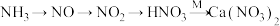
①工业合成氨是制取氮肥的基础。写出工业合成氨的化学反应方程式
②写出实验室用NH4Cl和消石灰共热制备氨气的化学反应方程式
③写出NH3发生催化氧化反应生成NO的化学方程式
向装置中通入4molNH3和2molO2,转移的电子数
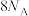 。
。④工业上为了提高NO的转化率,可以适当增加O2的量,理论上在一定的温度和压强下将2LNO完全转化成HNO3,至少应该通入空气的体积为
⑤将HNO3转化为Ca(NO3)2,列举两种不同类别的化合物M
(2)下列关于氮肥的使用说法正确的是___________。
| A.硝酸铵是一种常用的氮肥,在贮存和使用该化肥时不能剧烈撞击 |
| B.过度使用氮肥不会引起土壤和水体污染 |
| C.铵态氮肥和草木灰混合使用可以增强肥效 |
| D.铵态氮肥易与空气反应,因此需要深埋土壤中施用 |
您最近半年使用:0次
解题方法
2 . 回答下列问题
(1)化学与日常生活、医药、环保等密不可分.
医药行业的毒胶囊事件曾被央视《每周质量报告》曝光。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
①胶体中的分散质直径范围是______ nm。
②元素铬(Cr)的几种化合物存在转化关系:Cr2O3固体 KCrO2溶液(绿色)
KCrO2溶液(绿色)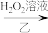 K2CrO4溶液(黄色)
K2CrO4溶液(黄色)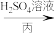 K2Cr2O7溶液(橙红色),从物质分类角度K2CrO4属于
K2Cr2O7溶液(橙红色),从物质分类角度K2CrO4属于______ (“氧化物”、“钾盐”、“碱”);甲、乙、丙中属于复分解反应的步骤是______ 。
③请配平下列离子方程式:____ 。
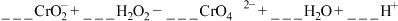
该反应中,H2O2作______ (填“氧化剂”或“还原剂”).
(2)在明代宋应星所著的《天工开物》中,有关于火法炼锌的工艺记载:“每炉甘石(主要成分为熔化成团,冷定毁知取出。……即倭铅也。”
①请完成上述火法炼锌反应的化学方程式并配平:____ 。
ZnCO3+2C ______+CO↑
______+CO↑
在该反应中,氧化产物是______ (填化学式)。
②利用生成的锌粒,加入稀硫酸会发生以下反应:Zn+H2SO4=ZnSO4+H2↑,请用“单线桥法”标出电子转移情况:____________ 。
(1)化学与日常生活、医药、环保等密不可分.
医药行业的毒胶囊事件曾被央视《每周质量报告》曝光。由工业明胶制成的胶囊往往含有超标的重金属铬,从而对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
①胶体中的分散质直径范围是
②元素铬(Cr)的几种化合物存在转化关系:Cr2O3固体
 KCrO2溶液(绿色)
KCrO2溶液(绿色)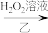 K2CrO4溶液(黄色)
K2CrO4溶液(黄色)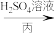 K2Cr2O7溶液(橙红色),从物质分类角度K2CrO4属于
K2Cr2O7溶液(橙红色),从物质分类角度K2CrO4属于③请配平下列离子方程式:
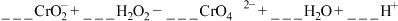
该反应中,H2O2作
(2)在明代宋应星所著的《天工开物》中,有关于火法炼锌的工艺记载:“每炉甘石(主要成分为熔化成团,冷定毁知取出。……即倭铅也。”
①请完成上述火法炼锌反应的化学方程式并配平:
ZnCO3+2C
 ______+CO↑
______+CO↑在该反应中,氧化产物是
②利用生成的锌粒,加入稀硫酸会发生以下反应:Zn+H2SO4=ZnSO4+H2↑,请用“单线桥法”标出电子转移情况:
您最近半年使用:0次
3 . KMnO4具有强氧化性,实验室可用其与浓盐酸反应制备氯气。
(1)配平下列有关反应的化学方程式____ ,___KMnO4+___HCl(浓)= __MnCl2 +__ KCl+___Cl2↑+__H2O。
(2)反应中,氧化剂是________ (填化学式,下同),氧化产物是________ 。元素化合价升高的元素是________ ,氧化剂与还原剂的个数之比为_______ 。
(3)盐酸在上述反应中体现出的性质有_______ (填序号)
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:_______ 。
(1)配平下列有关反应的化学方程式
(2)反应中,氧化剂是
(3)盐酸在上述反应中体现出的性质有
①氧化性 ②还原性 ③碱性 ④酸性
(4)湿法制备高铁酸钾( K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、
 、Cl-、H2O,写出该反应的离子方程式:
、Cl-、H2O,写出该反应的离子方程式:
您最近半年使用:0次
名校
解题方法
4 . 氧化还原反应是一类非常重要的反应。回答下列问题:
(1)将铁丝伸入CuSO4溶液中,发生反应的离子方程式为_______ 。
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在,其中Fe2+易被人体吸收。服用维生素C可使Fe3+转化成Fe2+而有利于人体吸收,说明维生素C具有_______ (填“氧化性”或“还原性”)。
(3)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为_______ 。
(4)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
①_______ 元素被氧化,发生氧化反应的物质是_______ 。
②请写出该反应的离子方程式_______ 。
(5)高铁酸钾(K2FeO4)是一种新型、高效的净水剂,具有很强的氧化性,与盐酸混合会生成Cl2,本身被还原为Fe3+,请写出该反应的离子方程式_______ 。
(1)将铁丝伸入CuSO4溶液中,发生反应的离子方程式为
(2)人体内的铁元素是以Fe2+和Fe3+的形式存在,其中Fe2+易被人体吸收。服用维生素C可使Fe3+转化成Fe2+而有利于人体吸收,说明维生素C具有
(3)市场上出售的某种麦片中含有微量还原性铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化成亚铁盐。此反应的化学方程式为
(4)实验室制取Cl2的化学方程式为:MnO2+4HCl(浓)
 MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:
MnCl2+Cl2↑+2H2O,请根据上述方程式回答下列问题:①
②请写出该反应的离子方程式
(5)高铁酸钾(K2FeO4)是一种新型、高效的净水剂,具有很强的氧化性,与盐酸混合会生成Cl2,本身被还原为Fe3+,请写出该反应的离子方程式
您最近半年使用:0次
名校
解题方法
5 . 按要求填空:
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有_______ (填编号,下同),属于非电解质的 有_______ ,能导电的有_______ 。
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是_______ (用化学式表示,下同) ,_______ 元素被氧化,还原产物与氧化产物之比为_______ 。
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为
您最近半年使用:0次
名校
解题方法
6 . 高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。

【资料】向胶体中加入电解质后,胶体因失去稳定性使分散质粒子聚集而产生沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
(1)K2FeO4中铁元素的化合价为___________ 。
(2)过程①中活性菌表现了___________ (填“氧化”或“还原”)性,该过程的还原产物是___________ (填离子符号);过程③属于___________ (填“物理”或“化学”)变化。
(3)根据上述原理,K2FeO4作水处理剂时,其主要作用有___________ (填两个)。
(4)可用次氯酸钾在碱性条件下与氢氧化铁反应得到K2FeO4,写出制备K2FeO4的离子方程式___________ ;由此可知,在碱性条件下 的氧化性
的氧化性___________ (填“>”、“=”或“<”) 。
。

【资料】向胶体中加入电解质后,胶体因失去稳定性使分散质粒子聚集而产生沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
(1)K2FeO4中铁元素的化合价为
(2)过程①中活性菌表现了
(3)根据上述原理,K2FeO4作水处理剂时,其主要作用有
(4)可用次氯酸钾在碱性条件下与氢氧化铁反应得到K2FeO4,写出制备K2FeO4的离子方程式
 的氧化性
的氧化性 。
。
您最近半年使用:0次
名校
7 . 高铁酸钾 是良好的水处理剂,其作用原理如图所示。请回答下列问题:
是良好的水处理剂,其作用原理如图所示。请回答下列问题:
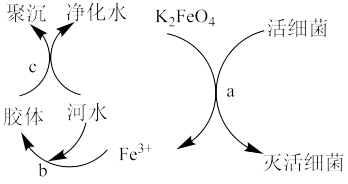
(1)高铁酸钾中铁元素的化合价为_______________ 。
(2)过程 中
中 体现
体现_______________ (填“氧化”或“还原”)性,氧化产物是_______________ ;反应过程中转移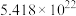 电子,需要
电子,需要_______________ 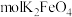 。
。
(3)过程 属于
属于_______________ (填“物理”或“化学”)变化。
(4)根据以上 处理水的原理,相比于
处理水的原理,相比于 ,其优点是
,其优点是_______________ 。
(5)湿法制备高铁酸钾的反应体系中有六种微粒: ,写出并配平湿法制备高铁酸钾的离子方程式并用单线桥表示出电子转移的方向和数目:
,写出并配平湿法制备高铁酸钾的离子方程式并用单线桥表示出电子转移的方向和数目:_______________ 。
 是良好的水处理剂,其作用原理如图所示。请回答下列问题:
是良好的水处理剂,其作用原理如图所示。请回答下列问题:
(1)高铁酸钾中铁元素的化合价为
(2)过程
 中
中 体现
体现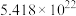 电子,需要
电子,需要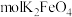 。
。(3)过程
 属于
属于(4)根据以上
 处理水的原理,相比于
处理水的原理,相比于 ,其优点是
,其优点是(5)湿法制备高铁酸钾的反应体系中有六种微粒:
 ,写出并配平湿法制备高铁酸钾的离子方程式并用单线桥表示出电子转移的方向和数目:
,写出并配平湿法制备高铁酸钾的离子方程式并用单线桥表示出电子转移的方向和数目:
您最近半年使用:0次
名校
解题方法
8 . 氧化还原反应在生产生活中有着重要作用,回答下列有关问题:
(1)某同学设计如下实验研究 的性质,已知淀粉遇碘会变蓝,能证明
的性质,已知淀粉遇碘会变蓝,能证明 具有还原性的实验是
具有还原性的实验是_______________ 。(填序号)。
(2)某届奥运会期间,由于工作人员将84消毒液(有效成分 )与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
_______________  (填“>”或“<”);当参加反应的
(填“>”或“<”);当参加反应的 和
和 的个数比为
的个数比为 时,该反应的还原产物为
时,该反应的还原产物为_______________ (填字母序号)。
aA. B.
B. C.
C. D.
D. E.
E. F.
F.
(3)2023年10月26日神舟十七号载人飞船发射成功。某种飞船以联氨 和
和 为动力源,发生反应:
为动力源,发生反应: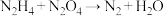 ,反应温度可高达
,反应温度可高达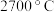 。
。
①配平该方程式_____________ 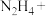 ________
________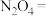 _________
_________ _________
_________ 。
。
②该反应中,氧化产物与还原产物的物质的量之比为_______________ 。
(4)补全并配平下列方程式____________
_______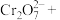 _________
_________ __________
__________ _____________
_____________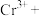
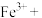 ________
________
(5)试分析: 反应中,被
反应中,被 氧化的
氧化的 的物质的量为
的物质的量为_______________  。
。
(1)某同学设计如下实验研究
 的性质,已知淀粉遇碘会变蓝,能证明
的性质,已知淀粉遇碘会变蓝,能证明 具有还原性的实验是
具有还原性的实验是| 序号 | 实验操作 | 实验现象 | ||
| ① | 向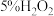 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 |
| ||
| ② | 向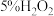 溶液中滴加淀粉碘化钾溶液 溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 )与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是
)与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:
促进藻类快速生长。该反应说明氧化性:
 (填“>”或“<”);当参加反应的
(填“>”或“<”);当参加反应的 和
和 的个数比为
的个数比为 时,该反应的还原产物为
时,该反应的还原产物为aA.
 B.
B. C.
C. D.
D. E.
E. F.
F.
(3)2023年10月26日神舟十七号载人飞船发射成功。某种飞船以联氨
 和
和 为动力源,发生反应:
为动力源,发生反应: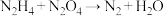 ,反应温度可高达
,反应温度可高达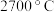 。
。①配平该方程式
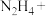 ________
________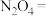 _________
_________ _________
_________ 。
。②该反应中,氧化产物与还原产物的物质的量之比为
(4)补全并配平下列方程式
_______
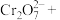 _________
_________ __________
__________ _____________
_____________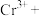
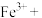 ________
________(5)试分析:
 反应中,被
反应中,被 氧化的
氧化的 的物质的量为
的物质的量为 。
。
您最近半年使用:0次
9 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)中国古代著作中有“银针验毒”的记录,其原理为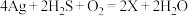 。
。
①X是______ (填化学式)。
②其中H2S在该反应中______ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
③用单线桥 标出上述方程式的电子转移方向和数目______ 。
(2)按如图所示操作,充分反应后:
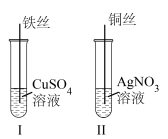
观察到I中铁丝上有红色固体物质产生,Ⅱ中铜丝上有银白色固体物质产生。结合I、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________ 。如果将铁丝放在硝酸银溶液中,能否发生反应___________ (填“能”或者“不能”)。
(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:

①补全并配平上述方程式:___________ 。
②当有15.8gKMnO4参与反应时,生成的氧化产物的质量为___________ 。
(1)中国古代著作中有“银针验毒”的记录,其原理为
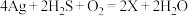 。
。①X是
②其中H2S在该反应中
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
③用
(2)按如图所示操作,充分反应后:

观察到I中铁丝上有红色固体物质产生,Ⅱ中铜丝上有银白色固体物质产生。结合I、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:

①补全并配平上述方程式:
②当有15.8gKMnO4参与反应时,生成的氧化产物的质量为
您最近半年使用:0次
名校
10 . 由我国自主研发的“奋斗者号”潜水艇在太平洋马里亚纳海沟成功坐底,创造了中国载人深潜的新纪录。
(1)过氧化钠可用作潜水艇的供氧剂,Na2O2中阳离子与阴离子的个数之比为___________ ;写出Na2O2和CO2反应的化学方程式:___________ ,该反应中生成一个O2时,转移的___________ 个电子。
(2)将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有___________ (填离子符号)。
(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。_______
___________MnO +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________
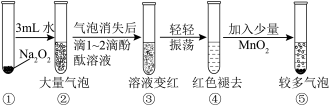
(4)某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法正确的是___________。
(5)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应: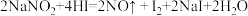 ,上述反应中氧化剂是
,上述反应中氧化剂是___________ ,氧化产物是___________ ,HI在反应中体现了___________ 性。
②根据上述反应鉴别NaNO2和NaCl。可选用的物质有___________ (填序号)。
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
(1)过氧化钠可用作潜水艇的供氧剂,Na2O2中阳离子与阴离子的个数之比为
(2)将一定量的Na2O2固体投入到含有下列离子的溶液中:Cl-、HCO
 、CO
、CO 、Na+,反应完毕后,溶液中上述离子数目几乎不变的有
、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(3)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:补全方程式并配平。
___________MnO
 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________(4)某实验小组通过如图所示实验,探究Na2O2与水的反应,下列说法正确的是___________。

| A.②中的大量气泡主要成分是氢气 |
| B.③中溶液变红,说明有酸性物质生成 |
| C.④中现象可能是由于溶液中含有强氧化性物质造成的 |
| D.⑤中MnO2的主要作用是验证溶液中存在过氧化氢 |
(5)查阅资料知:Na2O2在一定条件下可以转化为NaNO2,NaNO2易溶于水且溶解时吸热,有咸味,遇酸易放出气体,人误食会中毒。
请回答下列问题:
①已知NaNO2能发生如下反应:
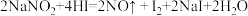 ,上述反应中氧化剂是
,上述反应中氧化剂是②根据上述反应鉴别NaNO2和NaCl。可选用的物质有
A.水 B.碘化钾淀粉试纸 C.淀粉 D.白酒 E.食用白醋
您最近半年使用:0次



