名校
1 .  可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。
回答下列问题:
(1) 的价层电子排布图
的价层电子排布图_______ ,“酸浸”过程中,滤渣1的主要成分为S、_______ (填化学式)。
(2)“酸浸”过程中 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。_______ 。
②80~100min时, 浓度上升的原因可能是
浓度上升的原因可能是_______ 。
(3)“沉铁”过程中依次加入的试剂X、Y为_______ (填字母)。
A.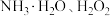 B.
B. C.
C.
(4)“滤液”萃取前调 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,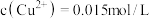 多次萃取后水相中
多次萃取后水相中 为
为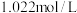 ,则铜的萃取率为
,则铜的萃取率为_______ (结果保留小数点后一位,溶液体积变化忽略不计)。
(5)利用 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:_______ 。
(6)结合图像分析,若要获得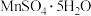 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热_______ 得到_______ ℃饱和溶液,_______ ,过滤酒精洗涤,低温干燥。
 可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分
可用于电子工业生产软磁铁氧体,工业上常以电解金属锰阳极渣(主要成分 ,杂质为
,杂质为 )和黄铁矿
)和黄铁矿 为原料制备
为原料制备 其流程如图。
其流程如图。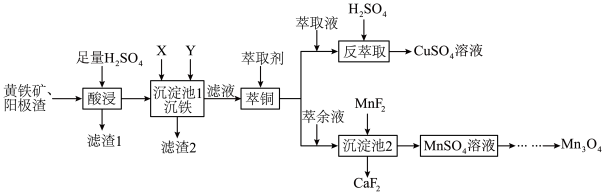
 |  |  |  | |
| 完全沉淀时的pH | 3.7 | 9.7 | 7.4 | 9.8 |
(1)
 的价层电子排布图
的价层电子排布图(2)“酸浸”过程中
 、
、 的质量浓度、Mn的浸出率与时间的关系如图所示。
的质量浓度、Mn的浸出率与时间的关系如图所示。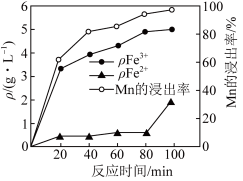
②80~100min时,
 浓度上升的原因可能是
浓度上升的原因可能是(3)“沉铁”过程中依次加入的试剂X、Y为
A.
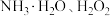 B.
B. C.
C.
(4)“滤液”萃取前调
 ,若有机萃取剂用表HR示,则发生萃取的反应可表示为
,若有机萃取剂用表HR示,则发生萃取的反应可表示为 。若,
。若,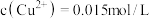 多次萃取后水相中
多次萃取后水相中 为
为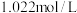 ,则铜的萃取率为
,则铜的萃取率为(5)利用
 溶液,用空气氧化法制备
溶液,用空气氧化法制备 。在
。在 溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备
溶液中滴入一定浓度的氨水,加压通氧气反应7小时制备 。写出上述反应的离子方程式:
。写出上述反应的离子方程式:(6)结合图像分析,若要获得
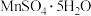 晶体的系列操作步骤为加热
晶体的系列操作步骤为加热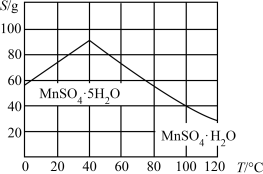
您最近半年使用:0次
名校
解题方法
2 . 以 为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废
为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废 催化剂(主要含有Pd、
催化剂(主要含有Pd、 ,还有少量PdO、
,还有少量PdO、 、C)为原料制备氯化钯的流程如下:
、C)为原料制备氯化钯的流程如下:
(1)“氯化浸出”前必须“焙烧”去除废催化剂表面积碳,原因是_______ ,焙烧时间过长,“氯化浸出”率下降,可能的原因是_______ 。
(2) 中Cl原子的杂化类型是
中Cl原子的杂化类型是_______ ,“氯化浸出”时,若盐酸浓度过高,可能发生的副反应离子方程式为_______ 。
(3)滤渣1主要成分为_______ ,已知 ,若要使溶液中
,若要使溶液中 不高于
不高于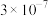 ,则应加入氨水使pH不低于
,则应加入氨水使pH不低于_______ 。
(4)工业上也可用 还原
还原 制取海绵Pd,该历程对环境友好。该反应的化学方程式为
制取海绵Pd,该历程对环境友好。该反应的化学方程式为_______ 。
(5)工业上测定Pd含量的原理为:试样用硝酸及盐酸溶解后,加过量EDTA络合钯,用锌标准溶液滴定过剩的EDTA.具体步聚如下:
I.标定锌标准溶液对钯的滴定度:
a.吸取25mLEDTA溶液置于烧杯中,滴加4~5滴盐酸,加适量水,用锌标准溶液滴定至终点,消耗锌标准溶液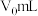 。
。
b.吸取15mL含0.0010gPd的Pd标准溶液于烧杯中,加入25mLEDTA溶液,加适量水用锌标准溶液滴定至试液由黄色变成紫红色为终点,消耗锌标准溶液 。
。
Ⅱ.滴定式样:
称取0.1000g试样置于烧杯中,加适量硝酸及盐酸充分溶解并作妥善处理,加入25mLEDT溶液,用锌标准溶液滴定至终点,消耗锌标准溶液VmL。则试样中Pd的质量分数为_______ %(用含V、 、
、 的式子表示)。
的式子表示)。
 为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废
为载体的钯催化剂常用于石化行业加氢催化裂化过程中,工业上以失活后的废 催化剂(主要含有Pd、
催化剂(主要含有Pd、 ,还有少量PdO、
,还有少量PdO、 、C)为原料制备氯化钯的流程如下:
、C)为原料制备氯化钯的流程如下: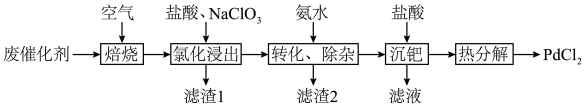
(1)“氯化浸出”前必须“焙烧”去除废催化剂表面积碳,原因是
(2)
 中Cl原子的杂化类型是
中Cl原子的杂化类型是(3)滤渣1主要成分为
 ,若要使溶液中
,若要使溶液中 不高于
不高于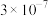 ,则应加入氨水使pH不低于
,则应加入氨水使pH不低于(4)工业上也可用
 还原
还原 制取海绵Pd,该历程对环境友好。该反应的化学方程式为
制取海绵Pd,该历程对环境友好。该反应的化学方程式为(5)工业上测定Pd含量的原理为:试样用硝酸及盐酸溶解后,加过量EDTA络合钯,用锌标准溶液滴定过剩的EDTA.具体步聚如下:
I.标定锌标准溶液对钯的滴定度:
a.吸取25mLEDTA溶液置于烧杯中,滴加4~5滴盐酸,加适量水,用锌标准溶液滴定至终点,消耗锌标准溶液
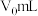 。
。b.吸取15mL含0.0010gPd的Pd标准溶液于烧杯中,加入25mLEDTA溶液,加适量水用锌标准溶液滴定至试液由黄色变成紫红色为终点,消耗锌标准溶液
 。
。Ⅱ.滴定式样:
称取0.1000g试样置于烧杯中,加适量硝酸及盐酸充分溶解并作妥善处理,加入25mLEDT溶液,用锌标准溶液滴定至终点,消耗锌标准溶液VmL。则试样中Pd的质量分数为
 、
、 的式子表示)。
的式子表示)。
您最近半年使用:0次
名校
3 . 过硫酸钠(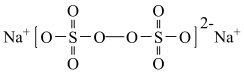 ),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对
),易溶于水,加热至65℃分解。作为强氧化剂,广泛应用于蓄电池工业、造纸工业、食品工业等。某化学小组对 制备和性质及用途进行探究。
制备和性质及用途进行探究。

工业制备过硫酸钠的反应原理:
主反应:

副反应:

实验室设计如图实验装置:
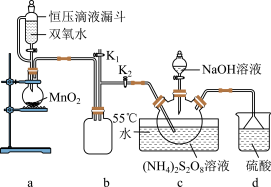
(2)装置b的作用是
(3)上述反应过程中,d装置中主要发生的化学反应方程式为
Ⅱ.探究
 的性质与用途
的性质与用途(4)
 用于废水中苯酚的降解
用于废水中苯酚的降解已知:a.
 具有强氧化性,
具有强氧化性, 浓度较高时会导致
浓度较高时会导致 淬灭。
淬灭。b.
 可将苯酚氧化,但反应速率较慢,加入
可将苯酚氧化,但反应速率较慢,加入 可加快反应。
可加快反应。过程为ⅰ.

ⅱ.
 将苯酚氧化为
将苯酚氧化为 气体
气体①
 氧化苯酚的离子方程式是
氧化苯酚的离子方程式是②将含
 的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。
的溶液稀释后加入苯酚的废水处理器中,调节溶液总体积为1L,pH=1,测得在相同时间内,不同条件下苯酚的降解率如图甲。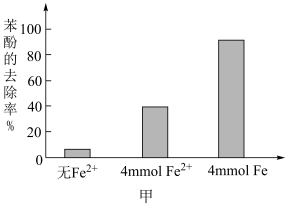
 ,可明显提高苯酚的降解率,主要原因是
,可明显提高苯酚的降解率,主要原因是(5)工业上利用
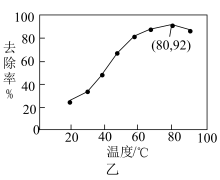
 能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含
能有效处理燃煤锅炉烟气中的NO气体。一定条件下,将含一定浓度NO的烟气以一定的速率通过含 的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为
的处理液中,NO去除率随温度变化的关系如图乙所示,80℃时,NO去除率为92%。若NO初始浓度为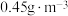 ,
, 达到最大去除率,NO去除的平均反应速率:
达到最大去除率,NO去除的平均反应速率: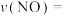
 。
。
您最近半年使用:0次
名校
4 . NCl3是一种黄色油状液体,熔点﹣40℃,沸点71℃,常温下密度为1.65g•mL﹣1.95℃以上爆炸,弱酸性环境稳定,中性水中易发生水解。常用于面粉的漂白和杀菌。实验室可用Cl2和NH4Cl 溶液在常温下反应制取,所用装置如图:
(1)仪器a的名称为___________ ;实验室利用装置A还可以制备下列哪些物质 ___________ (填字母)。
a.乙炔 b.硝基苯 c.溴苯 d.乙酸乙酯
(2)打开活塞K1,将浓盐酸滴入圆底烧瓶中,仪器a中制备NCl3的化学反应方程式为___________ ,待反应至仪器a中有大量油状液体生成,关闭活塞K1。将产物分离并用无水MgSO4干燥后,利用B、C装置将NCl3提纯,提纯过程中水浴温度应控制在 ___________ 。
(3)将提纯后的NCl3滴入含有紫色石蕊试剂的水中,溶液先变蓝后褪色,产生该现象的原因是___________ (使用化学用语结合文字解释)。
(4)液氯储罐中常混有NCl3.为测定氯气中的NCl3含量,将一定量样品先通入足量含有氧化汞的浓盐酸溶液中(反应为:NCl3+4HCl=NH4Cl+3Cl2),产生的气体通过饱和食盐水后再用足量NaOH溶液吸收,测得吸收后NaOH溶液增重35.125g。经测定NCl3吸收管内 质量为0.180g。该样品中NCl3的质量分数为
质量为0.180g。该样品中NCl3的质量分数为 ___________ %(保留三位有效数字);若产生的气体未通过饱和食盐水,则测定结果 ___________ (填“偏高”、“偏低”或“无影响”)。
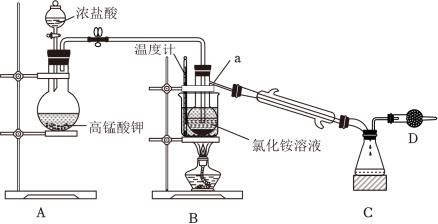
(1)仪器a的名称为
a.乙炔 b.硝基苯 c.溴苯 d.乙酸乙酯
(2)打开活塞K1,将浓盐酸滴入圆底烧瓶中,仪器a中制备NCl3的化学反应方程式为
(3)将提纯后的NCl3滴入含有紫色石蕊试剂的水中,溶液先变蓝后褪色,产生该现象的原因是
(4)液氯储罐中常混有NCl3.为测定氯气中的NCl3含量,将一定量样品先通入足量含有氧化汞的浓盐酸溶液中(反应为:NCl3+4HCl=NH4Cl+3Cl2),产生的气体通过饱和食盐水后再用足量NaOH溶液吸收,测得吸收后NaOH溶液增重35.125g。经测定NCl3吸收管内
 质量为0.180g。该样品中NCl3的质量分数为
质量为0.180g。该样品中NCl3的质量分数为
您最近半年使用:0次
名校
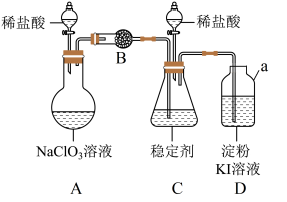
5 . 二氧化氯是一种生活中常用的消毒剂。实验室通过如下装置制备、研究二氧化氯。___________ 。
(2)常温下,装置A中生成两种气体产物,其一是 ,则装置A中发生反应的化学方程式为
,则装置A中发生反应的化学方程式为___________ 。
(3)为使 在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜
在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜___________ (填“较快”或“较慢”)。
(4) 在装置C中被完全吸收生成
在装置C中被完全吸收生成 ,此时装置D中溶液的颜色不变,则装置B的作用是
,此时装置D中溶液的颜色不变,则装置B的作用是___________ 。
(5)已知在酸性条件下 可发生反应生成
可发生反应生成 并释放出
并释放出 (不考虑其他副反应),
(不考虑其他副反应), 在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是
在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是___________ 。
(6)取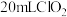 消毒过的自来水(密度为
消毒过的自来水(密度为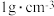 ,加稀硫酸酸化,加入
,加稀硫酸酸化,加入 过量
过量 溶液充分反应,再加2滴淀粉溶液,用
溶液充分反应,再加2滴淀粉溶液,用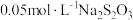 标准溶液滴定碘单质,达到滴定终点时消耗
标准溶液滴定碘单质,达到滴定终点时消耗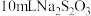 标准溶液(已知:
标准溶液(已知: )。
)。
①)该过程中 与
与 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
②达到滴定终点时现象是___________ ,原自来水中 的质量分数为
的质量分数为___________ 。
(2)常温下,装置A中生成两种气体产物,其一是
 ,则装置A中发生反应的化学方程式为
,则装置A中发生反应的化学方程式为(3)为使
 在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜
在装置C中被稳定剂充分吸收,装置A中滴加稀盐酸的速度宜(4)
 在装置C中被完全吸收生成
在装置C中被完全吸收生成 ,此时装置D中溶液的颜色不变,则装置B的作用是
,此时装置D中溶液的颜色不变,则装置B的作用是(5)已知在酸性条件下
 可发生反应生成
可发生反应生成 并释放出
并释放出 (不考虑其他副反应),
(不考虑其他副反应), 在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是
在装置C中完全吸收后,打开装置C中分液漏斗活塞,装置C中发生反应,则此时装置D的作用是(6)取
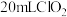 消毒过的自来水(密度为
消毒过的自来水(密度为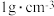 ,加稀硫酸酸化,加入
,加稀硫酸酸化,加入 过量
过量 溶液充分反应,再加2滴淀粉溶液,用
溶液充分反应,再加2滴淀粉溶液,用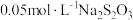 标准溶液滴定碘单质,达到滴定终点时消耗
标准溶液滴定碘单质,达到滴定终点时消耗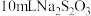 标准溶液(已知:
标准溶液(已知: )。
)。①)该过程中
 与
与 发生反应的离子方程式为
发生反应的离子方程式为②达到滴定终点时现象是
 的质量分数为
的质量分数为
您最近半年使用:0次
名校
6 . 普鲁士蓝可用于氨氮废水的处理,利用柠檬酸铁铵和赤血盐可制备得到普鲁士蓝。
Ⅰ.柠檬酸铁铵的制备
实验步骤:向已加有铁粉的三颈烧瓶中滴加柠檬酸溶液并搅拌,控温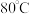 至生成柠檬酸亚铁白色沉淀。降温至
至生成柠檬酸亚铁白色沉淀。降温至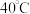 ,滴加一定量的氨水充分反应,生成柠檬酸亚铁铵。继续控温
,滴加一定量的氨水充分反应,生成柠檬酸亚铁铵。继续控温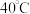 ,缓慢滴加一量的双氧水充分反应,经一系列操作,得到产品。已知:柠檬酸铁铵易溶于水,不溶于乙醇。
,缓慢滴加一量的双氧水充分反应,经一系列操作,得到产品。已知:柠檬酸铁铵易溶于水,不溶于乙醇。 的名称是
的名称是______ 。
(2)控温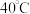 的原因
的原因______ 。
(3)“一系列操作”包括蒸发浓缩、冷却结晶、过滤、______ 、干燥。
Ⅱ.赤血盐的制备
用 在
在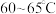 氧化黄血盐
氧化黄血盐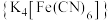 制备赤血盐
制备赤血盐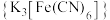 的装置如下图所示(夹持装置略)。
的装置如下图所示(夹持装置略)。______ ,装置B中试剂是______ 。
(5)反应结束后通入 一段时间的目的
一段时间的目的______ 。
(6)黄血盐会被酸性高锰酸钾彻底氧化为 和
和 ,用离子方程式说明不用酸性高锰酸钾制备赤血盐的原因
,用离子方程式说明不用酸性高锰酸钾制备赤血盐的原因______ 。
Ⅲ.普鲁士蓝的制备及应用
在紫外光作用下柠檬酸铁铵中的三价铁离子被还原为二价铁离子,再与赤血盐反应,进行电子转移后生成相对稳定的普鲁士蓝。酸化后的普鲁士蓝加双氧水可处理氨氮废水(主要含 ),原理如下:
),原理如下:
ⅰ.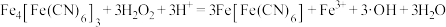
ⅱ. 将氨氮氧化为
将氨氮氧化为
(7)用实验制得的普鲁士蓝处理某氨氮废水,收集到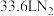 (已折成标准状况)。实验中消耗的
(已折成标准状况)。实验中消耗的 的质量至少为
的质量至少为______ g。
Ⅰ.柠檬酸铁铵的制备
实验步骤:向已加有铁粉的三颈烧瓶中滴加柠檬酸溶液并搅拌,控温
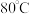 至生成柠檬酸亚铁白色沉淀。降温至
至生成柠檬酸亚铁白色沉淀。降温至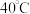 ,滴加一定量的氨水充分反应,生成柠檬酸亚铁铵。继续控温
,滴加一定量的氨水充分反应,生成柠檬酸亚铁铵。继续控温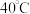 ,缓慢滴加一量的双氧水充分反应,经一系列操作,得到产品。已知:柠檬酸铁铵易溶于水,不溶于乙醇。
,缓慢滴加一量的双氧水充分反应,经一系列操作,得到产品。已知:柠檬酸铁铵易溶于水,不溶于乙醇。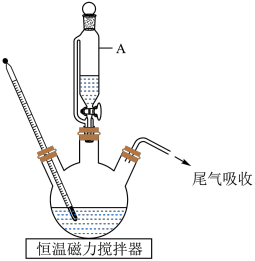
 的名称是
的名称是(2)控温
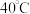 的原因
的原因(3)“一系列操作”包括蒸发浓缩、冷却结晶、过滤、
Ⅱ.赤血盐的制备
用
 在
在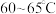 氧化黄血盐
氧化黄血盐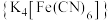 制备赤血盐
制备赤血盐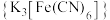 的装置如下图所示(夹持装置略)。
的装置如下图所示(夹持装置略)。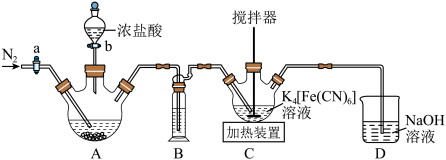
(5)反应结束后通入
 一段时间的目的
一段时间的目的(6)黄血盐会被酸性高锰酸钾彻底氧化为
 和
和 ,用离子方程式说明不用酸性高锰酸钾制备赤血盐的原因
,用离子方程式说明不用酸性高锰酸钾制备赤血盐的原因Ⅲ.普鲁士蓝的制备及应用
在紫外光作用下柠檬酸铁铵中的三价铁离子被还原为二价铁离子,再与赤血盐反应,进行电子转移后生成相对稳定的普鲁士蓝。酸化后的普鲁士蓝加双氧水可处理氨氮废水(主要含
 ),原理如下:
),原理如下:ⅰ.
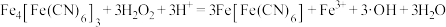
ⅱ.
 将氨氮氧化为
将氨氮氧化为
(7)用实验制得的普鲁士蓝处理某氨氮废水,收集到
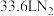 (已折成标准状况)。实验中消耗的
(已折成标准状况)。实验中消耗的 的质量至少为
的质量至少为
您最近半年使用:0次
解题方法
7 . 用锰废料(含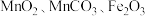 和少量
和少量 )制备
)制备 的工艺流程如下:
的工艺流程如下:
(1)流程中将锰废料粉碎的原因是_________ 。
(2)通入 时,
时, 发生还原反应,此时发生反应的化学方程式为
发生还原反应,此时发生反应的化学方程式为__________ ,能证明“吸收”后上层清液中没有 的试剂为
的试剂为_________ 。
(3)加入 的目的是将
的目的是将 氧化成
氧化成 ,写出“氧化”时的离子方程式
,写出“氧化”时的离子方程式________ ,所得“滤渣”的主要成分为_________ 。
(4)“化浆”操作中,________ (填“能”或“不能”)将稀硫酸换成稀盐酸;
(5)“转化”过程中,只有锰元素变价,则氧化剂与还原剂的物质的量之比为____ 。
(6)“系列操作”是过滤、洗涤、干燥,证明 洗涤干净的操作为
洗涤干净的操作为______ 。
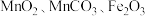 和少量
和少量 )制备
)制备 的工艺流程如下:
的工艺流程如下: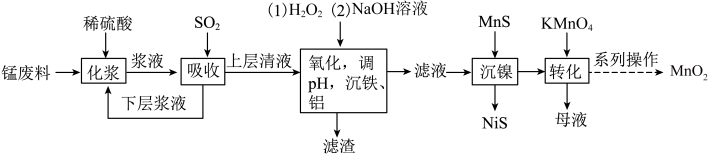
(1)流程中将锰废料粉碎的原因是
(2)通入
 时,
时, 发生还原反应,此时发生反应的化学方程式为
发生还原反应,此时发生反应的化学方程式为 的试剂为
的试剂为(3)加入
 的目的是将
的目的是将 氧化成
氧化成 ,写出“氧化”时的离子方程式
,写出“氧化”时的离子方程式(4)“化浆”操作中,
(5)“转化”过程中,只有锰元素变价,则氧化剂与还原剂的物质的量之比为
(6)“系列操作”是过滤、洗涤、干燥,证明
 洗涤干净的操作为
洗涤干净的操作为
您最近半年使用:0次
名校
8 . 我国成功利用大功率运载火箭发射“天宫二号”空间实验室。火箭推进器中装有还原剂肼(N2H4)(液态)和强氧化剂过氧化氢(H2O2),请回答下列问题:
(1)肼又名联氨,其结构式为_____ 。
(2)液态肼与过氧化氢的反应属于_____ (填“吸热”或“放热”)反应。
(3)写出该火箭推进器中相关反应的化学方程式:_____ 。
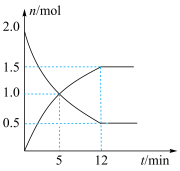
(4)在一定温度下,向0.5L密闭容器中充入2molN2H4和2molO2发生如下反应:N2H4(g)+O2(g)⇌N2(g)+2H2O(g),其中有关物质的物质的量随时间变化的曲线如图所示,请回答下列问题:_____
②下列能说明该反应达到平衡状态的是_____ 。
A.υ正(N2)=2υ逆(H2O)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.体系的压强不再发生变化
D.混合气体的密度不再发生变化
E.每断开1molO=O键,同时断开4molH-O键
③该反应达到平衡时,O2的体积百分数为_____ (结果保留一位小数)
④下列措施能够增大正反应的化学反应速率的有( )
A.升高反应温度 B.加入适当的催化剂C.向容器中加入氧气 D.向容器中加入氖气
(5)广泛应用的肼(N2H4)燃料电池属于环境友好型电池,该电池以空气中的氧气作氧化剂,氢氧化钠溶液作电解质,其负极的电极方程式:_____
(1)肼又名联氨,其结构式为
(2)液态肼与过氧化氢的反应属于
(3)写出该火箭推进器中相关反应的化学方程式:
(4)在一定温度下,向0.5L密闭容器中充入2molN2H4和2molO2发生如下反应:N2H4(g)+O2(g)⇌N2(g)+2H2O(g),其中有关物质的物质的量随时间变化的曲线如图所示,请回答下列问题:
②下列能说明该反应达到平衡状态的是
A.υ正(N2)=2υ逆(H2O)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.体系的压强不再发生变化
D.混合气体的密度不再发生变化
E.每断开1molO=O键,同时断开4molH-O键
③该反应达到平衡时,O2的体积百分数为
④下列措施能够增大正反应的化学反应速率的有
A.升高反应温度 B.加入适当的催化剂C.向容器中加入氧气 D.向容器中加入氖气
(5)广泛应用的肼(N2H4)燃料电池属于环境友好型电池,该电池以空气中的氧气作氧化剂,氢氧化钠溶液作电解质,其负极的电极方程式:
您最近半年使用:0次
名校
解题方法
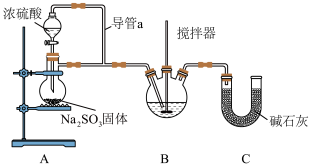
9 . 亚硝酰硫酸(HOSO3NO,相对分子质量为127)是一种浅黄色或蓝紫色液体,能溶于浓硫酸,与水反应,主要用于印染、医药领域的重氮化反应中替代亚硝酸钠。实验室用下图所示装置(部分夹持装置略)制备少量HOSO3NO,并测定产品纯度。_____ 。
(2)装置B中浓硝酸与SO2在浓硫酸作用下反应制得HOSO3NO。
①制备反应的化学方程式为_____ 。
②开始时反应缓慢,待生成少量HOSO3NO后,温度变化不大,但反应速率明显加快,其原因可能是_____ 。
(3)该实验装置存在可能导致HOSO3NO产量降低的缺陷是_____ ,装置C的作用是_____ 。
(4)已知亚硝酸不稳定,易分解:2HNO2=NO2↑+NO↑+H2O。写出HOSO3NO与水发生反应生成硫酸的化学方程式_____ 。
(5)测定HOSO3NO的纯度:
准确称取1.58g产品放入250mL碘量瓶中,加入40.00mL0.1000mol•L-1KMnO4溶液(已用稀硫酸酸化)恰好完全反应。
已知:2KMnO4+5HOSO3NO+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
①上述反应中,HOSO3NO体现了_____ (填“氧化”或“还原”)性。
②样品中亚硝酰硫酸的质量分数为_____ (计算结果保留一位小数)。
(2)装置B中浓硝酸与SO2在浓硫酸作用下反应制得HOSO3NO。
①制备反应的化学方程式为
②开始时反应缓慢,待生成少量HOSO3NO后,温度变化不大,但反应速率明显加快,其原因可能是
(3)该实验装置存在可能导致HOSO3NO产量降低的缺陷是
(4)已知亚硝酸不稳定,易分解:2HNO2=NO2↑+NO↑+H2O。写出HOSO3NO与水发生反应生成硫酸的化学方程式
(5)测定HOSO3NO的纯度:
准确称取1.58g产品放入250mL碘量瓶中,加入40.00mL0.1000mol•L-1KMnO4溶液(已用稀硫酸酸化)恰好完全反应。
已知:2KMnO4+5HOSO3NO+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4。
①上述反应中,HOSO3NO体现了
②样品中亚硝酰硫酸的质量分数为
您最近半年使用:0次
名校
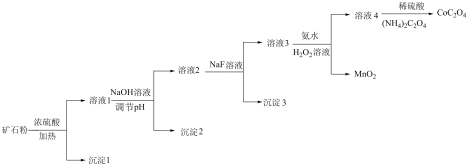
10 . 某钴矿石的主要成分有CoO、Co2O3、MnO、Fe2O3、MgO和SiO2,由该矿石粉制备CoC2O4固体的方法如下(部分催化剂已略)。
(1)原料钴矿石反应前需进行预处理,将钴矿石粉碎成粉末的作用是:_____ 。
(2)加入浓硫酸的目的是将金属氧化物转化为离子的形式,加热时发生的离子反应至少有_____ 个。
(3)沉淀1主要成分的化学式为:_____ 。
(4)向溶液1中加入NaOH溶液,将Fe3+转化为Fe(OH)3沉淀,应调节pH至少大于_____ 。
(5)向溶液2中加入NaF溶液,去除的离子是_____ 。
(6)向溶液3中加入氨水和过氧化氢溶液的目的是氧化,将Co2+转化为Co(NH3)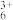 。其反应的离子方程式为:
。其反应的离子方程式为:_____ 。
(7)溶液4中,若将1molCo3+全部转化为CoC2O4沉淀,需要消耗(NH4)2C2O4_____ mol。
| Fe3+ | Fe2+ | Mg2+ | Mn2+ | Co2+ | |
| 开始沉淀时 | 1.5 | 6.3 | 8.9 | 8.2 | 7.4 |
| 完全沉淀时 | 2.8 | 8.3 | 10.9 | 10.2 | 9.4 |
(2)加入浓硫酸的目的是将金属氧化物转化为离子的形式,加热时发生的离子反应至少有
(3)沉淀1主要成分的化学式为:
(4)向溶液1中加入NaOH溶液,将Fe3+转化为Fe(OH)3沉淀,应调节pH至少大于
(5)向溶液2中加入NaF溶液,去除的离子是
(6)向溶液3中加入氨水和过氧化氢溶液的目的是氧化,将Co2+转化为Co(NH3)
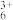 。其反应的离子方程式为:
。其反应的离子方程式为:(7)溶液4中,若将1molCo3+全部转化为CoC2O4沉淀,需要消耗(NH4)2C2O4
您最近半年使用:0次



