用锰废料(含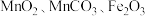 和少量
和少量 )制备
)制备 的工艺流程如下:
的工艺流程如下:
(1)流程中将锰废料粉碎的原因是_________ 。
(2)通入 时,
时, 发生还原反应,此时发生反应的化学方程式为
发生还原反应,此时发生反应的化学方程式为__________ ,能证明“吸收”后上层清液中没有 的试剂为
的试剂为_________ 。
(3)加入 的目的是将
的目的是将 氧化成
氧化成 ,写出“氧化”时的离子方程式
,写出“氧化”时的离子方程式________ ,所得“滤渣”的主要成分为_________ 。
(4)“化浆”操作中,________ (填“能”或“不能”)将稀硫酸换成稀盐酸;
(5)“转化”过程中,只有锰元素变价,则氧化剂与还原剂的物质的量之比为____ 。
(6)“系列操作”是过滤、洗涤、干燥,证明 洗涤干净的操作为
洗涤干净的操作为______ 。
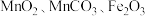 和少量
和少量 )制备
)制备 的工艺流程如下:
的工艺流程如下: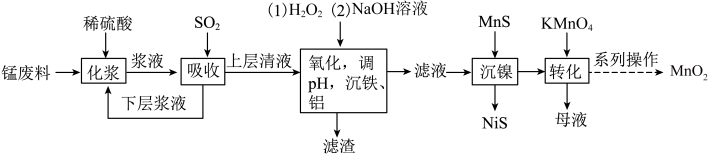
(1)流程中将锰废料粉碎的原因是
(2)通入
 时,
时, 发生还原反应,此时发生反应的化学方程式为
发生还原反应,此时发生反应的化学方程式为 的试剂为
的试剂为(3)加入
 的目的是将
的目的是将 氧化成
氧化成 ,写出“氧化”时的离子方程式
,写出“氧化”时的离子方程式(4)“化浆”操作中,
(5)“转化”过程中,只有锰元素变价,则氧化剂与还原剂的物质的量之比为
(6)“系列操作”是过滤、洗涤、干燥,证明
 洗涤干净的操作为
洗涤干净的操作为
更新时间:2024-05-09 20:40:51
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某化学研究小组以铜为电极电解饱和食盐水,探究过程如下:
【实验1】:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。

【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两
支小试管中,以后的操作和现象如下:
阅读资料:常见铜的化合物颜色如下:
请回答下列问题:
(1)铜的常见正化合价为________ 、_______ ,最终试管底部橙黄色沉淀的化学式___________ 。
(2) 电解开始30s内,阴极上发生的反应为:_________ 、阳极上发生的反应为:___________ 。
(3)写出实验2中①、②的离子方程式:①_______________ ;②___________________ 。
【实验1】:如右下图装置,电源接通后,与电池负极相连的铜丝上有大量气泡产生;与电池正极相连的铜丝由粗变细。电解开始30s内,阳极附近出现白色浑浊,然后开始出现橙黄色浑浊,此时测定溶液的pH约为10。随着沉淀量的逐渐增加,橙黄色沉淀慢慢聚集在试管底部,溶液始终未出现蓝色。

【实验2】:将实验1中试管底部的橙黄色沉淀取出,分装在两
支小试管中,以后的操作和现象如下:
| 序号 | 操作 | 现象 |
| ① | 滴入稀硝酸溶液 | 沉淀溶解,有无色气泡产生,最终得到蓝色溶液。 |
| ② | 滴入稀硫酸溶液 | 橙黄色沉淀转变为紫红色不溶物,溶液呈现蓝色 |
| 物质 | 颜色 | 物质 | 颜色 |
| 氯化铜 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 氢氧化亚铜(不稳定) | 橙黄色 |
| 碱式氯化铜 | 绿色 | 氢氧化铜 | 蓝色 |
| 氧化亚铜 | 砖红色或橙黄色 | 氯化亚铜 | 白色 |
请回答下列问题:
(1)铜的常见正化合价为
(2) 电解开始30s内,阴极上发生的反应为:
(3)写出实验2中①、②的离子方程式:①
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某实验小组对 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。
【查阅资料】i. 在酸性条件下发生反应:
在酸性条件下发生反应: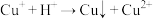 (未配平);
(未配平);
ii.氧化性: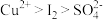 ;
;
iii.部分含铜物质的性质如下表:
【实验准备】用亚硫酸钠固体配制 溶液:
溶液:
(1)实验用到的玻璃仪器有烧杯、量筒、玻璃棒、___________ (填仪器名称),检验亚硫酸钠溶液在空气中是否变质所需的试剂为___________ 。
【合理预测】
(2)上表“预测1”中的实验现象为_______ 。“预测2”中反应的离子方程式为________ 。
【实验探究】
实验1:

经合理分析推测实验1中沉淀的组成:
(3)探究该橙黄色沉淀的组成:
①利用控制变量法测定其组成需要消除溶液中 的影响,应使用溶液(填化学式)代替实验1中
的影响,应使用溶液(填化学式)代替实验1中 溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
某小组同学为验证橙黄色沉淀的组成,分别进行以下实验:
②取洗涤干净后的橙黄色沉淀用稀硫酸溶解,若观察到___________ 的实验现象,可推出橙黄色沉淀中一定含有+1价的铜元素。
③
该实验现象___________ (填“能”或“不能”)证明橙黄色沉淀中含有 和
和 。
。
 溶液与
溶液与 溶液的反应进行探究。
溶液的反应进行探究。【查阅资料】i.
 在酸性条件下发生反应:
在酸性条件下发生反应: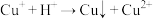 (未配平);
(未配平);ii.氧化性:
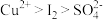 ;
;iii.部分含铜物质的性质如下表:
| 物质 |  | 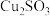 |  | 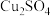 |
| 难溶于水的固体 | 可溶于水的固体 | |||
| 颜色 | 绿色 | 红色 | 白色 | 灰色 |
 溶液:
溶液:(1)实验用到的玻璃仪器有烧杯、量筒、玻璃棒、
【合理预测】
| 实验现象(不需要填写溶液颜色变化) | 反应类型 | |
| 预测1 | ___________ | 复分解反应 |
| 预测2 | 生成红色沉淀 | 氧化还原反应 |
| 预测3 | 生成白色沉淀 |
(2)上表“预测1”中的实验现象为
【实验探究】
实验1:

经合理分析推测实验1中沉淀的组成:
| 白色沉淀 | 橙黄色沉淀 |
 | 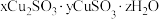 |
(3)探究该橙黄色沉淀的组成:
①利用控制变量法测定其组成需要消除溶液中
 的影响,应使用溶液(填化学式)代替实验1中
的影响,应使用溶液(填化学式)代替实验1中 溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。
溶液进行实验,生成橙黄色沉淀一段时间后沉淀颜色不变。某小组同学为验证橙黄色沉淀的组成,分别进行以下实验:
②取洗涤干净后的橙黄色沉淀用稀硫酸溶解,若观察到
③

该实验现象
 和
和 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】镍、钴、铈、铬虽然不是中学阶段常见的金属元素,但在工业生产中有着重要的作用.

(1)二氧化铈 是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.
是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用. 在稀硫酸和
在稀硫酸和 的作用下可生成
的作用下可生成 ,
, 在该反应中作
在该反应中作 ______  填“氧化”“还原”
填“氧化”“还原” 剂,每有1mol
剂,每有1mol  参加反应,转移电子的物质的量为
参加反应,转移电子的物质的量为 ______ .
(2)某锂离子电池含 导电固体为电解质.充电时,
导电固体为电解质.充电时, 还原为Li,并以原子形式嵌入电极材料碳
还原为Li,并以原子形式嵌入电极材料碳 中,以
中,以 表示,电池反应为
表示,电池反应为 则放电时,电池的正极反应式为
则放电时,电池的正极反应式为 ______ ,图1表示该装置工作时电子和离子的移动方向,此时该电池处于 ______  填“放电”或“充电”
填“放电”或“充电” 状态.
状态.
(3)自然界Cr主要以三价Cr和六价Cr的形式存在.六价Cr能引起细胞的突变和癌变.可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:______ 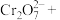
______ 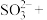
______ 
______ 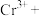
______ 
______ ,_____________
(4) 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣 除含镍外,还含有Cu、Zn、Fe等元素
除含镍外,还含有Cu、Zn、Fe等元素 为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去
为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去 的离子方程式为
的离子方程式为 ______ .
②向滤液Ⅱ中加入 ,溶液中发生反应的离子方程式为
,溶液中发生反应的离子方程式为 ______ ,调节pH的目的是 ______ .
③滤液Ⅲ溶质的主要成分是 ,再加入碳酸钠过滤后,加稀硫酸溶解又生成
,再加入碳酸钠过滤后,加稀硫酸溶解又生成 的目的是
的目的是 ______ .
④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作______ 极.

(1)二氧化铈
 是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用.
是一种重要的稀土氧化物,在平板电视显示屏中有着重要的应用. 在稀硫酸和
在稀硫酸和 的作用下可生成
的作用下可生成 ,
, 在该反应中作
在该反应中作  填“氧化”“还原”
填“氧化”“还原” 剂,每有1mol
剂,每有1mol  参加反应,转移电子的物质的量为
参加反应,转移电子的物质的量为 (2)某锂离子电池含
 导电固体为电解质.充电时,
导电固体为电解质.充电时, 还原为Li,并以原子形式嵌入电极材料碳
还原为Li,并以原子形式嵌入电极材料碳 中,以
中,以 表示,电池反应为
表示,电池反应为 则放电时,电池的正极反应式为
则放电时,电池的正极反应式为  填“放电”或“充电”
填“放电”或“充电” 状态.
状态. (3)自然界Cr主要以三价Cr和六价Cr的形式存在.六价Cr能引起细胞的突变和癌变.可以用亚硫酸钠将其还原为三价铬,完成并配平下列离子方程式:
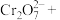
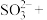

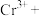

(4)
 是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣
是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣 除含镍外,还含有Cu、Zn、Fe等元素
除含镍外,还含有Cu、Zn、Fe等元素 为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去
为原料获得.操作步骤如图2:向滤液Ⅰ中加入FeS主要目的是除去Cu、Zn等杂质,①除去 的离子方程式为
的离子方程式为 ②向滤液Ⅱ中加入
 ,溶液中发生反应的离子方程式为
,溶液中发生反应的离子方程式为 ③滤液Ⅲ溶质的主要成分是
 ,再加入碳酸钠过滤后,加稀硫酸溶解又生成
,再加入碳酸钠过滤后,加稀硫酸溶解又生成 的目的是
的目的是 ④我国第五套人民币中的一元硬币材料为钢芯镀镍,镀镍时,镍应作
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】已知A、B、C、D是中学化学常见物质,它们之间存在如下转化关系:A+B→C+D+H2O(没有配平)。发生的反应可以是固体之间的反应,也可以是在水溶液中进行的反应,请按要求填空:
(1)若A为黑色固体非金属单质,与B的浓溶液共热时,产生C、D两种气体,C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是___________ ;下列溶液不能够区分这两种气体是___________ (填序号)。
①氯化钙溶液 ②品红溶液 ③KMnO4酸性溶液 ④氯水
其中气体C有刺激性气味,工业生产向燃煤中加入适量生石灰可减少它的排放,产物可作建筑材料,有关反应的化学方程式是___________ 。
(2)若A为非金属气体单质,B在水中的溶解度随温度升高而降低,其中D是漂白粉的有效成分,则该反应的化学方程式是___________ 。
(3)若A为紫红色金属,D为红棕色气体,则该反应的离子方程式是___________ 。
(4)若A.B为固体,气体C能使湿润的红色石蕊试纸变蓝,实验室常用此反应制备C气体,该反应的化学方程式为___________ ;列举C的一种用途:___________ 。
(1)若A为黑色固体非金属单质,与B的浓溶液共热时,产生C、D两种气体,C、D两种气体均能使澄清石灰水变浑浊,则该反应的化学方程式是
①氯化钙溶液 ②品红溶液 ③KMnO4酸性溶液 ④氯水
其中气体C有刺激性气味,工业生产向燃煤中加入适量生石灰可减少它的排放,产物可作建筑材料,有关反应的化学方程式是
(2)若A为非金属气体单质,B在水中的溶解度随温度升高而降低,其中D是漂白粉的有效成分,则该反应的化学方程式是
(3)若A为紫红色金属,D为红棕色气体,则该反应的离子方程式是
(4)若A.B为固体,气体C能使湿润的红色石蕊试纸变蓝,实验室常用此反应制备C气体,该反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】黄铁矿的主要成分是FeS2,其中含有一定量的铜、钴等金属。某工厂在传统回收工艺的基础上进一步改进焙烧方式,研究出高效利用硫铁矿资源的工艺如下:
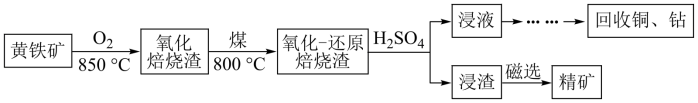
(1)黄铁矿焙烧之前需要粉碎,其目的是:_______
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是 ,反应的化学方程式为:
,反应的化学方程式为:_______ ;
②制硫酸工艺中涉及反应2SO2+O2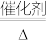 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是_______ 。
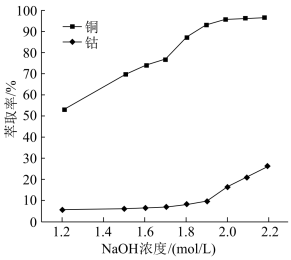
(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为_______ (填化学式);浸液通过加入萃取剂可实现铜和钴的分离,在萃取前加入NaOH溶液乳化可提高分离效率,不同浓度的溶液对萃取率的影响如图,则NaOH溶液最佳的浓度为_______ 。
已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为_______ (结果保留三位有效数字)。

(1)黄铁矿焙烧之前需要粉碎,其目的是:
(2)①黄铁矿的氧化焙烧是制硫酸工艺的重要一步,其产物之一是
 ,反应的化学方程式为:
,反应的化学方程式为:②制硫酸工艺中涉及反应2SO2+O2
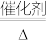 2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是
2SO3 ΔH<0,该反应需将温度控制在400-500℃,温度不宜过低的原因是(3)用硫酸浸取后的浸渣能用磁选法分离,则该氧化物为

已知黄铁矿氧化焙烧前后主要元素质量分数如表,为测定铜的浸出率,取50 g焙烧后的烧渣,经处理后测得Cu2+物质的量为5×10-3 mol,则铜离子的浸出率为
| 项目 | Fe | S | Cu | Co |
| 焙烧前(%) | 40.28 | 42.55 | 0.53 | 0.022 |
| 焙烧后(%) | 53.08 | 0.96 | 0.76 | 0.047 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】某化学小组制备 ,并验证
,并验证 的部分性质,装置如图(部分夹持装置省略)所示。
的部分性质,装置如图(部分夹持装置省略)所示。

回答下列问题:
(1)仪器a的名称为_______ ;A中反应的化学方程式为_______ 。
(2)体现 氧化性的实验现象是
氧化性的实验现象是_______ ;证明 具有漂白性的现象是
具有漂白性的现象是_______ 。
(3)C中反应的离子方程式为_______ 。
(4)实验观察到E装置试剂瓶内有白色沉淀生成,反应的离子方程式为_______ ;b中的试剂为_______ ;反应结束后通入 的目的是
的目的是_______ 。
 ,并验证
,并验证 的部分性质,装置如图(部分夹持装置省略)所示。
的部分性质,装置如图(部分夹持装置省略)所示。
回答下列问题:
(1)仪器a的名称为
(2)体现
 氧化性的实验现象是
氧化性的实验现象是 具有漂白性的现象是
具有漂白性的现象是(3)C中反应的离子方程式为
(4)实验观察到E装置试剂瓶内有白色沉淀生成,反应的离子方程式为
 的目的是
的目的是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】以黄铁矿为原料制硫酸产生的硫酸渣中含 、
、 、
、 、
、 等杂质。现以硫酸渣制备铁红(
等杂质。现以硫酸渣制备铁红( )的过程如下:
)的过程如下:
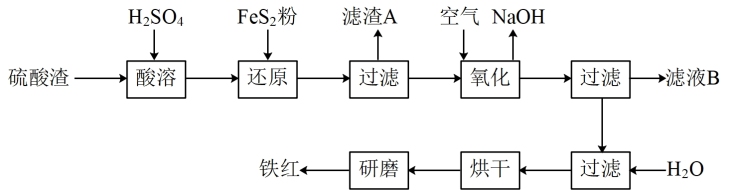
请回答下列问题:
(1) 中硫元素化合价为
中硫元素化合价为_______ ,滤渣A的名称为_______ 。
(2)酸溶时,粉碎硫酸渣的目的是____ ,酸溶过程中,溶解 的离子方程式是
的离子方程式是____ 。
(3)配平下列离子方程式:_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(4)检验铁红中铁元素的实验方法是_______ 。
(5)现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为_______ %。
 、
、 、
、 、
、 等杂质。现以硫酸渣制备铁红(
等杂质。现以硫酸渣制备铁红( )的过程如下:
)的过程如下:
请回答下列问题:
(1)
 中硫元素化合价为
中硫元素化合价为(2)酸溶时,粉碎硫酸渣的目的是
 的离子方程式是
的离子方程式是(3)配平下列离子方程式:
_______
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(4)检验铁红中铁元素的实验方法是
(5)现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为
您最近一年使用:0次
【推荐2】某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示:
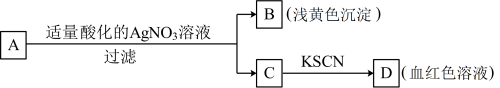
已知硝酸能将Fe2+氧化为Fe3+。回答下列问题:
(1) A可能是________________ ;
(2) B的化学式是______________ ,D的化学式是____________ ;
(3)滤液C中一定含有的阳离子Fe3+是____________ 。

已知硝酸能将Fe2+氧化为Fe3+。回答下列问题:
(1) A可能是
(2) B的化学式是
(3)滤液C中一定含有的阳离子Fe3+是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】钪(Sc)是一种稀土金属。从钛白酸性废水(主要含Ti、Fe2+,微量Sc)中富集钪,并制备氧化钪(Sc2O3)的工艺流程如下。
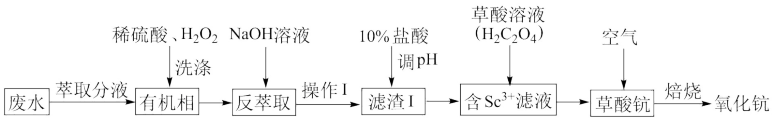
回答下列问题:
(1)“有机相”中主要含有Ti4+、Fe2+、Sc3+,酸洗时加入H2O2的目的是___________ ;
(2)在实验室中,“操作1”需要的玻璃仪器有烧杯、___________ ,“滤渣1”的主要成分是Ti(OH)4、___________
(3)调pH的目的是___________ ;检验“含Sc3+“滤液”中是否含Fe3+的操作为___________ 。
(4)写出草酸钪焙烧时反应的化学方程式___________
(5)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上能生产含85%氧化钪的产品最多___________ kg。

回答下列问题:
(1)“有机相”中主要含有Ti4+、Fe2+、Sc3+,酸洗时加入H2O2的目的是
(2)在实验室中,“操作1”需要的玻璃仪器有烧杯、
(3)调pH的目的是
(4)写出草酸钪焙烧时反应的化学方程式
(5)钛白酸性废水中Sc3+含量10.0~20.0mg·L-1,该工艺日处理钛白酸性废水50.0m3,理论上能生产含85%氧化钪的产品最多
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
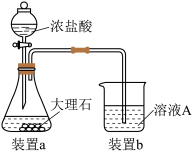
【推荐1】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。

请回答:
(1)写出步骤Ⅱ中生成固体C的离子方程式:______ 。步骤Ⅲ中试剂X是_____
(2)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是______ 。
(3)用固体F制备CuSO4溶液,可设计如图三种途径:
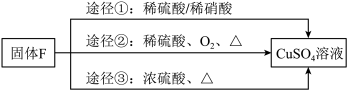
写出途径②中反应的化学方程式:______ 。
(4)用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为__________ 。

请回答:
(1)写出步骤Ⅱ中生成固体C的离子方程式:
(2)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是

(3)用固体F制备CuSO4溶液,可设计如图三种途径:

写出途径②中反应的化学方程式:
(4)用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
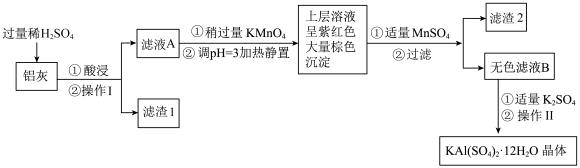
(1)明矾净水的原理是____________ (用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________ 、过滤、__________ 、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________ (只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________ ,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________ ,滤渣2含有的物质是_______________ 。

(1)明矾净水的原理是
(2)操作Ⅱ是蒸发浓缩、
(3)检验滤液A中是否存在Fe2+的试剂是
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】I.某学生在实验室用质量分数为98.0%、密度为1.84g·ml-1的浓硫酸配制物质的量浓度为1.84 mol·L-1的稀硫酸90mL。
(1)需用量筒量取浓硫酸______ mL。
(2)配制溶液时需用到的实验仪器除烧杯、量筒、胶头滴管外,还必需用到的玻璃仪器有______ 。
(3)下列操作会导致所配溶液的浓度偏高的是______ 。
a.转移溶液时,没有洗涤烧杯
b.未把硫酸溶液冷却至室温转移到容量瓶,加水定容
c.定容时仰视
d.定容时俯视
II.下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于模拟工业上用98.3%的浓硫酸吸收三氧化硫制硫酸。

试填写下列空白:
(1)上图装置中的“乙部分“相当于工业上制备硫酸的设备是______ (填设备名称) 。
(2)在硫酸工业制法中,下列说法正确的是______ (填字母) 。
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需要使用催化剂,因为它可以提高SO2转化为SO3的反应速率
D. SO3用 98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高SO3的吸收效率
(3)上述实验缺少尾气处理装置,你的解决方案是______ (用离子方程式表示)。
(1)需用量筒量取浓硫酸
(2)配制溶液时需用到的实验仪器除烧杯、量筒、胶头滴管外,还必需用到的玻璃仪器有
(3)下列操作会导致所配溶液的浓度偏高的是
a.转移溶液时,没有洗涤烧杯
b.未把硫酸溶液冷却至室温转移到容量瓶,加水定容
c.定容时仰视
d.定容时俯视
II.下图所示的装置是仿照工业制备硫酸的工艺流程设计出来的,用于模拟工业上用98.3%的浓硫酸吸收三氧化硫制硫酸。

试填写下列空白:
(1)上图装置中的“乙部分“相当于工业上制备硫酸的设备是
(2)在硫酸工业制法中,下列说法正确的是
A.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能在空气中燃烧
B.从沸腾炉出来的炉气需要净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需要使用催化剂,因为它可以提高SO2转化为SO3的反应速率
D. SO3用 98.3%的浓硫酸吸收,目的是防止形成酸雾,以提高SO3的吸收效率
(3)上述实验缺少尾气处理装置,你的解决方案是
您最近一年使用:0次



