名校
解题方法
1 . 碲( )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成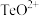 和
和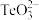 。
。
回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是___________ ;“焙烧”时, 转化为
转化为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)“调 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为___________ ;加入硫酸的量不宜过多,其原因是___________ 。
(4)“还原”时,获得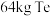 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为___________  ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是___________ (填化学式)。
(5)获得 固体“一系列操作”包含
固体“一系列操作”包含___________ 、过滤、洗涤、干燥。
 )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。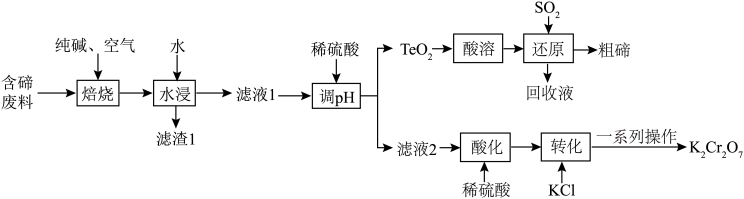
 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成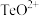 和
和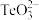 。
。回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
A. | B. | C. | D. |
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是
 转化为
转化为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)“调
 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为(4)“还原”时,获得
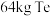 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为 ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是(5)获得
 固体“一系列操作”包含
固体“一系列操作”包含
您最近半年使用:0次
名校
2 . 含硫石油、煤、天然气的燃烧,硫化矿石的熔炼和焙烧,及各种含硫原料的加工生产过程等均能产生二氧化硫。
(1)画出硫原子的原子结构示意图_______ 。
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式_______ ;用该方法制备 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是_______ (填标号),原因是_______ 。 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。
①写出上述反应的离子方程式_______ 。
②该空气样品中 的含量为
的含量为_______  。
。
(4)为了减少二氧化硫产生的危害,可以采取的措施是_______ 。
(1)画出硫原子的原子结构示意图
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式
 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是A. B.
B. C.
C.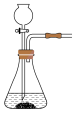 D.
D.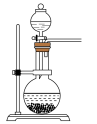
 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。①写出上述反应的离子方程式
②该空气样品中
 的含量为
的含量为 。
。(4)为了减少二氧化硫产生的危害,可以采取的措施是
您最近半年使用:0次
名校
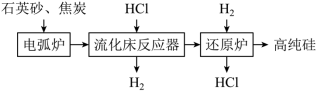
3 . 高纯硅用于制作光伏电池,如图是一种生产高纯硅的工艺流程图: ;
;
②还原炉的主反应: ;
;
③SiHCl3极易水解。回答下列问题:
(1)Si在元素周期表中的位置为________ 。石英砂的主要成分为SiO2,能溶于HF的水溶液,写出其化学方程式________ 。
(2)电弧炉中生成粗硅,反应的化学方程式为________ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为________ 。
(3)整个操作流程都需隔绝空气,原因是________ (答出两条 即可)。
(4)SiHCl3极易发生水解反应,其生成物之一是一种可燃性气体,则SiHCl3水解的化学方程式为________ 。
(5)上述操作流程中可以循环利用的物质是________ 。
 ;
;②还原炉的主反应:
 ;
;③SiHCl3极易水解。回答下列问题:
(1)Si在元素周期表中的位置为
(2)电弧炉中生成粗硅,反应的化学方程式为
(3)整个操作流程都需隔绝空气,原因是
(4)SiHCl3极易发生水解反应,其生成物之一是一种可燃性气体,则SiHCl3水解的化学方程式为
(5)上述操作流程中可以循环利用的物质是
您最近半年使用:0次
名校
解题方法
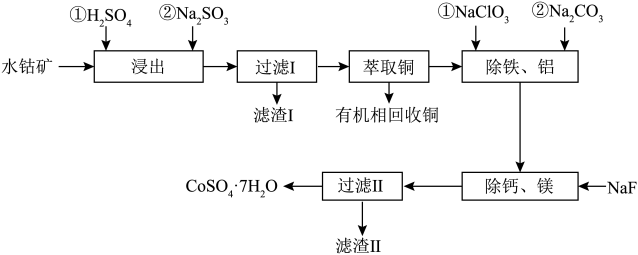
4 . CoSO47H2O有着广泛的应用,可以用作催化剂,用于有机合成反应中;还可以用于电镀、染色、制备颜料等工业应用。一种水钴矿中含SiO2、Co2O3、CuO、FeO、Al2O3、CaO及MgO等,以该水钴矿为原料提取出CoSO4·7H2O的工艺流程如下:
②当离子浓度小于或等于10-5molL-1时认为该离子沉淀完全。
请回答下列问题:
(1)为提高“浸出”速率,可以采取的措施是_______ 写出2条措施即可)。
(2)“浸出”步骤中,Co2O3发生反应的化学方程式为_______ 。
(3)滤渣Ⅰ的成分是_______ (填化学式)。
(4)“除铁、铝”步骤中,除铁时反应过程中氧化剂与还原剂的物质的量之比为_______ ;除铝时同时生成沉淀和气体,则发生反应的离子方程式为_______ 。
(5)“除钙、镁”步骤时,当钙离子和镁离子恰好除尽时,溶液中的氟离子浓度应不低于_______ molL-1。
(6)由“过滤Ⅱ”后的母液得到CoSO47H2O的操作是_______ ,_______ 、过滤、洗涤、干燥。
②当离子浓度小于或等于10-5molL-1时认为该离子沉淀完全。
请回答下列问题:
(1)为提高“浸出”速率,可以采取的措施是
(2)“浸出”步骤中,Co2O3发生反应的化学方程式为
(3)滤渣Ⅰ的成分是
(4)“除铁、铝”步骤中,除铁时反应过程中氧化剂与还原剂的物质的量之比为
(5)“除钙、镁”步骤时,当钙离子和镁离子恰好除尽时,溶液中的氟离子浓度应不低于
(6)由“过滤Ⅱ”后的母液得到CoSO47H2O的操作是
您最近半年使用:0次
名校
5 . CoO可用于制取催化剂,可以由含钴废料(主要成分为Co2O3,还含有少量SiO2、Fe2O3、Al2O3 和MgO)经过如下过程进行制取:
①写出“浸取”时Co2O3所发生反应的离子方程式:___________ 。
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为___________ 。
(2)已知:
①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
补充完整由“浸取液”制取CoC2O4·2H2O的实验方案:取一定量的浸取液,___________ ,过滤,向滤液中滴加2 mol·L-1 (NH4)2C2O4溶液……得到CoC2O4·2H2O晶体(实验中须使用的试剂:2 mol·L-1的氨水、5%的H2O2溶液、K3[Fe(CN)6]溶液、1 mol·L-1的NH4F溶液)。
(3)已知:Ksp(CoC2O4)=4×10-8、Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=5×10-5。
①反应Co2++H2C2O4 CoC2O4↓+2H+的平衡常数为
CoC2O4↓+2H+的平衡常数为___________ 。
②制取CoC2O4·2H2O时使用(NH4)2C2O4溶液而不是Na2C2O4溶液的原因是___________ 。
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol·L-1酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至250 mL。
③取25.00 mL溶液,用0.100 0 mol·L-1 FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数,并写出计算过程___________ 。[已知:M(CoC2O4·2H2O)=183]

①写出“浸取”时Co2O3所发生反应的离子方程式:
②“浸取”时含钴废料、硫酸和Na2SO3溶液混合的方式为
(2)已知:
①氧化性Co3+>H2O2;
②Ksp(MgF2)=6.4×10-11;CoF2可溶于水;Fe3+、Al3+与F-可生成配合物难以沉淀;
③实验条件下金属离子转化为氢氧化物时开始沉淀及沉淀完全的pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Co2+ | Mg2+ | |
| 开始沉淀pH | 1.9 | 3.4 | 6.9 | 6.6 | 9.1 |
| 沉淀完全pH | 3.2 | 4.7 | 8.9 | 9.2 | 11.1 |
(3)已知:Ksp(CoC2O4)=4×10-8、Ka1(H2C2O4)=5×10-2、Ka2(H2C2O4)=5×10-5。
①反应Co2++H2C2O4
 CoC2O4↓+2H+的平衡常数为
CoC2O4↓+2H+的平衡常数为②制取CoC2O4·2H2O时使用(NH4)2C2O4溶液而不是Na2C2O4溶液的原因是
(4)为测定草酸钴样品的纯度,进行如下实验:
①取草酸钴样品3.000 g,加入100.00 mL 0.100 0 mol·L-1酸性KMnO4溶液,加热充分反应至不再有CO2气体产生(该条件下Co2+不被氧化,杂质不参与反应)。
②将溶液冷却,加水稀释定容至250 mL。
③取25.00 mL溶液,用0.100 0 mol·L-1 FeSO4溶液滴定过量的KMnO4,恰好完全反应时消耗18.00 mL FeSO4溶液。计算样品中CoC2O4·2H2O的质量分数,并写出计算过程
您最近半年使用:0次
名校
解题方法
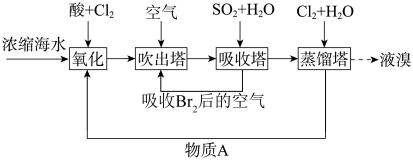
6 . 海洋资源的利用具有广阔的前景。利用空气吹出法从海水中提取溴的流程如图:
(1)“吸收塔”中发生反应的离子方程式为_______ 。
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在_____ (填序号)。
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A_____ (填化学式)可以循环利用。
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的 的百分含量如图:
的百分含量如图: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①结合实际生产,“氧化”的适宜条件为______ 。
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为______ 。
③吸收后的空气进行循环利用,吹出时,吹出塔中 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:______ 。
(1)“吸收塔”中发生反应的离子方程式为
(2)“蒸馏塔”具有将溴单质与水溶液分离的作用,其温度应控制在
A.40∼50℃ B.60∼70℃ C.100℃以上
(3)物质A
(4)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的
 的百分含量如图:
的百分含量如图: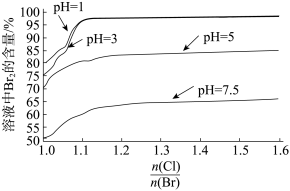
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①结合实际生产,“氧化”的适宜条件为
②海水中溴元素的浓度是64mg/L,经该方法处理后1m3海水最终得到38.4gBr2,则该实验海水中溴元素的提取率为
③吸收后的空气进行循环利用,吹出时,吹出塔中
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示,当
流量的关系如图所示,当 流量过大,
流量过大, 吹出率反而下降,其原因:
吹出率反而下降,其原因:
您最近半年使用:0次
名校
7 . 锌是一种重要的金属,锌及其化合物被广泛应用于汽车、建筑、船舶、电池等行业。现某科研小组以固体废锌催化剂(主要成分是 ,含少量
,含少量 、
、 、
、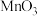 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。
②25℃时,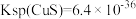 ,
,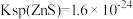
③深度除杂标准:溶液中 ≤2.0×10-6
≤2.0×10-6
(1)“浸取”温度为30℃,锌的浸出率可达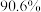 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为___________ 。
(2)“滤渣1”的主要成分为 、
、___________ 。
(3)“深度除锰”是将残留的 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式___________ 。
(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。 加入量最优选择
加入量最优选择___________ (填标号)
A.100% B.110% C.120% D.130%
②由图可知,当 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是___________ (用离子方程式解释)。
(5) 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图:___________ 。
②键角③___________ 120°(填“<”或“=”)。
 ,含少量
,含少量 、
、 、
、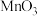 、
、 等杂质)为原料制备锌的工艺流程如图所示:
等杂质)为原料制备锌的工艺流程如图所示: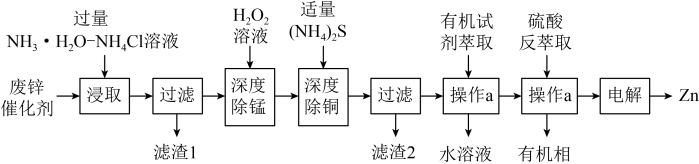
 和
和 转化为
转化为 、
、 进入溶液。
进入溶液。②25℃时,
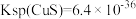 ,
,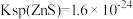
③深度除杂标准:溶液中
 ≤2.0×10-6
≤2.0×10-6(1)“浸取”温度为30℃,锌的浸出率可达
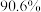 ,继续升温浸出率反而下降,其原因为
,继续升温浸出率反而下降,其原因为(2)“滤渣1”的主要成分为
 、
、(3)“深度除锰”是将残留的
 转化为
转化为 ,写出该过程的离子方程式
,写出该过程的离子方程式(4)“深度除铜”时,锌的最终回收率,除铜效果(用反应后溶液中的铜锌比
 表示)与
表示)与 加入量的关系曲线如图所示。
加入量的关系曲线如图所示。
 加入量最优选择
加入量最优选择A.100% B.110% C.120% D.130%
②由图可知,当
 达到一定量的时候,锌的最终回收率下降的原因是
达到一定量的时候,锌的最终回收率下降的原因是(5)
 原子能形成多种配位化合物,一种锌的配合物结构如图:
原子能形成多种配位化合物,一种锌的配合物结构如图: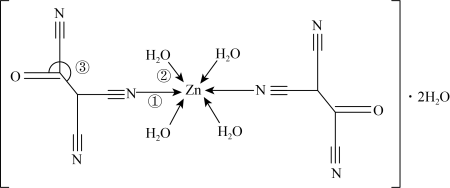
②键角③
您最近半年使用:0次
解题方法
8 . 稀土金属(RE)属于战略性金属,我国的稀土提炼技术位于世界领先地位。一种从废旧磁性材料[主要成分为铈(Ce)、Al、Fe和少量不溶于酸的杂质]中回收稀土金属Ce的工艺流程如图所示。
(1)为提高酸浸的速率,可采取的措施为___________ (写一条即可)。
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为___________ 。
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为___________ ,“滤液2”中铝元素的存在形式为___________ (填化学式)。
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为___________ 。
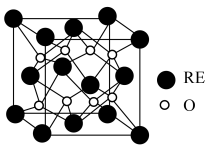
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为___________ ,距离RE原子最近的O原子有___________ 个。若M(晶胞)=Mg/mol,晶胞边长为anm,NA为阿伏加德罗常数的值,则晶胞的密度为___________ g/cm3(列出计算式)。
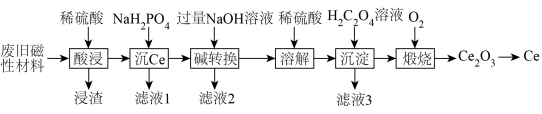
(1)为提高酸浸的速率,可采取的措施为
(2)常温下,“酸浸”后测得溶液中c(Fe2+)=1.0mol/L,c(Ce3+)=0.01mol/L,则“沉Ce”时,为了使Al3+完全沉淀,但不引人Fe(OH)2和Ce(OH)3,需要调节溶液的pH范围为
(3)“碱转换”过程中Ce(H2PO4)所发生反应的离子方程式为
(4)“沉淀”后所得的固体为Ce2(C2O4)3·10H2O,将其煅烧可得Ce2O3和一种无毒的气体,发生反应的化学方程式为
(5)某稀土金属氧化物的立方晶胞如图所示,则该氧化物的化学式为
您最近半年使用:0次
9 . 已知短周期元素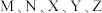 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1) 在元素周期表中的位置是
在元素周期表中的位置是___________ , 元素的离子结构示意图:
元素的离子结构示意图:___________ ,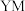 的电子式:
的电子式:___________ 。
(2) 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是___________ (填化学式),原因是___________ 。
(3)在 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 的化合物氮化镓(
的化合物氮化镓(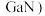 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着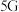 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。(填字母)
a. 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族
b. 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
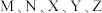 分布在三个周期,
分布在三个周期, 最外层电子数相同,
最外层电子数相同, 原子序数大于
原子序数大于 ,其中
,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中
单质极易与常见无色无味液态物质发生置换反应且作氧化剂,在短周期中 的最高价氧化物对应水化物的碱性最强。回答下列问题:
的最高价氧化物对应水化物的碱性最强。回答下列问题:(1)
 在元素周期表中的位置是
在元素周期表中的位置是 元素的离子结构示意图:
元素的离子结构示意图: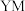 的电子式:
的电子式:(2)
 的简单氢化物熔、沸点更高的是
的简单氢化物熔、沸点更高的是(3)在
 与
与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 的化合物氮化镓(
的化合物氮化镓(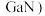 和砷化镓(
和砷化镓( )作为第三代半导体材料,具有耐高温、耐高电压等特性,随着
)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着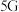 技术的发展,它们的商用价值进入“快车道”。
技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期第ⅣA族
位于元素周期表第四周期第ⅣA族b.
 为门捷列夫预言的“类铝”
为门捷列夫预言的“类铝”c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,放出
的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
10 . 电子工业中,用 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。
(1) 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为___________ 。
(2)废液中加入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 、___________ 。
(3)滤渣为混合物。物质 是
是___________ 。
(4)通入 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为___________ ;工业上通常用双氧水代替 ,这样做的优点是
,这样做的优点是___________ 。
 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。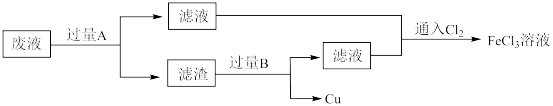
(1)
 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为(2)废液中加入过量
 发生反应的离子方程式为
发生反应的离子方程式为(3)滤渣为混合物。物质
 是
是(4)通入
 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为 ,这样做的优点是
,这样做的优点是
您最近半年使用:0次



